山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)化学反应速率和活化能

实验化学反应速率和活化能 一、实验目的 1.了解浓度、温度和催化剂对化学反应速率的影响。 2.测定过二硫酸钾与碘化钾反应的反应速率,并计算反应级数、反应速率常数 和反应的活化能,练习实验数据的处理和作图方法。 二、实验原理 L.化学反应速率方程及反应级数 在水溶液中过二疏酸钾与碘化钾发生如下反应: KS.0+3KI→2KS0,+KL2 S.0,+3r→2S02+1 (1) 其反应速率ⅴ根据速率方程可表示为: v=kc"(S,O:)c"(I) 式中v是在此条件下反应的瞬时速率。若c(S.0,)、c(I) 是起始浓度,则v表示起始速率。k是速率常数,m与之和是反应级数。 2.化学反应速率测定 实验能测定的速率是在一段时间(△t)内反应的平均速率v。如果在△( =-4cs,0) △1 时间内S.0浓度的改变为△c(S.0,),则平均速率为: 近似地用平均速率代替起始速率。 v=-△cS0,=kcs,0,cr) △M 为了测出△t时间内S.0,的浓度变化量,需要在混合KS.0溶液和 KI溶液的同时,加入一定体积已知浓度的NS.O溶液和淀粉溶液,这样在

反应(1)进行的同时还进行下面的反应: 2S.0,+1→S,0+3r (2) 这个反应进行得非常快,几乎瞬间完成,而反应(1)比反应(2)慢得多。因 此,由反应(1)生成的1立即与S0,反应,生成无色的S,0和T 。所以在反应的开始阶段看不到碘与淀粉反应而显示的特有蓝色。当体系中的 NaS.0,一旦耗尽,反应(1)继续生成的I:就与淀粉反应而呈现出特有的蓝色。 由于从反应开始到蓝色出现标志着$.0,全部耗尽,所以从反应开始到 出现蓝色这段时间△t里,S0,浓度的改变△c(S,0 )实际上就是NaS.O,的起始浓度。 从反应式(1)和(2)可以看出,S0浓度减少量为S.0 △cS,0,*)=fS0 浓度减少量的一半,所以S0在△t时间内浓度减少量可以从下式求得。 对反应速率方程 v=ke"(S,0,2)c"(I-) 两边取对数,得1gv=1gk+mlgc(S.0,)+lg() 同一温度下,固定c(T),改变c(S0求出一系列反应速率v,以 1gv对1gc(S0,)作图,可得一直线,斜率即为m。同理,固定 c(S.0,),以1gv对1gc(I)作图得直线,斜率为n。将m、n和任意 一次实验的一组反应物的初始浓度值代入反应速率方程,就可求得反应 速率常数k。 3.化学反应活化能 根据阿累尼乌斯公式: -28吾哈 测不同温度下的值,可求得活化能E

三、仪器与药品 仪器:量筒(10mL)吸量管(5mL,10mL)温度计(0~100C) 烧杯(100mL,50mL)秒表恒温水浴锅。 药品:0.10mol·LKS.00.10mol·L1KI0.0050mol·L NaS,0,(上述试剂的浓度均要准确,且需新配制的)0.10mol·L'KS0, 0.4%淀粉溶液0.020mol·LCu(N0)20.10mo1·LKN0,冰. 四、实验步骤 1.浓度对化学反应速率的影响 在室温下进行表1中编号1的实验。用吸量管分别量取10.00mL0.10 mol·LKI溶液、4.00l0.0050mol·LaS,0,溶液和2.00mL 0.4%淀粉溶液置于100mL烧杯中混匀。然后用量筒量取10.0mL0.10mol·L KS0溶液,迅速倒入上述混合液中,同时启动秒表,并不断搅动,注意观察溶 液的颜色变化。当溶液刚出现蓝色时,立即按停秒表,记录反应时间和室温。 用同样方法按照表1的用量进行编号2、3、4、5的实验。根据以上实验结果,计 算反应级数和反应速率常数。将结果填入表1。 2.温度对化学反应速率的影响 按表1中实验编号4的药品用量,将装有KI、N阳S.0、KNO和淀粉混合溶液的 烧杯和装有KS,0溶液的小烧杯,放入冰水浴中冷却,待它们的温度冷却到低于 室温10.0℃时,将KS0,溶液迅速加到K1等混合溶液中,同时计时并不断搅拌, 当溶液刚出现蓝色时,记录反应时间。 在高于室温10.0℃的条件下,重复上述实验,记录反应时间。 根据此二次实验数据和实验4的数据,可求出不同温度下的值,计算出反 应的活化能E。将结果填入表2。 3.催化剂对化学反应速率的影响 按表1中实验编号4的用量,把KI、NaS.0、O,和淀粉溶液加到100ml烧杯
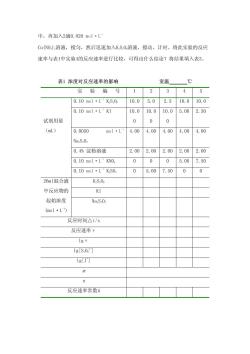
中,再加入2滴0.020mol·L CuNO)溶液,搅匀,然后迅速加入KS0溶液,搅动、计时。将此实验的反应 速率与表1中实验4的反应速率进行比较,可得出什么结论?将结果填入表3。 表1浓度对反应速率的影响 室温 ℃ 实验编号12345 0.10mo1·LKS,0 10.05.0 2.510.010.0 0.10mo1·LK1 10.010.010.05.002.50 试剂用量 0 0 0 (mL) 0.0050 mol·L 4.004.00 4.004.004.00 Na.S.O, 0.4%淀粉溶液 2.002.002.002.002.00 0.10mol·L+KN 0 005.007.50 0.10mo1·LKS0, 0 5.007.5000 26m1混合液 K.S.0 中反应物的 KI 起始浓度 NaS.O (mol·L') 反应时间△t/s 反应速率V 1gv 1gS.0] 1g[T] n 反应速率常数人

表2温度对化学反应速率的影响 实验编号 4 6 反应温度/℃ 反应时间△t/s 反应速率v 反应速率常数k Igk 1/T 活化能E 注:本实验活化能测定值的误差不超过10%(文献值:51.8kJ·mo1) 表3催化剂对化学反应速率的影响 实验编号 4 加入0.02mo1·LCu(N0).的滴数 反应温度/℃ 反应时间△t/s 反应速率v 反应速率V 五、问题与讨论 1.下列操作情况对实验结果有何影响? (1)取用六种试剂的量筒没有分开专用 (2)先加KS.O溶液,最后加KI溶液。 (3)KS.0溶液缓慢加入K1等混合溶液中

2.若不用S0,而用I厂或I 的浓度变化来表示反应速率,则反应速率常数是否一样? 3.为什么根据反应溶液出现蓝色的时间长短来计算反应速率?反应溶液出现蓝 色时反应是否停止了? 4.本实验中NaS0的用量过多或过少,对实验结果有何影响? 注意事项: 1.量筒和吸量管贴好标签专用,试剂瓶盖不能张冠李戴。 2.加入KS0溶液时要迅速,必须同时启动秒表。 3.加试剂时一定要看准试剂瓶和量器的标签要一致,各种试剂的量一定要准确 ,尤其NaS0,溶液的体积
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)分光光度法测定铁含量.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)醋酸电离度和电离平衡常数的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)粗食盐的提纯与检验.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)部分溶液的配制.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)误差分析及数据处理.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)基础化学实验基本常识.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分光光度分析.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)滴定分析法.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)配位化合物结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)原子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电极电位.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)稀溶液的依数性.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学热力学基础.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学反应速率.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)多相离子平衡.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电解质溶液.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)缓冲溶液.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)绪论.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)缓冲溶液的配制与性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)溶液的配制.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)酸碱标准溶液的配制与标定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)胃舒平药片中铝和镁的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)硝酸钾的制备与提纯.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)阳离子混合液和阴离子混合液的分离鉴定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)植物体中某些元素的分离与鉴定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)自来水中氯离子含量的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)化学反应速率和活化能.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)缓冲溶液的配制与性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)缓冲溶液的配制和性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)化学反应速率和活化能的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)乙酸乙酯的制备.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)乙酰水杨酸的制备.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)PBL教学理论教案氢原子结构的玻尔模型.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)基础化学理论教案.pdf
- 山东第一医科大学(泰山医学院):《有机化学》课程教案大纲(打印版)理论教学大纲.pdf
- 山东第一医科大学(泰山医学院):《有机化学》课程教案大纲(打印版)实验教学大纲.pdf
