山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)醋酸电离度和电离平衡常数的测定

实验醋酸电离度和电离平衡常数的测定 一、实验目的 1,学会醋酸电离度和电离常数的测定方法。 2.学习使用酸度计。 3。巩固滴定操作。 二、实验原理 醋酸(CH,C0OH或HAc)是弱电解质,在水溶液中存在下列电离平衡: HAC、→ H,0°+Ac 起始浓度(mol·L)c 0 0 平衡浓度(mol·L)c-ca ca ca 若c为醋酸的起始浓度,a为醋酸的电离度,[H,0门、[AC]、[HAc] 分别为H,0、Ac、HAC的平衡浓度,K为醋酸的电离常数,则 [H0]=[Ac]=ca、[HAc]=c(1-a) 电离度: a=H,01x10% 电离常数:K,-HoL4e】ca[HoT [HAc]1-a c-[H,O'] 已知:pe 1gH,0],所以测定了已知浓度的醋酸溶液的pH值,就可求出它的电离度和电离 平衡常数。 三、仪器与试剂 仪器:容量瓶(50ml)吸量管(10ml)移液管(25ml.)烧杯(50ml) 锥形瓶(250ml)碱式滴定管(50mL)pHS-25型酸度计。 试剂:HAc(0.2mol·L)Na0H标准液(0.2000mol·L)酚酞指示剂。 四、实验内容 1.原始醋酸溶液浓度的标定

用移液管移取25.00mL待标定醋酸溶液置于锥形瓶中,加2一3滴酚酞指示剂 ,用标准NaOH溶液滴定至微红色,且半分钟内不褪色为止。记下所用的NaOI溶 液的体积。再重复上述滴定操作两次,要求三次所消耗Na0H溶液的体积相差小0 .05mL。计算Ac溶液的浓度,将滴定数据和计算结果填入表1中。 2.配制不同浓度的醋酸溶液 用移液管和吸量管吸取25.00mL、5.00mL、2.50mL已测得准确浓度的醋酸溶 液分别置于三个50mL容量瓶中,用蒸馏水稀释至刻度,摇匀,并计算出这三瓶 醋酸溶液的准确浓度。 3.测定不同浓度醋酸溶液的pH值 取以上四种不同浓度的醋酸溶液25.0ml分别加入到4只洁净干燥的50mL烧杯 中,按由稀到浓的次序在pHS- 25型H计上分别测出它们的pH值,记录数据和室温。计算电离度和电离平衡常 数,填入表2中。 表1原始醋酸溶液浓度的标定 用 _mol·L1NaOH标准溶液滴定 mLHAc溶液 滴定序号 1 2 3 初读数 NaOH标准溶液 末读数 的用量(mL) 实际消耗体积 消耗体积平均值 HAc溶液的准确浓度(mo1·L)
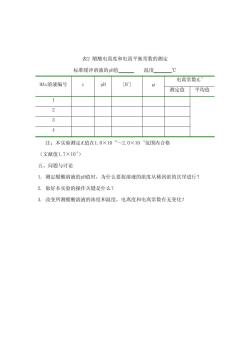
表2醋酸电离度和电离平衡常数的测定 标准缓冲溶液的pH值 温度 ℃ 电离常数K HAC溶液编号 pH [H] 测定值 平均值 1 2 3 4 注:本实验测定K值在1.0×105~2.0×105范围内合格 (文献值1.7×105) 五、问题与讨论 1.测定醋酸溶液的H值时,为什么要按溶液的浓度从稀到浓的次序进行? 2.做好本实验的操作关键是什么? 3.改变所测醋酸溶液的浓度和温度,电离度和电离常数有无变化?
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)粗食盐的提纯与检验.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)部分溶液的配制.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)误差分析及数据处理.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)基础化学实验基本常识.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分光光度分析.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)滴定分析法.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)配位化合物结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)原子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电极电位.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)稀溶液的依数性.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学热力学基础.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学反应速率.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)多相离子平衡.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电解质溶液.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)缓冲溶液.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)绪论.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)基础化学实验教案.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)理论教学大纲(负责人:董建).pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)分光光度法测定铁含量.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)化学反应速率和活化能.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)缓冲溶液的配制与性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)溶液的配制.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)酸碱标准溶液的配制与标定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)胃舒平药片中铝和镁的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)硝酸钾的制备与提纯.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)阳离子混合液和阴离子混合液的分离鉴定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)植物体中某些元素的分离与鉴定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)自来水中氯离子含量的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)化学反应速率和活化能.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)缓冲溶液的配制与性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)缓冲溶液的配制和性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)化学反应速率和活化能的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)乙酸乙酯的制备.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)乙酰水杨酸的制备.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验教案,打印版)PBL教学理论教案氢原子结构的玻尔模型.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)基础化学理论教案.pdf
