山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电解质溶液
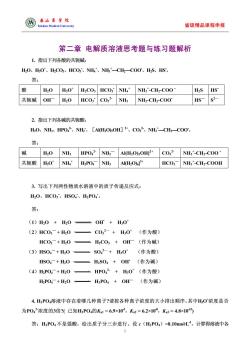
@本山华花 Medieal Universit 省级精品课程申报 第二章电解质溶液思考题与练习题解析 1.指出下列各酸的共轭碱: H,O、H0、H,CO、HCO、NH,、NH-CHCO0、HS、HS 答: H20 H3O*H2CO3 HCO;NH*NH:'-CH:-COO H2S HS 共轭碱OHH,0 HCO,CO,2 NH3 NH2-CH2-CO0 HS-S2- 2.指出下列各碱的共轭酸: HO、NH、HPO2、NH、[AH,OsOH]、CO2、NHCH2COO。 答: H2O NH3 HPO NH2-AI(H2O)sOH"CO NH'-CH2-COO 共轭酸HO'NH H,PO,NHAH,O)HCO,一NHCH-COOH 3.写出下列两性物质水溶液中的质子传递反应式: H2O、HCO3、HSO4、HzPO4 答: (1)H20+H0=OF+H30* (2)HC0,+H0 一C0,2-+H0*(作为酸) HC03+H,0 HCO3+OH(作为碱) (3)HS0:+H0 一S02+0(作为酸) HSO,一+H20= 一HSO4+OH(作为碱) (4)HP0,+H20。 一HPO2+H,0(作为酸〉 H2PO+H2O- -H3PO4 OH (作为碱) 4.HPO溶液中存在者哪几种离子?请按各种离子浓度的大小排出顺序。其中H0浓度是否 为P0:浓度的3倍2(已知HP04的K1=6.9×103,K2=6.2x10,K=4.8×105 答:H3P0,不是强酸,给出质子分三步进行。设c(H,PO4)=0.10moL,计算得溶液中各

圆表山压多乾 iversit 省级精品课程申报 离子浓度由大到小为: 离子 H HPO.2 OH PO 浓度/moL2.6×1r2 2.6×102 6.2×103 3.8×10r31.1×108 可见其中Ⅲ的浓度并不是PO一浓度的3倍 5.HC0,和-HP0:均为两性物质,为什么前者的水溶液呈弱碱性而后者的水溶液呈弱酸 性? 答:两性物质的酸常数比碱常数大,则显酸性;酸常数比碱常数小,则显碱性。 HC03:作为酸K2=4.7x10。 作为碱K2=1.0×101Ka1=1.0×10414.5×10=22×10,K2>K2,所以溶液显弱碱性。 pH=1(pKa+pK)=1(6.37+10.25)=8.31>7(碱性) HP0:作为酸K2=6.2×103。 作为碱K3=1.0x11K1=1.0×106.9x103=1.4×102,K2>K3,所以溶液显弱碱性。 pH=(pK+pK)=1(2.12+7.21)=4.66500 .H0]=K,6=V1.74x105x01mol-L=132×103 pH=2.88 第二杯混合液:加入了100mL0.2 mol-LNHyH20后 产物是NHAC,c(NHAc))=0.1molL,飞N的=令=562x10 K'NH4 c(NH)220K ca /K'>500 07=√K,K,=.74×105×5.62×100=1.00×107moL pH-7.00

@来山手学花 省级精品课程申报 7.实验测得某氨水的pH值为11.26,已知NH,的K。=1.78×105,求氨水的浓度。 解: pH=11.26,p0H=14-11.26=2.74,10H1=1.82×103 (NH)=[NH]-0.181 mobL+ K 1,78×105 8.现有0.20 mol-LHCI溶液,问: (①)如要调整该溶液至pH=4.0,应该加入HAc还是NaAc? (2)如果加入等体积的2.0moL'小NaAc溶液,则混合溶液的pH值是多少? (3)如果加入等体积的2.0 mol-LNaOH溶液,则混合溶液的pH值又是多少? 解: (应加入碱性的NaAc (2)生成0.9 mol-LNaAc和0.10 mol-LHAc, [Ac-] 0.90 pH=5.70 (③)NaOH过量 I0H=0.90moL,p0H=0.046,pH=13.95 9.取0.10moL'HB溶液50.00mL,与0.10moL'K0H溶液20.00mL混合,将混合溶 液加水稀释至100.0mL,测得其pH为5.25,试求此弱酸B)的酸常数。 HB1=010500010x200-30x10-moy s2rn K,-HB1.56102010-37510 HB 3.0×10 10.将0.40moL丙酸HPr)溶液125.0mL,加水稀释至500.0mL,求稀释后溶液的pH值。 (K=138×105) 解:

网来山手学花 省级精品课程申报 c0r)-040x1250-010nal.e H*1=k,=1.38×10-5×0.10m0lL=1.2×10-molL pH=2.9 1.计算下列溶液的pH值 ()0.10 mol-LHC1溶液与0.10 mol-LNH>-H,0等体积混合: (2)0.10moL'HCI溶液与0.10moL'NaCO3溶液等体积混合: (30.10moL'NaOH溶液与0.10 molLNaHCO,溶液等体积混合。 解: ()反应后,产物为NH,CI,cNH,C)=0.050moL [H*]=VK,×cNH)=5.62x10-0×0.050molL=5.3x10-fmo1L pH =5.28 (2)反应后,产物为NaHC0,c(C0)=0.050moL pH=pK,1+pK2)=8.31 (3)反应后,产物是NaC0,cNaC0)=0.050moL 人套2aw K2=Kw/Ka1=1.0×1014/(4.46×107=2.24×10 因K1/K2>102,e(NaCO3)/Kb1>500,故可按最简式计算 [0Hj=√Kb1G=V2.14x10-×0.050m0l-L=3.27×10- pH=11.51 12.通过计算说明: (I)体积和pH值均相同的盐酸溶液和醋酸溶液,分别加入NaOH至反应完全。NaOH的 用量相同吗? (2)体积和浓度均相同的盐酸溶液和醋酸溶液,分别加入NaOH至反应完全。NaOH的用 量相同吗? 解: ()设盐酸和醋酸溶液的pH值均3,体积均为1L,则盐酸和醋酸溶液的H30均为0.001 moL。用cNaO=O.1moL的NaOH中和, 4

@春山季花 省级精品课程申报 ①盐酸溶液,c(HC=Hs01=0.001moL 中和盐酸所用NaOH的量:Na0田=c(HCD)xI(HCD)/cNa0D=0.001×1/0.1=0.01 L=10mL ②醋酸溶液,H0-0.001moL, [H,0]=√K,xc(HAc) 0.001=V1.74×103×cAe),cHAc=0.057 moI-L 中和醋酸所用NaOH的量: /Na0HD=c(HAc)×V1cNa0HD=0.057×1/0.1=0.57L=570ml 所以,两溶液所用NaOH的量不相同 (2)设盐酸和醋酸溶液的浓度均为0.01moL,体积均为1L,用cNaO=0.1moL的 NaOH中和, ①中和盐酸所用NaOH的量: V(NaOH)=c(HCI)xV(HCI)/c(NaOH)=0.01x1/0.1=0.1 L=100 mL ②中和醋酸所用NaOH的量: V(NaOH)=c(HAc)x/(HAc)/c(NaOH)=0.01x1/0.1=0.1 L=100 mL 所以,两溶液所用NaOH的量相同 13.以下叙述正确的是 A.凡是多元弱酸溶液中,其酸根的浓度都等于其最后一级的酸常数。 B.NAc溶液与HC溶液起反应,反应达平衡时,平衡常数等于醋酸的酸常数的倒数。 C.H,CO3溶液中加入NaHCO3后产生同离子效应,往NaHCO3溶液中加入NaCO3不会产生 同离子效应 D室温下1.0×10moL氨水溶液中,水的离子积常数为1.0×101。 答:B 14.下列物质在水中按碱性由弱到强排列的顺序是 A.OH<HPO<NH3 HSO<H2O B.OH<NH3<HPO2<HSO<H2O C.HPO2<OH<NH:<H2O<HSO D.HSO<H2O<HPO<NH:<OH E.HPO<OH<H20<NH3<HSO

@来山多花 省级精品课程申报 答:D 15.HAc在下列哪一种溶液中解离度最大 A.0.1 mol-LNaCI B.0.1 mol-LHCI C.0.1 mol-LNaAc D.纯水 E.0.1 mol-LH2SO 答:A 16.Tt's known that the pK.of HA is 4.20,calculate the [H3O"],pH and [A']of the following solutions: (1)a solution consisted of 0.10 mol-L of HA and 0.20 mol-L of NaA; (2)a solution consisted of 0.10 mol-L of HA and 0.20 mol-L of HCL 0 HA+H20—HO+A 0.10-H00.1moL [H50*]0.20+H07≈0.2moL [HO][A]/[HA]= K=10420=6.31×105 [H0*]=KHA/[A7=(6.31×105×0.10/0.20)molL =3.15x105moL1 pH-4.50A7=0.20 (2) HA H2O HO'+A 0.10-H070.1moL1 H07+0.200.20moL1H07 :[Hr][A]/[HA]=K IA7=KHA/H07=(6.31×105×0.1/0.20moL1 =3.15x105m0lL1 [HsO]=0.20mol-L1 pH=0.70 17.100 mL of 0.010 mol-LNazSO solution was mixed with 100 mL of 0.20 moLKNOs solution,calculate the ionie strength of the mixed solution. 解: 6

@本山季花 省级精品课程申报 ao小-8g-aim eo,)小--ia 1-(NZ(Na+O(O)+(KK)+(NONO)1 =号I0.01×+12+0.005×-2y2+0.10×(+12+0.10x617 =0.115molL 18.100 mL of 0.100 mol-L HA solution was mixed with 50 mL of 0.100 mol-LNaOH solution,the pH of the mixed solution was equal to 5.67.Calculate the proton transfer equilibrium constant of HA. 解: A]=Na0=01050-33x102atH']=100=214x10-a 3.3x10 19.In a solution of NHAc,if c(NHAc)=0.1 mol-L,the concentration of proton would be A.0.IKme B.0.IKxH C.√KHe·KNH D.√Ke"KKNH, E.VKNH·K/KH Answer:D 20.At the temperature of the human body,37C,the value of Kis 2.4x104.Which of the following is right? A.[H]=[OH]=10mol-L B.I7=IOH]=1.55×10'moL C.pH+pOH=14 D.[H']14 >

泰山医学院 Taishan Medical University 省级精品课程申报 Answer:B 21.All of the following are acid-base conjugate pairs EXCEPT A.HONO,NO2 B.H3O,OH C.CH3NH3,CH3NH2 D.HS,S2- E.C6 HsCOOH,C6 HsCOO° Answer:B
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)缓冲溶液.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)绪论.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)基础化学实验教案.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(教案大纲,打印版)理论教学大纲(负责人:董建).pdf
- 花色苷(书籍文献)Anthocyanins,Kevin Gould · Kevin Davies · Chris Winefield,Biosynthesis, Functions, and Applications.pdf
- 单宁化学(书籍文献)Tannin Chemistry.pdf
- 绍兴文理学院:化学化工学院高分子材料与工程专业课程教学大纲汇编.pdf
- 绍兴文理学院:化学化工学院化学专业课程教学大纲汇编.pdf
- 绍兴文理学院:化学化工学院应用化学专业课程教学大纲汇编.pdf
- 三明学院:资源与化工学院材料化学专业课程教学大纲汇编.pdf
- 三明学院:材料化学专业课程教学大纲汇编.pdf
- 三明学院:化学工程与工艺专业课程教学大纲汇编.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Selective inhibition of BET bromodomains.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Personalized medicine in oncology - the future is now.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)GLIVEC(STI571, IMATINIB),A RATIONALLY DEVELOPED,TARGETED ANTICANCER DRUG,Nat Rev Drug Disc 2002.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Epigenetic protein families - a new frontier for drug discovery.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Application of the Three-Dimensional Structures of Protein Target Molecules in Structure-Based Drug Design.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Structural Mechanism for Statin Inhibition of HMG-CoA Reductase.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Structural basis for inhibition of a voltage-gated Ca2+ channel by Ca2+ antagonist drugs.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Prioritization of cancer therapeutic targets using CRISPR–Cas9 screens.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)多相离子平衡.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学反应速率.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)化学热力学基础.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)稀溶液的依数性.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)电极电位.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)原子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分子结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)配位化合物结构.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)滴定分析法.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(习题与解析,打印版)分光光度分析.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)基础化学实验基本常识.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)误差分析及数据处理.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)部分溶液的配制.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)粗食盐的提纯与检验.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)EDTA标准溶液的配制、标定及水的总硬度测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)醋酸电离度和电离平衡常数的测定.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)分光光度法测定铁含量.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)化学反应速率和活化能.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)缓冲溶液的配制与性质.pdf
- 山东第一医科大学(泰山医学院):《基础化学》课程教学资源(实验指导,打印版)溶液的配制.pdf
