《物理化学》课程教学课件(PPT讲稿)总复习

第二章热力学第一定律 基本概念 1系统和环境的划分是人为规定的,不是物质 内部性质所决定的。 例如:金属铜在试管中氧化成氧化铜,然后通 入氢气,使其还原为铜。我们可以规定铜为系统, 此过程为一循环过程;若规定铜和氧气为系统,则 此过程就不是循环过程了。所以在没有划分系统之 前不能谈是什么过程。 2025/4/4 物理化学(B)I
物理化学(B)I 1 2025/4/4 第二章 热力学第一定律 一.基本概念 1.系统和环境的划分是人为规定的,不是物质 内部性质所决定的。 例如:金属铜在试管中氧化成氧化铜,然后通 入氢气,使其还原为铜。我们可以规定铜为系统, 此过程为一循环过程;若规定铜和氧气为系统,则 此过程就不是循环过程了。所以在没有划分系统之 前不能谈是什么过程

又如,一个密封的烧杯,内有水和水蒸气,我 们规定水为系统,那么这是一个敞开系统,若把水 和水蒸气共同做为系统,则是一个封闭系统。 2.恒外压过程和等压过程要区别开 恒外压过程是外压始终不变。 P始P终P环=常数 等压过程是系统压力等于环境压力 P始=P终=P环=常数 2025/4/4 物理化学(B)I
物理化学(B)I 2 2025/4/4 又如,一个密封的烧杯,内有水和水蒸气,我 们规定水为系统,那么这是一个敞开系统,若把水 和水蒸气共同做为系统,则是一个封闭系统。 2.恒外压过程和等压过程要区别开 恒外压过程是外压始终不变。 P始≠P终≠P环=常数 等压过程是系统压力等于环境压力 P始=P终=P环=常数

Kmol,H2,1Pe 1PO 1 mol,H2,1P 273K,22.4dm3 等压过程 546K,44.8dm3 1 mol,H2,2P 0.5Pe mol,H2,1P 1 273K,11.2dm3 恒外压过程 273K,22.4dm3 2025/4/4 物理化学(B)I
物理化学(B)I 3 2025/4/4 1 mol, H2 , 1P 273K, 22.4 dm3 1 mol, H2 , 1P 546K, 44.8 dm3 1 P 等压过程 1 mol, H2 , 2P 273K, 11.2 dm3 1 mol, H2 , 1P 273K, 22.4 dm3 0.5 P 恒外压过程

3.可逆过程与循环过程的区别 可逆过程:某一系统经过某一过程,由状态 1变到状态2之后,如果能使系统和环境都完全复 原(即系统回到原来的状态,同时消除了原来过 程对环境所产生的一切影响),则原来的过程就 称为可逆过程。 循环过程:如果系统由某一状态出发,经过 一系列的变化又回到原来的状态,这样的过程称 为循环过程。它不管环境是否发生了变化。 2025/4/4 物理化学(B)1
物理化学(B)I 4 2025/4/4 3.可逆过程与循环过程的区别 可逆过程:某一系统经过某一过程,由状态 1变到状态2之后,如果能使系统和环境都完全复 原(即系统回到原来的状态,同时消除了原来过 程对环境所产生的一切影响),则原来的过程就 称为可逆过程。 循环过程:如果系统由某一状态出发,经过 一系列的变化又回到原来的状态,这样的过程称 为循环过程。它不管环境是否发生了变化

4.准静态过程与可逆过程有什么不同和联系 区别: 准静态过程只着眼于工质内部的平衡,有无 外部机械摩擦对工质内部的平衡并不影响,准静 态过程进行时可能发生能量耗散; 可逆过程不仅要求工质内部平衡还要求工质 与外界的作用可以无条件的逆复,过程进行时不 存在任何能量的耗散 联系: 可逆过程一定是准静态过程,准静态过程不 定是可逆过程 2025/4/4 物理化学(B)I
物理化学(B)I 5 2025/4/4 4.准静态过程与可逆过程有什么不同和联系 区别: 准静态过程只着眼于工质内部的平衡,有无 外部机械摩擦对工质内部的平衡并不影响,准静 态过程进行时可能发生能量耗散; 可逆过程不仅要求工质内部平衡还要求工质 与外界的作用可以无条件的逆复,过程进行时不 存在任何能量的耗散. 联系: 可逆过程一定是准静态过程,准静态过程不 一定是可逆过程
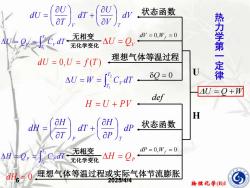
du- dV 状态函数 dV=0,W,=0 热力学 du =0,U f(T) 理想气体等温过程 AU=W-CrdT. 8Q=0 一定律 AU=0+W def H=U+PV H dH dT dP 状态函数 ap AH+Op∫Cdr 无相变 dP=0,W=0 无化学变化 △H=Qp d。=0理想气体等温过程或实际气体节流膨胀 202544 物理化学(B)I
物理化学(B)I 6 2025/4/4 U = Q +W dV V U dT T U dU V T + = 状态函数 dV = 0,Wf = 0 U = QV = = 2 1 T T V V U Q C dT 无相变 无化学变化 d U = 0,U = f (T ) 理想气体等温过程 = = 2 1 T T V U W C dT Q = 0 U dP P H dT T H dH P T + = 状态函数 dP = 0,Wf = 0 H = QP = = 2 1 T T P P H Q C dT 无相变 无化学变化 dH = 0 理想气体等温过程或实际气体节流膨胀 H def H = U + P V 热 力 学 第 一 定 律
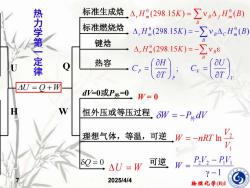
标准生成烙△,H(298.15K)=y△,H(B) 热力学第一定律 标准燃烧格A,H(298.15K)=-∑VAcH(B) 键焓 △,H(298.15K)=-∑ve 热容 Cr= AU=O+W dW=0或P外=0 W=0 H W 恒外压或等压过程δW=-PdW 理想气体,等温,可逆W=-nRTn V 80=0 △U=W 可逆 PV2-PV y-1 2025/4/4 物理化学(B)I
物理化学(B)I 7 2025/4/4 U = Q +W U H 热 力 学 第 一 定 律 Q 标准生成焓 = B r Hm (298.15K) B f Hm (B) 0 0 标准燃烧焓 = − B r H m (298.15K) B C Hm (B) 0 0 键焓 = − B r Hm K B (298.15 ) 0 热容 V V P P T U C T H C = = ; dV=0或P外=0 W = 0 恒外压或等压过程 W = −P外dV 理想气体,等温,可逆 1 2 ln V V W = −nRT Q = 0 U = W 可逆 1 2 2 1 1 − − = P V PV W W

U热力学 0 第一定律 AU=0+W H W Qr与Qy 赫斯定律 基尔霍 绝热可 卡诺 的关系 夫定律 逆过程 循环 OPOr+RTAn SH(E)=AH(T)+AC,dT 方程 n=1+9=1- PVY=K 0, T, 2025/414 物理化学(B)I
物理化学(B)I 8 2025/4/4 U = Q +W U H Q W 热 力 学 第一定律 QP与QV 的关系 赫斯定律 基尔霍 夫定律 绝热可 逆过程 方 程 卡诺 循环 2 1 2 1 1 1 T T Q Q = + = − Q Q RT n P = V + = + 2 1 ( ) ( ) 2 1 T T P H T H T C dT PV = K
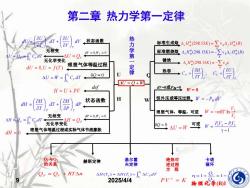
第二章热力学第一定律 dn+u) dW,状态函数 av) 力学 标准生成格△,H(298.15K)=∑Vg△,H(B 无相变 U=y d=0W,=0 标准燃烧楚A,H29815K)=-∑vAcH(B 无化学变化 键焓 dU =0,U=f(T) 理想气体等温过程 定律 →A,228150=25 热容 AU=W=C,dr←0=0 U Cy-OT) ☑U=Q+网- H=U+PV def dW0或P外=D W=0 状态函数 H 恒外压或等压过程、W=-P外dW dP 无相变 理想气体,等温,可逆W=-nRTn骨 △H=e。=Cdr 无化学变化 2=0AU=m可導m=B业-P出 dH=0 理想气体等温过程或实际气体节流膨胀 y-1 Qp与Q 赫斯定律 基尔霍 绝热可 卡诺 的关系 夫定律 逆过程 循环 方程 Op=O ,+RT△n AH(T)-AH(T)+ACdT n=1+g=1- 2025/414 PVY=K 物理化学(B)I
物理化学(B)I 9 2025/4/4 U = Q +W dV V U dT T U dU V T + = 状态函数 dV = 0,Wf = 0 U = QV = = 2 1 T T V V U Q C dT 无相变 无化学变化 dU = 0,U = f (T ) 理想气体等温过程 = = 2 1 T T V U W C dT Q = 0 U dP P H dT T H dH P T + = 状态函数 dP = 0,Wf = 0 H = QP = = 2 1 T T P P H Q C dT 无相变 无化学变化 dH = 0 理想气体等温过程或实际气体节流膨胀 H def H = U + PV 热 力 学 第 一 定 律 Q 标准生成焓 = B r Hm (298.15K) B f Hm (B) 0 0 标准燃烧焓 键焓 = − B r Hm K B (298.15 ) 0 热容 V V P P T U C T H C = = ; dV=0或P外=0 W = 0 恒外压或等压过程 W = −P外 dV 理想气体,等温,可逆 1 2 ln V V W = −nRT Q = 0 U = W 可逆 1 2 2 1 1 − − = P V PV W W = − B r H m (298.15K) B C Hm (B) 0 0 QP = QV + RTn QP与QV 的关系 赫斯定律 基尔霍 夫定律 绝热可 逆过程 方 程 卡诺 循环 2 1 2 1 1 1 T T Q Q = + = − = + 2 1 ( ) ( ) 2 1 T T H T H T CP dT PV = K 第二章 热力学第一定律

第三章小结 1.卡诺定理 所有工作于同温热源和同温冷源之间的热机,其效率 都不能超过可逆机(即卡诺热机),即可逆机的效率最大。 所有工作于同温热源与同温冷源之间的可逆热机, 其热机效率都相等,即与热机的工作物质无关。 7≤7R <不可逆循环 0 - 可逆循环 物理化学(B)I
物理化学(B)I 第三章 小结 1. 卡诺定理 I R I 0 n i i i Q T 所有工作于同温热源和同温冷源之间的热机,其效率 都不能超过可逆机(即卡诺热机),即可逆机的效率最大。 所有工作于同温热源与同温冷源之间的可逆热机, 其热机效率都相等,即与热机的工作物质无关。 < 不可逆循环 = 可逆循环
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)习题_热力学部分.ppt
- 《物理化学》课程教学资源(作业习题)化学势(含参考答案)热力学.doc
- 《物理化学》课程教学课件(PPT讲稿)习题_相平衡习题.ppt
- 《物理化学》课程教学资源(作业习题)化学势(含参考答案).doc
- 《物理化学》课程教学资源(作业习题)化学平衡(含参考答案).doc
- 《有机与药物合成化学》课程教学课件(讲稿)羧酸——关于有机酸的化学.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)羧酸衍生物——羧酸的亲核取代产物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)β-二羰基化合物——活泼亚甲基的反应.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)含氮化合物——有机氮的性质.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)杂元素化合物——含杂元素的有机物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)杂环化合物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)有机化合物官能团引入与碳链增长——含碳氢氧卤素化合物的一般合成(山东科技大学:王鹏).pdf
- 《物理化学》课程教学资源(课堂小测验与解答).doc
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
- 《分析化学》课程教学资源(国家标准)GB-T 8170-2008 数值修约规则与极限数值的表示和判定.pdf
- 《分析化学》课程课后思考题(含答案)第一章.doc
- 《分析化学》课程课后思考题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第六章.doc
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差与数据处理.ppt
- 《物理化学》课程教学课件(PPT讲稿)课程复习_第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第7章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学资源(书籍文献)萤火虫的发光.doc
- 《物理化学》课程教学课件(PPT讲稿)胶体与界面化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础.ppt
- 《物理化学》课程教学资源(学习资料)化合物缩写 V. LIST OF ABBREVIATIONS.pdf
- 《物理化学》课程教学课件(PPT讲稿)表面活性剂 类型.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学势.ppt
- 《物理化学》课程教学资源(实验指导)凝固点降低法测摩尔量.doc
- 《物理化学》课程教学资源(实验指导)双液系气液平衡相图.doc
