《物理化学》课程教学资源(实验指导)凝固点降低法测摩尔量

凝固点降低法测摩尔质量4学时 【目的要求】 1使用凝固点降低法测定萘的摩尔质量。 2.掌握溶液凝固点的测定技术。 3.掌握数字温度温差测量仪器的使用方法。 【预习要求】 1.明确稀溶液依数性的含义 2.了解用凝固点降低法测定溶质摩尔质量的原理和方法。 3.了解温度温差测量仪器的测量原理、使用方法及注意事项。 〖实验原理〗 溶液的凝固点通常指溶剂和溶质不生产固溶体的情况下,固态纯溶剂和液态 溶液成平衡时的温度。当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯 溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即 △T=T-T=K,bB (2-15) 式中,T,为纯溶剂的凝固点:T,为溶液的凝固点,b。为溶液中的溶质B 的质量摩尔浓度:K,为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的 性质有关。 若称取一定的溶质m。(g)和溶剂m,(g),配成稀溶液,则此溶液的质量摩 尔浓度为 b。=m×10 「Mama 式中,M为溶质的分子量。将该式带入式(215),整理得: M.Km10 (2-15) 若已知某溶液的凝固点降低常数K,值,通过实验测定此溶液的凝固点降低 值△T,,即可计算溶质的分子量M。·
凝固点降低法测摩尔质量- 4 学时 〖目的要求〗 1.使用凝固点降低法测定萘的摩尔质量。 2.掌握溶液凝固点的测定技术。 3.掌握数字温度温差测量仪器的使用方法。 〖预习要求〗 1. 明确稀溶液依数性的含义 2.了解用凝固点降低法测定溶质摩尔质量的原理和方法。 3.了解温度温差测量仪器的测量原理、使用方法及注意事项。 〖实验原理〗 溶液的凝固点通常指溶剂和溶质不生产固溶体的情况下,固态纯溶剂和液态 溶液成平衡时的温度。当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯 溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即 T T f T f Kf bB = − = * (2-15) 式中, T f * 为纯溶剂的凝固点; T f 为溶液的凝固点, bB 为溶液中的溶质 B 的质量摩尔浓度; K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的 性质有关。 若称取一定的溶质 mB (g) 和溶剂 mA (g) ,配成稀溶液,则此溶液的质量摩 尔浓度为 10−3 = M m m b B A B B 式中, M B 为溶质的分子量。将该式带入式(2-15),整理得: 10−3 = T m m M K A B B f (2-15) 若已知某溶液的凝固点降低常数 K f 值,通过实验测定此溶液的凝固点降低 值 T ,即可计算溶质的分子量 M B

纯溶剂的凝固点是其液固共存的平衡温度。通过测定凝固点的方法是将液 体逐渐冷却,理论上,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝 固热而补偿了热损失,体系将保持液固两相共存的平衡温度不变,直到全部凝 固,再继续均匀下降。其冷却曲线如图所示 (a) 时间 图1溶剂与溶液的冷却曲线 溶液的凝固点是溶液与溶剂的固相共存时的平衡温度,其冷却曲线与纯溶剂 不同。当有溶剂凝固析出时,剩余溶液的浓度增大,因而溶液的凝固点也逐渐下 降见图2-11(©)],如果溶液的过冷程度不大,析出溶剂固体的量对溶液浓度影 响不大,则以过冷回升的温度作凝固点,对测定结果影响不大[见图2-1()]。 如果过冷太甚,凝固的溶剂过多,溶液的浓度变化过大,则出现图2-11()的 情况,这样就会使凝固点的测定结果偏低。 【仪器和试剂】 凝固点测定仪1套:数字温差测量仪1台:磁力搅拌1台:秒表1只:水银 温度计1只:25ml移液管1只。 环己烷(A.R):萘(A.R)
纯溶剂的凝固点是其液-固共存的平衡温度。通过测定凝固点的方法是将液 体逐渐冷却,理论上,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝 固热而补偿了热损失,体系将保持液-固两相共存的平衡温度不变,直到全部凝 固,再继续均匀下降。其冷却曲线如图所示 图 1 溶剂与溶液的冷却曲线 溶液的凝固点是溶液与溶剂的固相共存时的平衡温度,其冷却曲线与纯溶剂 不同。当有溶剂凝固析出时,剩余溶液的浓度增大,因而溶液的凝固点也逐渐下 降[见图 2-11(c)],如果溶液的过冷程度不大,析出溶剂固体的量对溶液浓度影 响不大,则以过冷回升的温度作凝固点,对测定结果影响不大[见图 2-11(d)]。 如果过冷太甚,凝固的溶剂过多,溶液的浓度变化过大,则出现图 2-11(e)的 情况,这样就会使凝固点的测定结果偏低。 【仪器和试剂】 凝固点测定仪 1 套;数字温差测量仪 1 台;磁力搅拌 1 台;秒表 1 只;水银 温度计 1 只;25ml 移液管 1 只。 环己烷(A. R.);萘(A. R.)

6 图2实验装置图(1冰浴容器2.玻璃空气套管3.温度计4.样品加入口 5、7.搅拌器6.温度传感器8.凝固点管) 【实验步骤】 1.制备冰浴 取适量冰与水混合为寒剂,调节寒剂温度为2~3℃。注意不断搅拌并不时补 充碎冰,使寒剂保持此温度5m(调节冰浴温度的时候,水多冰少,不能持续加 冰,要等待约2mn,温度稍稳定,再加碎冰。只把空气管留在仪器内,把凝固 点管取出放在桌面)。整个实验过程中,寒剂温度要基本保持不变。 2.溶剂环己烷精确凝固点的测定 用移液管向清洁、干燥的凝固点管内加入25ml环己烷,插入数字温差测量 仪的温度传感器,调整位置,勿使其碰壁,放在空气套管中,插入冰浴。匀速搅 拌,使温度逐渐降低,当温度降至近似凝固点(6.3℃)以上1℃约为7.3℃时, 打开秒表,每30s读一次温度,当凝固点管中有少量固体出现时,即加速搅拌, 待温度回升后恢复原来的搅拌速度。过程中温度先下降后回升,回升到最高温度 后,继续记录温度7-8min,停止读数。 3.溶液精确凝固点的测定 取出凝固点管,用手捂住管壁,同时不断搅拌,使管中环己烷全部熔化。 用电子天平精确称取约0.10.12g萘(准确记录质量,保留小数点后4位数 字),加入到凝固点管,待全部溶解后,插入数字温差测量仪的温度传感器,调 整位置,勿使其碰壁。将凝固点管放在空气套管中,插入冰浴。匀速搅拌,使温
图 2 实验装置图(1.冰浴容器 2. 玻璃空气套管 3. 温度计 4. 样品加入口 5、7.搅拌器 6. 温度传感器 8.凝固点管 ) 【实验步骤】 1. 制备冰浴 取适量冰与水混合为寒剂,调节寒剂温度为 2~3℃。注意不断搅拌并不时补 充碎冰,使寒剂保持此温度 5min(调节冰浴温度的时候,水多冰少,不能持续加 冰,要等待约 2 min,温度稍稳定,再加碎冰。只把空气管留在仪器内,把凝固 点管取出放在桌面)。整个实验过程中,寒剂温度要基本保持不变。 2. 溶剂环己烷精确凝固点的测定 用移液管向清洁、干燥的凝固点管内加入 25ml 环己烷,插入数字温差测量 仪的温度传感器,调整位置,勿使其碰壁,放在空气套管中,插入冰浴。匀速搅 拌,使温度逐渐降低,当温度降至近似凝固点(6.3℃)以上 1℃约为 7.3℃时, 打开秒表,每 30s 读一次温度,当凝固点管中有少量固体出现时,即加速搅拌, 待温度回升后恢复原来的搅拌速度。过程中温度先下降后回升,回升到最高温度 后,继续记录温度 7~8min,停止读数。 3. 溶液精确凝固点的测定 取出凝固点管,用手捂住管壁,同时不断搅拌,使管中环己烷全部熔化。 用电子天平精确称取约 0.1~0.12g 萘(准确记录质量,保留小数点后 4 位数 字),加入到凝固点管,待全部溶解后,插入数字温差测量仪的温度传感器,调 整位置,勿使其碰壁。将凝固点管放在空气套管中,插入冰浴。匀速搅拌,使温
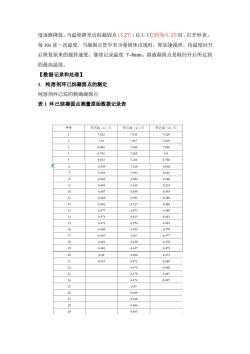
度逐渐降低,当温度降至近似凝固点(5.2℃)以上1℃约为6.2℃时,打开秒表, 每30s读一次温度,当凝固点管中有少量固体出现时,即加速搅拌,待温度回升 后恢复原来的搅拌速度。继续记录温度7~8min。溶液凝固点是取回升后所达到 的最高温度 【数据记录和处理】 1.纯溶剂环己烷凝固点的测定 纯溶剂环己烷的精确凝固点 表1环己烷凝固点测量原始数据记录表 序号 环己烧(2)1 环己(3)心 7.382 7349 7429 2 7.18 7.45 7209 6.984 7.369 7.048 6.793 7.285 6.9 5 6.634 7204 6788 6.539 7.129 6.698 6.62 6 691 10 6.48 0.849 6.49 11 6.483 6.791 6.48 12 6.481 6.727 6488 13 6.477 6.673 6485 14 6.474 6.613 6481 15 6471 6.554 6.481 16 6.460 6502 64 17 567 6477 18 6464 6428 6476 20 6.46 6.461 6,473 21 6.457 6.472 6469 22 6.473 6.468 23 6.476 6.467 24 6.474 6.467 25 647 36 6.468 6.468 6.46s
度逐渐降低,当温度降至近似凝固点(5.2℃)以上 1℃约为 6.2℃时,打开秒表, 每 30s 读一次温度,当凝固点管中有少量固体出现时,即加速搅拌,待温度回升 后恢复原来的搅拌速度。继续记录温度 7~8min。溶液凝固点是取回升后所达到 的最高温度。 【数据记录和处理】 1. 纯溶剂环己烷凝固点的测定 纯溶剂环己烷的精确凝固点 表 1 环己烷凝固点测量原始数据记录表
环己烷第三次凝固 64 时周(10) 图3环己烷的冷却曲线 由上图可知,环己烷的凝固点T=6.493℃。 2.环己烷+萘溶液凝固点的测定 环己烷+萘溶液精确凝固点 表2环己烷+萘溶液测量原始数据记录表 时间(s)0 30 6090120150180210 温度℃)6.0005.8675.7475.6275.5155.40452965.192 时间()240 270290 310330350370 390 温度(℃)5.0915.1315.1445.1405.1335.1275.1205.108 时间()420 450480 510570630690 温度(℃)5.0915.0755.0595.0475.0475.0234989
图 3 环己烷的冷却曲线 由上图可知,环己烷的凝固点 * 6.493 Tf = ℃。 2. 环己烷+萘溶液凝固点的测定 环己烷+萘溶液精确凝固点 表 2 环己烷+萘溶液测量原始数据记录表

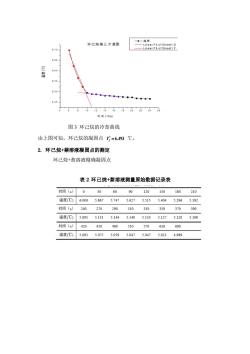
6.0 5.8 5.6 5.4 ◆ 5.2 5.0 0100200300400500600700 Time(Sec.) 图4环己烷+崇溶液的冷却曲线 (体系由0.1525g萘与25ml环己烷组成,系统温度降低至6℃开始记录。 根据上图溶液凝固点T,=5.169℃) 实验数据: 环己烷纯溶剂的实验凝固点温度为:T=6,93℃ 萘的环己烷稀溶液的实验凝固点温度为:T,=5.169℃ △T=1.324℃或1.324K 萘的质量:0.1525g 环己烷的体积:25ml 实验测得萘的相对分子质量: k,m。 20.0K.kg·mox0.1525g 误差: 1156-128.12x100%=9.7% 128.12 理论参考数据:
图 4 环己烷+萘溶液的冷却曲线 (体系由 0.1525g 萘与 25mL 环己烷组成,系统温度降低至 6℃开始记录。 根据上图溶液凝固点 Tf =5.169℃) 实验数据: 环己烷纯溶剂的实验凝固点温度为: * 6.493 Tf = ℃ 萘的环己烷稀溶液的实验凝固点温度为: Tf =5.169℃ T =1.324℃或 1.324K 萘的质量:0.1525g 环己烷的体积:25ml 实验测得萘的相对分子质量: 1 3 1 3 3 f 20.0 0.1525 10 115.6 1.324 25 0.797 f B B A k m K kg mol g M g mol T m K cm g cm − − − = = = 误差: 115.6 128.12 100% 9.7% 128.12 − = 理论参考数据:

环己烷的凝固点降低常数值:K=20.0K·kghol 环己烷纯溶剂的密度p=0.797gm3=797kgm3 理论萘的相对分子质量128.12gmol 注意事项 1.需要约15-20min制备冰浴,冰浴温度要稳定,应不低于待测溶液凝固点3-4℃ 2.制备冰浴时,要机械搅拌,温度传感器插入冰浴中 3.温度传感器放入环己烷中时要将水擦干才能放入凝固点管中。 4.只要析出少量固体,搅拌要加速,温度回升后再降低搅拌速度。 5.玻璃仪器都不需要清洗,溶液倒入废液桶。 6.凝固点降低仪器的温度显示时,△T与T的显示基本一致,如果温度出现过 冷,△T会出现负值。 提问与思考 1为什么要先测近似凝固点? 答:(1)因为要准确测定凝固点比较困难,我们可以先测一个近似点,当精确测 量时,在近似点附近我们可以降低温度下降速度,到凝固点时快速搅拌。 (2)为了控制过冷程度。当温度冷却至凝固点时要通过急速搅拌,防止过冷 超过要求,促进品体析出。 2根据什么原则考虑溶质的用量?太多或太少对测量结果有何影响? 答:根据稀溶液依数性范围确定,太多不符合稀溶液,且溶液的凝固点降低太多, 析出溶剂品体后,溶液浓度变化大,凝固点也随之降低,不易准确测定其凝固点 过少,溶液的凝固点降低少,相对测定误差也大。 3测凝固点时,纯溶剂温度回升后有一恒定阶段,而溶液则没有,为什么? 答:纯溶剂逐步冷时,体系温度随时间均匀下降,到某一温度时有固体析出,由 于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平
环己烷的凝固点降低常数值: K f = 20.0K • kg ̸mol 环己烷纯溶剂的密度ρ=0.797 g/m3 =797 kg/m3 理论萘的相对分子质量 128.12g̸mol 注意事项 1. 需要约 15-20min 制备冰浴,冰浴温度要稳定,应不低于待测溶液凝固点 3-4℃. 2. 制备冰浴时,要机械搅拌,温度传感器插入冰浴中 3. 温度传感器放入环己烷中时要将水擦干才能放入凝固点管中。 4. 只要析出少量固体,搅拌要加速,温度回升后再降低搅拌速度。 5. 玻璃仪器都不需要清洗,溶液倒入废液桶。 6. 凝固点降低仪器的温度显示时,ΔT 与 T 的显示基本一致,如果温度出现过 冷,ΔT 会出现负值。 提问与思考 1 为什么要先测近似凝固点? 答:(1)因为要准确测定凝固点比较困难,我们可以先测一个近似点,当精确测 量时,在近似点附近我们可以降低温度下降速度,到凝固点时快速搅拌。 (2)为了控制过冷程度。当温度冷却至凝固点时要通过急速搅拌,防止过冷 超过要求,促进晶体析出。 2 根据什么原则考虑溶质的用量?太多或太少对测量结果有何影响? 答:根据稀溶液依数性范围确定,太多不符合稀溶液,且溶液的凝固点降低太多, 析出溶剂晶体后,溶液浓度变化大,凝固点也随之降低,不易准确测定其凝固点。 过少,溶液的凝固点降低少,相对测定误差也大。 3 测凝固点时,纯溶剂温度回升后有一恒定阶段,而溶液则没有,为什么? 答:纯溶剂逐步冷时,体系温度随时间均匀下降,到某一温度时有固体析出,由 于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平

衡,放热与散热达到平衡时,温度不再改变,自由度=0,所以在曲线呈出现一个 平台:而溶液两相共存时,自由度=1温度仍可以下降,但由于溶剂凝固时放出 凝固热,使温度回升,但回升到最高点又开始下滑,所以步冷曲线不出现水平阶 段。 4溶液浓度太稀或者太浓对实验结果有什么影响?为什么? 答:浓度太稀,则凝固点下降不明显,浓度太浓,则不符合测定条件所需的“稀 溶液”。这都是由溶液的依数性所决定的。 5当溶质在溶液中有离解、缔合和生成配合的情况时,对其摩尔质量的测定有何 影响? 答:由于凝固点下降公式是对于理想溶液和浓度很小的稀溶液,要求溶质在溶剂 中只有一种形式,如果溶质有离解、缔合、溶剂化和生成配合物时,那么溶液中 的溶质的浓度就变了,公式中的溶质的摩尔浓度也变了,必然影响测定结果, 般解离使结果变大,缔合使结果变小,由于溶质出现的这种情况,凝固点下降公 式己经不再适用,所以测定结果就没有意义。 6用凝固点降低法测定摩尔质量,选择溶剂时应考虑哪些因素? 答:首先要能很好的溶解溶质,当溶质在溶液里有解离、缔合、溶剂化或者形成 配合物等情况时不适用,一般只适用于强电解质稀溶液。其次凝固点不应该太高 或太低,应在常温下易达到如:水、苯、环己烷等。 7为了提高实验的准确度是否可用增加溶质浓度的方法增加值? 答:不可以,溶质加的太多,不是稀溶液,就不符合凝固点降低公式了。 8冰浴温度过高或者过低有什么不好? 答:过高导致冷却太慢,过低导致测量不出正确的凝固点。 9搅拌速度过快和过慢对实验有何影响? 答:在温度逐渐降低过程中,搅拌过快,不易过冷,搅拌过慢,体系温度不均匀。 温度回升过时,搅拌过快,回升最高点因搅拌热而偏高,过慢,溶液凝固点测定 值偏低。所以搅拌的作用一是使体系温度均匀,二是供热(尤其是刮擦器壁), 促进固体新相形成。 10凝固点降低法测定摩尔质量使用范围? 答:稀溶液
衡,放热与散热达到平衡时,温度不再改变,自由度=0,所以在曲线呈出现一个 平台;而溶液两相共存时,自由度=1 温度仍可以下降,但由于溶剂凝固时放出 凝固热,使温度回升,但回升到最高点又开始下滑,所以步冷曲线不出现水平阶 段。 4 溶液浓度太稀或者太浓对实验结果有什么影响?为什么? 答:浓度太稀,则凝固点下降不明显,浓度太浓,则不符合测定条件所需的“稀 溶液”。这都是由溶液的依数性所决定的。 5 当溶质在溶液中有离解、缔合和生成配合的情况时,对其摩尔质量的测定有何 影响? 答:由于凝固点下降公式是对于理想溶液和浓度很小的稀溶液,要求溶质在溶剂 中只有一种形式,如果溶质有离解、缔合、溶剂化和生成配合物时,那么溶液中 的溶质的浓度就变了,公式中的溶质的摩尔浓度也变了,必然影响测定结果,一 般解离使结果变大,缔合使结果变小,由于溶质出现的这种情况,凝固点下降公 式已经不再适用,所以测定结果就没有意义。 6 用凝固点降低法测定摩尔质量,选择溶剂时应考虑哪些因素? 答:首先要能很好的溶解溶质,当溶质在溶液里有解离、缔合、溶剂化或者形成 配合物等情况时不适用,一般只适用于强电解质稀溶液。其次凝固点不应该太高 或太低,应在常温下易达到如:水、苯、环己烷等。 7 为了提高实验的准确度是否可用增加溶质浓度的方法增加值? 答:不可以,溶质加的太多,不是稀溶液,就不符合凝固点降低公式了。 8 冰浴温度过高或者过低有什么不好? 答:过高导致冷却太慢,过低导致测量不出正确的凝固点。 9 搅拌速度过快和过慢对实验有何影响? 答:在温度逐渐降低过程中,搅拌过快,不易过冷,搅拌过慢,体系温度不均匀。 温度回升过时,搅拌过快,回升最高点因搅拌热而偏高,过慢,溶液凝固点测定 值偏低。所以搅拌的作用一是使体系温度均匀,二是供热(尤其是刮擦器壁), 促进固体新相形成。 10 凝固点降低法测定摩尔质量使用范围? 答:稀溶液

11凝固点下降是根据什么相平衡体系和哪一类相线? 答:二组分低共熔体系中的凝固点降低线,也称为某一物质饱和的析晶线。 12为什么用空气套,不用它对实验有何影响? 答:降缓降温速率,防止过准予发生。 13若溶质在溶液中有理解现象,对摩尔质量的测定值有何影响? 答:因为凝固点下降多少直接影响,直接反映了溶液中溶质的的质点数,所以当 有离解时质点数增加,△T,变大,而公式M,8了m, K'ma可以看出M。会偏 小。 14为什么要初测物质的凝固点) 答:防止过冷出现,节省时间。 15为什么要防止过冷现象?如何控制过冷程度? 答:由于新相难以生成,加入晶种或控制搅拌速度。 16测定溶液的凝固点时必须减少过冷现象吗? 答:若果冷严重,温度回升的最高温度不是原尝试溶液凝固点,测得的凝固点偏 低。 17选做溶剂时K,大的灵敏度高还是K,小的灵敏度高? 答:大的 18测定溶液凝固点时,过冷温度不能超过多少度? 答:0.5,最好是02. 19溶剂和溶质的纯度与实验结果有关吗? 答:有 20如不用外推法求凝固点,一般△T,会偏大还是偏小? 答:大 21一般冰浴温度要求不低于溶液凝固点几度为宜? 答:2-3℃. 22测定溶液的凝固点时析出固体较少,测得的凝固点准确吗? 答:准确,因为溶液的凝固点随着溶剂的析出而不断下降。析出的固体少测得的 Ma越准确
11 凝固点下降是根据什么相平衡体系和哪一类相线? 答:二组分低共熔体系中的凝固点降低线,也称为某一物质饱和的析晶线。 12 为什么用空气套,不用它对实验有何影响? 答:降缓降温速率,防止过准予发生。 13 若溶质在溶液中有理解现象,对摩尔质量的测定值有何影响? 答:因为凝固点下降多少直接影响,直接反映了溶液中溶质的的质点数,所以当 有离解时质点数增加, T f 变大,而公式 T m K m M f A f B B • • = 可以看出 M B 会偏 小。 14 为什么要初测物质的凝固点/ 答:防止过冷出现,节省时间。 15 为什么要防止过冷现象?如何控制过冷程度? 答:由于新相难以生成,加入晶种或控制搅拌速度。 16 测定溶液的凝固点时必须减少过冷现象吗? 答:若果冷严重,温度回升的最高温度不是原尝试溶液凝固点,测得的凝固点偏 低。 17 选做溶剂时 K f 大的灵敏度高还是 K f 小的灵敏度高? 答:大的 18 测定溶液凝固点时,过冷温度不能超过多少度? 答:0.5,最好是 0.2. 19 溶剂和溶质的纯度与实验结果有关吗? 答:有 20 如不用外推法求凝固点,一般 T f 会偏大还是偏小? 答:大 21 一般冰浴温度要求不低于溶液凝固点几度为宜? 答:2-3℃. 22 测定溶液的凝固点时析出固体较少,测得的凝固点准确吗? 答:准确,因为溶液的凝固点随着溶剂的析出而不断下降。析出的固体少测得的 M B 越准确

23测定的溶液的凝固点时析出的固体较多,测得的凝固点准确吗? 答:不准确,因为溶液的凝固点随着溶剂的析出而不断下降。析出的固体多会使 凝固点下降多,△T,变大,所测的M。会偏小
23 测定的溶液的凝固点时析出的固体较多,测得的凝固点准确吗? 答:不准确,因为溶液的凝固点随着溶剂的析出而不断下降。析出的固体多会使 凝固点下降多, T f 变大,所测的 M B 会偏小
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)表面活性剂 类型.ppt
- 《物理化学》课程教学资源(学习资料)化合物缩写 V. LIST OF ABBREVIATIONS.pdf
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体与界面化学.ppt
- 《物理化学》课程教学资源(书籍文献)萤火虫的发光.doc
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第7章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)课程复习_第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
- 《物理化学》课程教学课件(PPT讲稿)习题_热力学部分.ppt
- 《物理化学》课程教学资源(实验指导)双液系气液平衡相图.doc
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 误差和数据处理.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一张 绪论.ppt
- 《分析化学》课程课后思考题(含答案)第九章.doc
- 《分析化学》课程教学资源(实验指导)氮含量的测定.doc
- 《分析化学》课程教学资源(国家标准)标准滴定溶液的制备.pdf
- 《分析化学》课程教学资源(知识拓展)如何检测化学武器.doc
- 《物理化学》课程教学课件(PPT讲稿)第5章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 多组分系统热力学及其在溶液中的应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第3章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第2章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(导学任务)第23次课.doc
