《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡

反应等温方程 反应A.G9 第四章 经验平衡常数 化学平衡 平衡常数测定 温度对K⊙影响 其它因素的影响 平衡组成计算 习题课
习题课 平衡组成计算 其它因素的影响 温度对K影响 平衡常数测定 经验平衡常数 反应rGm 反应等温方程

§4.1化学反应的方向和限度 一、化学反应的限度 二、反应系统的Gibbs自由能 三、化学反应的平衡常数和等温方程
2 §4.1 化学反应的方向和限度 一、化学反应的限度 二、反应系统的Gibbs 自由能 三、化学反应的平衡常数和等温方程

化学反应的限度 forward 对行反应:Reactants Products backward 当反应达到平衡态时,具有下列特征: 1.系统中各物质的数量不再随时间而改变。即反应进度达 到极限值一g(反应的限度) 。 2.宏观上看反应停止了,实际上达到动态平衡。 rate(forward)=rate(backward) 3.平衡不受催化剂的影响 4.反应条件不仅能影响平衡,还能改变反应方向。如:加 压能使石墨→金刚石
3 一、化学反应的限度 对行反应: Reactants Products 当反应达到平衡态时,具有下列特征: 1.系统中各物质的数量不再随时间而改变。即反应进度达 到极限值— eq(反应的限度)。 2.宏观上看反应停止了,实际上达到动态平衡。 rate(forward)= rate(backward) 3.平衡不受催化剂的影响 4.反应条件不仅能影响平衡,还能改变反应方向。如:加 压能使石墨→金刚石 forward backward

推导过程涉及到第三章的公式 G=∑uBnB G*=Hg*nB (dG)Tp=E uBdnB 44*>4B* A0G@+是 guG hun ala +bug
4 G = B nB G* = B * nB (dG)T, p = B dnB A *>B * 推导过程涉及到第三章的公式 G H A B g h a b + = +

二、反应系统的Gibbs自由能 任意化学反应:()zp,W=0时,反应方向和限度的判据为: (dGxp=∑4BdnB=2vB4Bd5≤0 其中d5为反应的进度。d5=dng /vg 0逆向自发 既然反应系统的吉布斯自由能G随反应进度而减 小,那这种减小具体的方式如何呢? 5
5 二、反应系统的Gibbs 自由能 , B B T p G = 既然反应系统的吉布斯自由能G随反应进度而减 小,那这种减小具体的方式如何呢? 任意化学反应:( )T, p , W’=0时, 反应方向和限度的判据为: (dG)T, p = B dnB = B B d 0 其中 d 为反应的进度。d =dnB /vB 上式可整理为 0 逆向自发
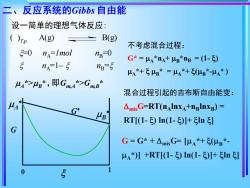
二、反应系统的Gibbs自由能 设一简单的理想气体反应: ()p A(g) B(g) 不考虑混合过程: 5-0 nA=Imol nB-0 G*=μa*nA+B*nB=(1-) 5 nA=1-5 ng-5 μA*+号B*=A*+(μB*-μA*)》 44*>4g*,即GmA*>GmB* 混合过程引起的吉布斯自由能变: 4 G AmixG=RT(nAInxA+nglnxB)= B RT[(1-)ln(1-)+1n引 G G=G*+△mixG=[u⅓*+(μB*- μa*)川+RT1-)ln(1-)+n引 0
设一简单的理想气体反应: =0 nA =1mol nB=0 nA=1– nB = ( )T,p A(g) B(g) A *> B * , 即Gm,A*>Gm,B * G G 1 0 A B 二、反应系统的Gibbs 自由能 不考虑混合过程: G* = A *nA+ B *nB = (1- ) A *+ B * = A *+ (B *-A * ) 混合过程引起的吉布斯自由能变: mixG=RT(nAlnxA+nBlnxB) = RT[(1- ) ln(1- )]+ ln ] G = G* + mixG= [A *+ (B *- A *)] +RT[(1- ) ln(1- )]+ ln ]
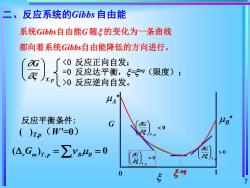
反应系统的Gibbs自由能 系统Gibbs自由能G随5的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 〈0反应正向自发; =0反应达平衡,5=®g(限度); 工p>0反应逆向自发。 反应平衡条件: G ()np(W=0) (△,Gn)r,p=∑Y4B=0 G G >0 5 0
7 反应平衡条件: ( )T,p(W’=0) T, p ξ G , ( ) 0 = = r m T p B B G 系统Gibbs自由能G 随 的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 0 反应逆向自发。 G 0 eq 1 A B 0 , T p G 0 , = T p G 0 , T p G 二、反应系统的Gibbs 自由能

三、化学反应的平衡常数和等温方程 假设有理想气体化学反应A+bB二 8G+hH 当反应达到平衡g4G+hlH=44+buB 混合理想气体B的化学势表达式为: 叭=D+Tn品 则上式可写为 86+grng)a始+hTn】 +b+bRTIn D 8
8 三、化学反应的平衡常数和等温方程 假设有理想气体化学反应 aA + bB gG + hH 当反应达到平衡 G H A B g h a b + = +B B B ( , ) ( ) ln p T p T RT p = + 混合理想气体B的化学势表达式为: 则上式可写为 ln ln ln ln G H G H A B A B p p g gRT h hRT p p p p a aRT b bRT p p + + + = + + +

三、化学反应的平衡常数和等温方程 即 、6 RT (g4呢+hu唱-a4月-bμg) 式中,P为B物质在平衡时的分压。因为等式右边各项都 只是T的函数,T一定时,等式右边为一常数。所以 =常数=KW 标准平衡常数,一定温度时为 一定值,量纲为1 9
9 即 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − 式中,pB为B物质在平衡时的分压。因为等式右边各项都 只是T的函数,T一定时,等式右边为一常数。所以 g h G H a b A B p p p p p p p p = 常数 = Kθ 标准平衡常数,一定温度时为 一定值,量纲为1 三、化学反应的平衡常数和等温方程

三、化学反应的平衡常数和等温方程 RT (g4忌+h明-a号-bg) 如果令 g4呢+hg-a4-bg=△,G品 反应的标准吉布斯函 则△,GR=-RTInK 数变化,指反应物和产物 均处于标准态时,产物的 吉布斯函数与反应物的吉 布斯函数总和之差 10
10 如果令 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − G H A B r m g h a b G + − − = 则 ln r m G RT K = − 反应的标准吉布斯函 数变化,指反应物和产物 均处于标准态时,产物的 吉布斯函数与反应物的吉 布斯函数总和之差 三、化学反应的平衡常数和等温方程
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)课程复习_第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
- 《物理化学》课程教学课件(PPT讲稿)习题_热力学部分.ppt
- 《物理化学》课程教学资源(作业习题)化学势(含参考答案)热力学.doc
- 《物理化学》课程教学课件(PPT讲稿)习题_相平衡习题.ppt
- 《物理化学》课程教学资源(作业习题)化学势(含参考答案).doc
- 《物理化学》课程教学资源(作业习题)化学平衡(含参考答案).doc
- 《有机与药物合成化学》课程教学课件(讲稿)羧酸——关于有机酸的化学.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)羧酸衍生物——羧酸的亲核取代产物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)β-二羰基化合物——活泼亚甲基的反应.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)含氮化合物——有机氮的性质.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)杂元素化合物——含杂元素的有机物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)杂环化合物.ppt
- 《有机与药物合成化学》课程教学课件(讲稿)有机化合物官能团引入与碳链增长——含碳氢氧卤素化合物的一般合成(山东科技大学:王鹏).pdf
- 《物理化学》课程教学资源(课堂小测验与解答).doc
- 《物理化学》课程教学课件(PPT讲稿)总复习.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第7章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第5章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第4章 化学平衡.ppt
- 《物理化学》课程教学资源(书籍文献)萤火虫的发光.doc
- 《物理化学》课程教学课件(PPT讲稿)胶体与界面化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基础.ppt
- 《物理化学》课程教学资源(学习资料)化合物缩写 V. LIST OF ABBREVIATIONS.pdf
- 《物理化学》课程教学课件(PPT讲稿)表面活性剂 类型.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学势.ppt
- 《物理化学》课程教学资源(实验指导)凝固点降低法测摩尔量.doc
- 《物理化学》课程教学资源(实验指导)双液系气液平衡相图.doc
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定法.ppt
