《有机化学》课程教学资源(学习资料)有机人名反应 Organic Name Reactions

有机人名反应 Organic Name Reactions 目录 Arbuzoy向 Hunsdiecker反应 54 Arndt-Eister反应 Kiliani氯化增碳法 Baeyer-Villiger氧化 Knoevenagel反应 Beckmann重排.」 .6 Knorr及应. .57 Birch还原 7 Koble反应 57 Bischler-Napieralski合成法. Koble-Schmitt反应 58 Bouveault-.Blanc还原 l euc kart反应 59 Bucherer反应 Lossen反应 Cannizzaro反应. .13 Mannich反 .62 Chichibabin反应 14 eerwein-Ponndorf反应 63 Claisen重排. 15 Michael加成反应. .64 Claisen酯缩合反应 17 Norrish I和型裂解反应 65 Claisen-Schmidt反应 Oppenauer氧化 66 Clemmensen还原, .20 Paa-Knorr反应. .67 Combes合成法. .21 Pictet-Spengler合成法. .69 Cope重排 22 Pschorr反应 70 CaDe消除反应 73 Reformatsky反应 71 Curtius反应 Dakin反 245 Reimer-Ti ann反应 Reppe合成 Darzens反应, .26 Robinson缩环反应., .74 Demjanov重排. .27 Rosenmund还原 76 Dieckmann缩合反应 28 Ruff递降反应 16 Diels.Alder反 30 dmeyer反应 Ebs反应 Schiemann反应 8 Eschweiler-.Clarke反应 .33 Schmidt反应 Favorskii反应. .34 Skraup合成法. 81 Favorskii重排._ 35 Sommelet-.Hauser反应 82 Friedel-Crafts皖基化反微 37 Stephen还原 83 Friedel-Crafts酰基化反应 10 Stevens重推 84 Fries重排. Strecker氨基酸合成法. Gabriel合成法. .40 Tiffeneau-Demjanov重排. .86 Gattermann反应. 42 Ullmann反应 87 Gattermann-Koch反应 43 Vilsmeier反应 .89 Gomberg-Bachmann反应 -Me rwein重排 Hantzsch合成法 Haworth反应. .46 Villiamson合成法. .92 Hel-Volhard-Zelinski反应 .48 Wittig反应 93 Hinsberg反应. .49 Vittio-Horner反应 04 n烷基化 Wohl递降反应, 95 Hofmann消除反应 Wolff-Ki hner-.黄鸣龙反应96 Hofmann重排(降解)】 .52 Yurev反应. .98 Houben-Hoesch反应.53 Zeisel甲氧基测定法.99
有机人名反应 Organic Name Reactions 目 录 Arbuzov 反应.2 Arndt-Eister 反应.3 Baeyer-Villiger 氧化. 4 Beckmann 重排. 6 Birch 还原.7 Bischler-Napieralski 合成法. 9 Bouveault-Blanc 还原.10 Bucherer 反应. 11 Cannizzaro 反应. 13 Chichibabin 反应.14 Claisen 重排. 15 Claisen 酯缩合反应. 17 Claisen-Schmidt 反应. 19 Clemmensen 还原.20 Combes 合成法. 21 Cope 重排.22 Cope 消除反应.23 Curtius 反应.24 Dakin 反应. 25 Darzens 反应. 26 Demjanov 重排. 27 Dieckmann 缩合反应. 28 Diels-Alder 反应.29 Elbs 反应.32 Eschweiler-Clarke 反应.33 Favorskii 反应.34 Favorskii 重排.35 Friedel-Crafts 烷基化反应.37 Friedel-Crafts 酰基化反应.38 Fries 重排.39 Gabriel 合成法.40 Gattermann 反应. 42 Gattermann-Koch 反应.43 Gomberg-Bachmann 反应.44 Hantzsch 合成法.45 Haworth 反应. 46 Hell-Volhard-Zelinski 反应. 48 Hinsberg 反应.49 Hofmann 烷基化.50 Hofmann 消除反应.51 Hofmann 重排(降解).52 Houben-Hoesch 反应.53 Hunsdiecker 反应. 54 Kiliani 氰化增碳法. 55 Knoevenagel 反应.55 Knorr 反应.57 Koble 反应. 57 Koble-Schmitt 反应. 58 Leuckart 反应.59 Lossen 反应.60 Mannich 反应. 62 Meerwein-Ponndorf 反应.63 Michael 加成反应.64 Norrish I 和 II 型裂解反应.65 Oppenauer 氧化. 66 Paal-Knorr 反应.67 Pictet-Spengler 合成法.69 Pschorr 反应. 70 Reformatsky 反应. 71 Reimer-Tiemann 反应. 73 Reppe 合成法. 74 Robinson 缩环反应.74 Rosenmund 还原.76 Ruff 递降反应.76 Sandmeyer 反应.77 Schiemann 反应.78 Schmidt 反应.79 Skraup 合成法. 81 Sommelet-Hauser 反应.82 Stephen 还原.83 Stevens 重排. 84 Strecker 氨基酸合成法. 86 Tiffeneau-Demjanov 重排.86 Ullmann 反应.87 Vilsmeier 反应. 89 Wagner-Meerwein 重排.90 Wacker 反应.91 Williamson 合成法. 92 Wittig 反应. 93 Wittig-Horner 反应.94 Wohl 递降反应.95 Wolff-Kishner-黄鸣龙 反应. 96 Yurév 反应.98 Zeisel 甲氧基测定法.99

Arbuzov反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基腾酸二烷基酯和一个新的卤代烷: R (RO)3P R'X (RO)P=0 +Rx 亚磷酸三烧基酯 烧基群酸二烧基酮 卤代烷反应时,其活性次序为:RI>RBr>R'CI。除了卤代烷外,烯丙型或炔丙型卤化物、-卤代酰、 -或阝-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基各不相同时,总是 先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 3 ROH PC13 (RO)3P 如果反应所用的卤代烷RX的烷基和亚磷酸三烷基酯(ROP的烷基相同(即R'=R),则 Arbuzov反应如下: (RO)3P +RX- →R-P(OR2 X=Br,CL,I 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯RP(OR)2和次亚膦酸酯RPOR'也能发生该类反应,例如: R-P(OR)2 R"X-R-P-OR R'X R" R-P-OR'+R'X R -R”+RX 反应机理 一般认为是按S2进行的分子内重排反应: OR OR OR -R'RX OR
Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、卤代醚、 或 卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基各不相同时,总是 先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2 和次亚膦酸酯 R2POR' 也能发生该类反应,例如: 反应机理 一般认为是按 SN2 进行的分子内重排反应:

反应实创 1.(C2HsO)3P CHgI CH3-P(OC2Hs)2 C2HsI 95% 甲基翻酸二乙刷 2.(CaO)P+CasI100C Cas-B(OC2H)2 定量 乙基群酸二乙酯 CH2CI CH2-P(OC2Hs)2 3.(C2HsO)3P+ +C25C187% 1一萘甲基群酸二乙刷 Arndt-Eister反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 足a兴,一-祭照 反应机理 赛要用先充馨发显 (1) (2) (3) 反应实倒
反应实例 Arndt-Eister 反应 反应机理 反应实例

COCHN2 O0OO@O器 CH,CO,H ao Baeyer-Villiger氧化 82% 反应机理
Baeyer-Villiger 氧化 反应机理
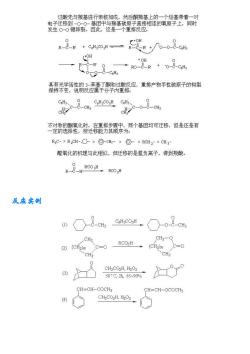
过酸先与基进行亲核加成,然后朝羰基上的个烃基带着一对 碳基碳原子直接相连的氧原子上,同时 (O 景接酒精朗服透调整应,重排产物手性碳原千的物型 -m4 c 0-o-8- 不能霁墨化装德薨势资群为两个团可迁伤。包是还是有 R;C->R2CH->-CH->>RCH2->CH3- 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 RO RCO 反应实创 CH CH2-Q (2(CH2m RCH→(Cm=0 CH. CH2 CH3C02H,202 50°C,2h85-90% CH=CH-COCH CH=CH-OCOCH3 CHgCO2H,H2O2
反应实例
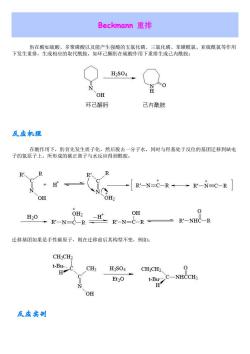
Beckmann重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用 下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: H2S04 0 OH 环己酮肟 己内酰胺 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电 子的氮原子上,所形成的碳正离子与水反应得到酰胺。 R R +H' +[R'-N=C-R→R'-N=C-R OH OH2 OH 0 H20 +R'-N=C-R= 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: CH:CH CH3 H2S04 CH3CH2 Et2O BCNHCCH OH 反应实创
Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用 下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电 子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例

CH ON 1) H2S04 )NH-CHs N-OH CH5、 CH (2) CoHSNH-C-CH3 OH Birch还原 忠器枭聚器 O Na mHx4EoH→○ 反应机理
Birch 还原 反应机理
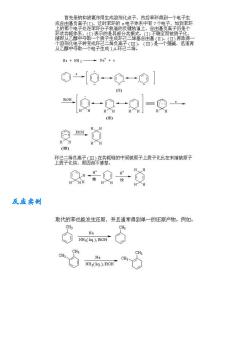
首先是钠和液氨作用生成溶剂化点子,然后苯环得到一个电子生 从2中最个电子生成冠,( 由子恋成花 Na NH3-Na'+e 00一⊙一0] “良一g一-一 “的 w) 环属影花换离质品来视监的中同陕原子上质子化比在末碳原子 ÷0÷的 反应实创 取代的苯也能发生还原,并且通常得到单一的还原产物。例如: 照4合 Na N,().EOHCH☆ Na
反应实例
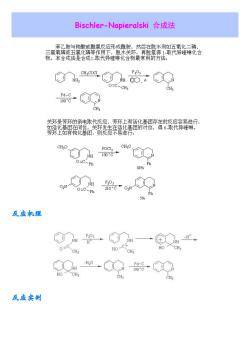
Bischler-Napieralski合成法 物。本合成法是合成1取代异哇琳化合物最常用的方法。 ,4a.粉.。 0= CH3 CH, 芳环上如有钝化基团,则反应不易进寿。 Ph 88% oO 反应机理 反应实创
Bischler-Napieralski 合成法 反应机理 反应实例

OH 0) HpHo个人CH0 -H0 CH3 OH (2 ◇出,0 Na-Hg 00H Bouveault-Blanc还原 R-OR+Ns RCH:OH+ROH 反应机理
Bouveault-Blanc 还原 反应机理
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 安徽大学:《有机化学》课程授课教案 Organic Chemistry(讲稿,授课教师:冯燕,授课教师:冯燕).pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第五章 物质结构基础.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第七章 高分子化合物与材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第六章 元素化学与无机材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第二章 化学反应基本原理与大气污染.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第四章 电化学与金属腐蚀.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第三章 水化学与水污染.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第一章 热化学与能源.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷9(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷9(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷10(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷10(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷8(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷8(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷7(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷7(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷6(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷5(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷6(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷5(答案).pdf
- 山东理工大学:《物理化学》课程授课教案(讲义,讨论稿).doc
- 山东理工大学:《物理化学》课程授课计划(A)Ⅰ.doc
- 《物理化学》课程教学资源(A)Ⅰ 物理化学辅导与习题详解第五版(华中科技大学出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第06章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第05章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(2/2,2.10-2.18).ppt
- 《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(1/2,2.1-2.9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第0章 绪论、第1章 气体.ppt
- 《物理化学》课程教学课件(讲稿,AⅠ)第0-1章 绪论、气体(山东理工大学:薛莉).pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第6章 化学平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第5章 相平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第4章 多组分系统热力学及其在溶液中的应用.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第3章 热力学第二定律 The Second Law of Thermodynamics.pdf
