《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡
第六章 化学平衡 范霍夫平衡舒箱 愠盟 dD +eE fF gG P'D P'E P'F P'G
第六章 化学平衡

第六章化学平衡衡 §6.1化学反应的平衡条件 反应进度和化学反应的亲和势 §6.2化学反应的平衡常数和等温方程式 §6.3平衡常数的表示式 §6.4复相化学平衡 §6.5标准摩尔生成Gibbs自由能 §6.6温度、压力及惰性气体对化学平衡的影响 §6.7同时化学平衡衡 §6:8反应的耦合 §6.9近似计算 *§6.10生物能学简介
第六章 化学平衡 §6.1 化学反应的平衡条件—— 反应进度和化学反应的亲和势 §6.2 化学反应的平衡常数和等温方程式 §6.3 平衡常数的表示式 §6.4 复相化学平衡 §6.5 标准摩尔生成Gibbs自由能 §6.6 温度、压力及惰性气体对化学平衡的影响 §6.8 反应的耦合 §6.9 近似计算 §6.7 同时化学平衡 *§6.10 生物能学简介

§6.1化学反应的平衡条件和反应进度 5的关系 化学反应系统: 封闭的单相系统,不作非膨胀功,当发生了 一个微小变化时,有: dU=TdS-pdW+∑dnB dG=-SdT+dp+∑4dnB 引入反应进度的概念 dξ= dns dne Veds VB
§6.1 化学反应的平衡条件和反应进度 的关系 化学反应系统: 封闭的单相系统,不作非膨胀功,当发生了 一个微小变化时,有: B B d d d d U T S p V n = − + B B B d d d d G S T V p n = − + + B 引入反应进度的概念 B B d d n = d d nB B =

反应进度(extent of reaction) yoD+yEE+.>yF+yGG+. t=0,5=0 neg ngo t=t,5=5 np ne ne na 反应进度的定义为: △5=s⑤)-”wd5= ns 5单位:mol VB VB ngo和n.分别代表任一组分B在起始和t时 刻的物质的量。B是任一组分B的化学计量数, 对反应物取负值,对生成物取正值
反应进度(extent of reaction ) 反应进度 的定义为: B B,0 B n n ( ) = − B B d d n = 和 分别代表任一组分B 在起始和 t 时 刻的物质的量。 是任一组分B的化学计量数, 对反应物取负值,对生成物取正值。 nB,0 B n B D E F G D E F G + +→ + + t = t, = D n E n F n G n t = 0, = 0 nD,0 E,0 n nF,0 nG,0 单位:mol

化学反应的平衡条件和反应进度5的关系 基本公式可表示为: dU=TdS-pdV+∑ye4ed5 P dG=-SdT+Wdp+∑y4d5 等温、等压条件下, (dGp=∑Hndne=∑n4md
化学反应的平衡条件和反应进度 的关系 基本公式可表示为: B B B d d d d U T S p V = − + B B B d d d d G S T V p = − + + 等温、等压条件下, , B B B ( )d d G n T p = B B B = d

化学反应的平衡条件和反应进度ξ的关系 (dG)z,p=∑yB4d5 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4B保持不变
化学反应的平衡条件和反应进度 的关系 , B B B ( )d d G T p = B B r m T p, B G G = = 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变

判断化学反应的方向与限度 用。,4或aCh,作判据都是等效的 (AGm).p0 反应自发地向左进行 ∑4>0 (A:Gm)T.p=O ∑4=0 反应达到平衡
判断化学反应的方向与限度 用 , B r m , 作判据都是等效的 B ( ) , ( ) T p B T p G G 或 r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行 r m , ( ) 0 G T p = 反应达到平衡 B B B 0 B B B > 0 B B B = 0

判断化学反应的方向与限度 用 a衫 判断,这相当于G~5图上曲线的斜率 T,p 因为是微小变化,反应进度处于0~1mol之间。 G 0 反应自发向左进行,趋向平衡 og T,P =0 反应达到平衡 T.p
判断化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率 T p, G G ~ , 0 T p G 反应自发向右进行,趋向平衡 , 0 T p G 反应自发向左进行,趋向平衡 , 0 T p G = 反应达到平衡 因为是微小变化,反应进度处于0~1 mol之间
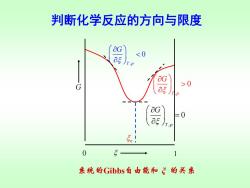
判断化学反应的方向与限度 &G >0 系统的Gibbs自由能和飞的关系
判断化学反应的方向与限度 , 0 T p G , 0 T p G = , 0 T p G Gibbs ξ 0 1 G e

为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学资源(A)Ⅰ 物理化学辅导与习题详解第五版(华中科技大学出版社).pdf
- 山东理工大学:《物理化学》课程授课计划(A)Ⅰ.doc
- 山东理工大学:《物理化学》课程授课教案(讲义,讨论稿).doc
- 《有机化学》课程教学资源(学习资料)有机人名反应 Organic Name Reactions.doc
- 安徽大学:《有机化学》课程授课教案 Organic Chemistry(讲稿,授课教师:冯燕,授课教师:冯燕).pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第五章 物质结构基础.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第七章 高分子化合物与材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第六章 元素化学与无机材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第二章 化学反应基本原理与大气污染.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第四章 电化学与金属腐蚀.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第三章 水化学与水污染.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第一章 热化学与能源.pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷9(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷9(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷10(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷10(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷8(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷8(答案).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷7(试题).pdf
- 内蒙古科技大学:《普通化学》课程教学资源(试卷习题)模拟试卷7(答案).pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第06章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第05章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(2/2,2.10-2.18).ppt
- 《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(1/2,2.1-2.9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第0章 绪论、第1章 气体.ppt
- 《物理化学》课程教学课件(讲稿,AⅠ)第0-1章 绪论、气体(山东理工大学:薛莉).pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第6章 化学平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第5章 相平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第4章 多组分系统热力学及其在溶液中的应用.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第3章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第2章 热力学第一定律 The First Law of Thermodynamics.pdf
- 山东理工大学:《物理化学》课程教学大纲 Physical Chemistry A1.doc
- 《物理化学》课程教学课件(PPT讲稿)多组分系统练习题_多组分系统练习题.ppt
- 《物理化学》课程教学课件(PPT讲稿)相图练习题_相图练习题.ppt
