《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(2/2,2.10-2.18)

§2.10 Joule-Thomson效应 Joule-Thomson:效应 Joule在1843年所做的气体自由膨胀实验是不够精 确的,1852年Joule和Thomson设计了新的实验,称为 节流过程。 在这个实验中,使人们对实际气体的U和H的性质 有所了解,并且在获得低温和气体液化工业中有重要 应用。 ②也本开上大掌
1 §2.10 Joule-Thomson效应 Joule-Thomson效应 Joule在1843年所做的气体自由膨胀实验是不够精 确的,1852年Joule和Thomson设计了新的实验,称为 节流过程。 在这个实验中,使人们对实际气体的U和H的性质 有所了解,并且在获得低温和气体液化工业中有重要 应用
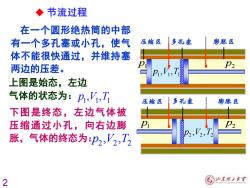
◆节流过程 在一个圆形绝热筒的中部 有一个多孔塞或小孔,使气 压缩区 多孔塞 膨胀区 体不能很快通过,并维持塞 两边的压差。 上图是始态,左边 气体的状态为:p,V,T 压缩区 多孔塞 膨胀区 下图是终态,左边气体被 压缩通过小孔,向右边膨 胀,气体的终态为p2,V2,T2 P2-V2-12 2 ⑥少东m2大¥
2 在一个圆形绝热筒的中部 有一个多孔塞或小孔,使气 体不能很快通过,并维持塞 两边的压差。 下图是终态,左边气体被 压缩通过小孔,向右边膨 胀,气体的终态为: 2 2 2 p V T , , 上图是始态,左边 气体的状态为: 1 1 1 p V T , , p1 p2 1 1 1 p V T , , p1 p2 2 2 2 p V T , , ◆ 节流过程
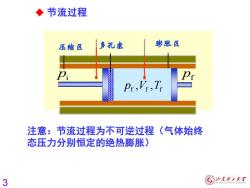
◆节流过程 压缩区 多孔寒 膨胀区 注意:节流过程为不可逆过程(气体始终 态压力分别恒定的绝热膨胀) 3 ⑥少本2大¥
3 pi pf i i i p V T , , pi pf pf f f f p V T , , ◆ 节流过程 注意:节流过程为不可逆过程(气体始终 态压力分别恒定的绝热膨胀)

◆节流过程的△H,△U 节流过程是在绝热筒中进行的,Q=0,所以: U,-U,=△U=W 开始,环境将一定量气体压缩时所作功(即 以气体为系统得到的功)为: W=-PAV =-P(0-V)=pV 气体通过小孔膨胀,对环境作功为: W2=-P2AV=-P2(V2-0)=-P,' 4 ③恤求开2大¥
4 W p V 1 1 = − 开始,环境将一定量气体压缩时所作功(即 以气体为系统得到的功)为: 节流过程是在绝热筒中进行的,Q = 0 ,所以: U U U W 2 1 − = = 气体通过小孔膨胀,对环境作功为: W p V 2 2 = − = − − p V V 1 1 1 1 (0 ) = p 2 2 2 ( 0 ) 2 = − − p V V = − p ◆ 节流过程的ΔH, ΔU

◆节流过程的△H,△U 在压缩和膨胀时,系统净功的变化应该是两个 功的代数和。 W=W+W2=PV-P2V2 即 U,-U=△U=W=pV-p2V3 移项 02+p2V2=0+PV H2=H1 △H=0 节流过程是个等焓过程 5 ⑥少东开大¥
5 在压缩和膨胀时,系统净功的变化应该是两个 功的代数和。 W W W p V p V 1 2 1 1 2 2 = + = − 即 U U U W 2 1 − = = 节流过程是个等焓过程 H H 2 1 = 移项 U p V U p V 2 2 2 1 1 1 + = + 1 1 2 2 = − pV p V = H 0 ◆ 节流过程的ΔH, ΔU

◆Joule-Thomson系数H-T 4-r称为Joule-Thomson系数,是 4T三 T、p的函数,它表示经节流过程后, 气体温度随压力的变化率。 4-T是系统的强度性质。因为节流过程的dp0 经节流膨胀后,气体温度降低。 4-T<0 经节流膨胀后,气体温度升高。 4灯-T=0 经节流膨胀后,气体温度不变。 6
6 是系统的强度性质。因为节流过程的 , 所以当: J-T d 0 p J-T ( )H T p = ◆ Joule-Thomson系数 J-T 称为Joule-Thomson系数,是 T、p的函数,它表示经节流过程后, 气体温度随压力的变化率。 J-T J-T >0 经节流膨胀后,气体温度降低。 J-T <0 经节流膨胀后,气体温度升高。 J-T =0 经节流膨胀后,气体温度不变

◆转化温度 (inversion temperature) 在常温下,一般气体的4灯均为正值。例如,空 气的4r=0.4K/100kPa,即压力下降100kPa,气 体温度下降0.4K。 但H2和He等气体在常温下,4r0 当4T=0时的温度称为转化温度,这时气体经焦 汤实验,温度不变。 7
7 ◆ 转化温度(inversion temperature) 当 时的温度称为转化温度,这时气体经焦 -汤实验,温度不变。 J-T = 0 在常温下,一般气体的 均为正值。例如,空 气的 ,即压力下降 ,气 体温度下降 。 100 kPa J-T J-T = 0.4 K /100 kPa 0.4 K 但 和 等气体在常温下, ,经节流 过程,温度反而升高。 He J-T 0 H2 若要降低温度,可调节操作温度使其 J-T 0

等焓线(isenthalpic curve) 为了求红的值,必须 作出等焓线,这要作若干个 节流过程实验。 实验1,左方气体为P,I,经 节流过程后终态为p,I,,在 Tp图上标出1、2两点。 气体的等焓线 实验2,左方气体仍为P,?,调节多孔塞或小孔大小, 使终态的压力、温度为p,I,这就是Tp图上的点3。 如此重复,得到若干个点,将点连结就是等焓线。 8
8 ◆ 等焓线(isenthalpic curve) 为了求 的值,必须 作出等焓线,这要作若干个 节流过程实验。 J-T 如此重复,得到若干个点,将点连结就是等焓线。 实验1,左方气体为 ,经 节流过程后终态为 ,在 T-p图上标出1、2两点。 p T2 2 pT1 1 实验2,左方气体仍为 ,调节多孔塞或小孔大小, 使终态的压力、温度为 ,这就是T-p图上的点3。 pT1 13 3 p T p T 1 2 3 4 5 6 7
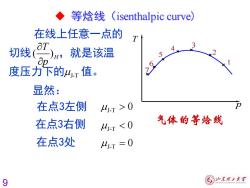
◆ 等焓线(isenthalpic curve) 在线上任意一点的 切线 江)n, 就是该温 D 度压力下的4红值。 显然: 在点3左侧 4-T>0 在点3右侧 4T<0 气体的等烩线 在点3处 4.T=0 9
9 显然: J-T 0 在点3右侧 J-T 0 在点3处 J-T = 0 在线上任意一点的 切线 ,就是该温 度压力下的 J-T 值。 ( )H T p 在点3左侧 p T 1 2 3 4 5 6 7 ◆ 等焓线(isenthalpic curve)

转化曲线(inversion curve) 选择不同的起始状态p,I, 作若干条等焓线。 r0, 是致冷区,在这个区内,可 以把气体液化; 虚线以右,4T<0,是致热区,气体通过节流过 程温度反而升高。 10 ⑥也东大¥
10 ◆ 转化曲线(inversion curve) 在虚线以左, , 是致冷区,在这个区内,可 以把气体液化; J-T 0 虚线以右, ,是致热区,气体通过节流过 程温度反而升高。 J-T 0 选择不同的起始状态 , 作若干条等焓线。 1 1 pT 将各条等焓线的极大值 相连,就得到一条虚线,将 T-p图分成两个区域
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第03章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第04章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第05章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第06章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 多组分系统热力学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 物理化学辅导与习题详解第五版(华中科技大学出版社).pdf
- 山东理工大学:《物理化学》课程授课计划(A)Ⅰ.doc
- 山东理工大学:《物理化学》课程授课教案(讲义,讨论稿).doc
- 《有机化学》课程教学资源(学习资料)有机人名反应 Organic Name Reactions.doc
- 安徽大学:《有机化学》课程授课教案 Organic Chemistry(讲稿,授课教师:冯燕,授课教师:冯燕).pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第五章 物质结构基础.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第七章 高分子化合物与材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第六章 元素化学与无机材料.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第二章 化学反应基本原理与大气污染.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第四章 电化学与金属腐蚀.pdf
- 内蒙古科技大学:《普通化学》课程教学课件(PPT讲稿)第三章 水化学与水污染.pdf
- 《物理化学》课程教学课件(PPT讲稿)第02章 热力学第一定律(1/2,2.1-2.9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第0章 绪论、第1章 气体.ppt
- 《物理化学》课程教学课件(讲稿,AⅠ)第0-1章 绪论、气体(山东理工大学:薛莉).pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第6章 化学平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第5章 相平衡.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第4章 多组分系统热力学及其在溶液中的应用.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第3章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《物理化学》课程教学课件(讲稿,AⅠ)第2章 热力学第一定律 The First Law of Thermodynamics.pdf
- 山东理工大学:《物理化学》课程教学大纲 Physical Chemistry A1.doc
- 《物理化学》课程教学课件(PPT讲稿)多组分系统练习题_多组分系统练习题.ppt
- 《物理化学》课程教学课件(PPT讲稿)相图练习题_相图练习题.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十四章 胶体分散系统和大分子溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十三章 表面物理化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第十二章 化学动力学基础(二).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十一章 化学动力学基础(一).ppt
- 《物理化学》课程教学课件(PPT讲稿)第十章 电解与极化作用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 可逆电池电动势及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电解质溶液.ppt
- 《物理化学》课程教学课件(PPT练习题)表面和胶体化学复习.ppt
- 《物理化学》课程教学资源(复习题,含答案)动力学复习.pdf
