南方医科大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论(2/2)

滴定分析法慨论 (2) 刘利红 南方医科大学
滴定分析法概论 (2) 刘利红 南方医科大学

酸度 平衡浓度 基本概念 分析浓度 分布系数公式推导 分布系数 衡的处理方法教学设计 乡布系数及客流中化学平 分布曲线 一元酸 多元酸 奥例及小结 酸碱质子理论 电荷平衡 水溶液中的酸碱平衡 物料平衡 质子条件 零水准法 内容小结
物料平衡 零水准法 电荷平衡 分布系数 分析浓度 平衡浓度 酸度 基本概念 分布系数公式推导 分布曲线 酸碱质子理论 水溶液中的酸碱平衡 质子条件 内容小结 实例及小结 多元酸 一元酸

第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 2、水溶液中溶质各型体的分布和分布系数 3、化学平衡的系统处理方法
第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 2、水溶液中溶质各型体的分布和分布系数 3、化学平衡的系统处理方法 3

第四节滴定分析中的化学平衡 1、活度、活度系数和平衡常数 ·分析化学关心的问题 ·测定的结果用浓度还是活度表示 ·判断由于离子强度的变化是否会对测量结果产生 不可忽略的影响 ·如何校正不可忽略的影响
1、活度、活度系数和平衡常数 • 分析化学关心的问题 • 测定的结果用浓度还是活度表示 • 判断由于离子强度的变化是否会对测量结果产生 不可忽略的影响 • 如何校正不可忽略的影响 第四节滴定分析中的化学平衡

·1.活度(@):在电解质溶液中,离子的“有效浓度” ·2活度系数(Y):是衡量实际溶液与理想液之间差别 的尺度0 溶液无限稀时:Y=1 ·浓度c与 中性分子:Y=1 容剂活度:a=1 V<1,则a<c: c<104molL,则y→1,aec ·在稀溶液中质量摩尔浓度与物质的量浓度差别不大,所 以计算中用物质的量浓度c表示(mo/L) 即:
• 1.活度(α):在电解质溶液中,离子的“有效浓度” • 2.活度系数(γ):是衡量实际溶液与理想溶液之间差别 的尺度. • 浓度c与活度a的关系 • α=γm • 在稀溶液中质量摩尔浓度与物质的量浓度差别不大,所 以计算中用物质的量浓度c 表示(mol/L) • 即: a ci = m为质量摩尔 浓度(mol/kg) 溶液无限稀时:γ =1 中性分子: γ = 1 容剂活度:α = 1 γ<1,则α<c; c<10-4mol/L,则γ→1,α≈c

活度系数y:对稀溶液m<0.1mol/kg或c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Z1-电荷 -lgY,=0.512Z2 B-常数,25C时为0.00328 A-离子体积华数,三水化离子 半径,以pm(10-12)计,离子 的a值见P41附录表2-1 离子强度较小时,可不考虑水化离子大小 /仁溶液中离子强度 德拜-休克尔极限公式 'i-离子的活度集数,a、人 Zi记知时,ri值见P42附录表2 -lgY,=0.5Z√7 2 1= C:i离子浓度 Z:i离子电荷
+ − = B I I i Zi 1 å lg 0.512 2 活度系数 6 γ:对稀溶液 m<0.1mol/kg 或 c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Zi-电荷 B-常数,25C时为0.00328 Å-离子体积系数,水化离子 半径,以pm(10-12)计,离子 的å值见P41附录表2-1 I-溶液中离子强度 ri-离子i的活度系数, å、 I、 Zi已知时, ri值见P42附录表2- 2 离子强度较小时,可不考虑水化离子大小, 德拜-休克尔极限公式: Z I i i 2 − lg = 0.5 = i i Zi I c 2 2 1 ci:i离子浓度 Zi:i离子电荷

例1计算0.10MOLL1HCL溶液中H+的活度。 解 OH+=YH+[H+]=YH+x0.1 mol/L 1=2∑c2=2Z+CZ) =x010 ml-.x+号x010mL× 2 =0.10mol.L a=0.83×0.10mol/L=0.083mol/L
例1 计算0.10 MOL·L -1 HCL溶液中H+的活度。 解 1 1 2 1 2 2 Cl 2 H 2 i i 0.10 mol L 0.10 mol L 1 2 1 0.10 mol L 1 2 1 ([H ] [Cl ] ) 2 1 2 1 − − − + − = = + I = c Z = Z + + Z − a = 0.83×0.10 mol/L = 0.083 mol/L αH+ =γH+[H+] =γH+ ×0.1 mol/L

例20.050mol/L的AICl3溶液中cc和aaI3+ 1=2∑e2=50050x32+3x0050x1)=030m01- 解 aa=300,aA=900,B=0.00328 -gy,=0.5122 1+Ba厅 -gyc=0.1882→yg-=0.66 -lgYA-=0.9644→Y4=0.11 高价离子影响大 .a=3×0.050×0.66=0.099molL a4=0.050×0.11=0.0055mol.L1
1 1 1 Cl A l 2 2 2 1 0.050 0.11 0.0055 3 0.050 0.66 0.099 lg 0.9644 0.11 lg 0.1882 0.66 lg 0.512 å 300 å 900 0.00328 (0.050 3 3 0.050 1 ) 0.30 2 1 2 1 3 3 3 - 3 − − + − = = = = − = = − = = − = = = = = = + = + − + + − − + a mol L a mol L Z B I c Z mol L A l Cl A l A l Cl Cl B a I I i i i i i , , 例2 0.050mol/L 的 AlCl3 溶液中 αCl- 和 αAl3+ 解 高价离子影响大
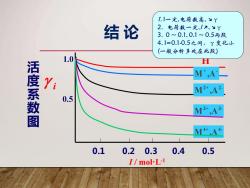
1.I一定,电荷数高,yY 结论 2.电荷数一定,/7,yY 3.0~0.1,0.1~0.5两段 4.1=0.1-0.5之问,Y变化小 (一般分析多处在此段) 1.0 H 活度系数图 M,A Yi M2+,A2 0.5 M3+,A3. M+ A+ 0.1 0.20.3 0.4 0.5 I/mol-L-1
活 度 系 数 图 0.1 0.2 0.3 0.4 0.5 1.0 0.5 i M ,A 3+ 3- M ,A 2+ 2- M ,A+ - + H M ,A 4+ 4- 1. I一定,电荷数高, ↘γ 2. 电荷数一定,I ↗, ↘γ 3. 0 ~ 0.1, 0.1 ~ 0.5两段 4. I=0.1-0.5之间,γ变化小 (一般分析多处在此段) I / mol·L-1 结 论

活度常数始、浓度常数及混合常数 1.活度常数K°: aA+bB cC+dD 形成常数 K 哈8 a 本章用K°处理平衡浓度之间的关系
活度常数Ka、浓度常数及混合常数 本章用K0 a处理平衡浓度之间的关系
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论(1/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.3 有限量测量数据的统计处理(2/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.2 有效数字及其运算规则、2.3 有限量测量数据的统计处理(1/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.1 测量值的准确度和精密度.ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical chemistry(主讲:刘利红).ppt
- 南方医科大学:《分析化学》课程教学资源(作业习题)分析化学(第8版)课后习题参考解答.pdf
- 南方医科大学:《分析化学》课程教学大纲 Analytical Chemistry.docx
- 山东第一医科大学(泰山医学院):《生物化学》课程各章习题集(打印版,含参考答案).pdf
- 山东第一医科大学(泰山医学院):《生物化学》课程实验指导 Biochemistry Experiment Direction(英文,打印版).pdf
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程实验指导(打印版,共七章).pdf
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程教学大纲(打印版,负责人:于兹喜).pdf
- 《医用化学》课程电子教案(PPT教学课件)第十八章 有机含氮化合物.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十九章 杂环化合物(aromatic heterocycles).ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十章 糖类.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十二章 氨基酸.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十一章 脂类.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十四章 卤代烃.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十六章 醛酮.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十五章 醇酚醚.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十三章 对映异构.ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第五章 配位滴定法 Complex formation Titration.pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 Acid-base titration.pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(1/3).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(2/3).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(3/3).pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第八章 重量分析法(主讲:田元新).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)复习串讲课件.pptx
- 海南大学:《无机化学》课程教学大纲 Inorganic Chemistry.pdf
- 海南大学:《无机化学》课程教学资源(作业习题)第一章 气体(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第二章 热化学(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第三章 化学动力学基础(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第五章 酸碱平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第四章 化学平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第七章 氧化还原反应(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第六章 沉淀溶解平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第九章 化学键与分子结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第八章 原子结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十章 固体结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十一章 配合物结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十三章 硼族碳族元素(含解答).doc
