南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(2/3)

复习回顾 0°=0°+0.059 lg YoraRed >条件电位及影响因素: 2 YRedaOx 电极电位越大,氧化性越强,还原性越弱;反之- 离子强度、生成沉淀、生成配合物、酸效应 >条件平衡常数计其影响因素 0.059 Ig K' △0≥0.35 nn, >反应速度及影响因素 应物浓度、温度、催化剂、诱导效应
复 习 回 顾 ➢条件电位及影响因素: 电极电位越大,氧化性越强,还原性越弱;反之- 离子强度、生成沉淀、生成配合物、酸效应 ➢条件平衡常数计其影响因素 ➢反应速度及影响因素 反应物浓度、温度、催化剂、诱导效应 d O x O x d n R e ' R e lg 0.059 = + lg 0.35 0.059 1 2 O' 2 O' 1 − = K n n

回 熟悉氧化还原滴定曲线及其相关计算, 款 熟练掌握化学计量点电位的计算及滴定 学 突越范围的计算(注意对称电位和不对 称电位的区别) © 熟悉氧化还原指示剂的分类及变色原理, 掌握常用的氧化还原滴定法的指示剂; 标
教 学 目 标 ☺ 熟悉氧化还原滴定曲线及其相关计算, 熟练掌握化学计量点电位的计算及滴定 突越范围的计算(注意对称电位和不对 称电位的区别); ☺ 熟悉氧化还原指示剂的分类及变色原理, 掌握常用的氧化还原滴定法的指示剂;

滴定曲线 n2Ox1+nRed2 nzRed1+njOx2 >随着滴定剂的加入,两个电对的电极电位不断发生变 化,并随时处于动态平衡中。可由任意一个电对计算出 溶液的电位值,对应加入的滴定剂体积绘制出滴定曲线 >滴定等当点前,常用被滴定物(量大)电对进行计算: >滴定等当点后,常用滴定剂(量大)电对进行计算;
滴定曲线 n2Ox1 + n1Red2 = n2Red1 + n1Ox2 ➢ 随着滴定剂的加入,两个电对的电极电位不断发生变 化,并随时处于动态平衡中。可由任意一个电对计算出 溶液的电位值,对应加入的滴定剂体积绘制出滴定曲线。 ➢ 滴定等当点前,常用被滴定物(量大)电对进行计算; ➢ 滴定等当点后,常用滴定剂(量大)电对进行计算;

0.1000mol·L1Ce(S0)2溶液滴定0.1000mol Fe2+的酸性溶液(1.0molL1硫酸) 滴定反应:Ce4++Fe2+=Ce3++Fe3+ 查表可知09ce+ce3+=1.44V;09Fe3*re2+=0.68V 1gK=144068=1296→该反应进行相当完全 0.059 反应为动态平衡,任何时刻两个电对的电极电位相等 g0e+00591ge-9+0059e Ce3+
0.1000 mol ·L-1 Ce(SO4 )2溶液滴定0.1000 mol ·L-1 Fe2+ 的酸性溶液(1.0 mol ·L-1硫酸) 滴定反应: Ce4+ + Fe2+ = Ce3+ + Fe3+ 查表可知' Ce4+/Ce3+= 1.44 V; ' Fe3+/Fe2+ = 0.68 V 反应为动态平衡,任何时刻两个电对的电极电位相等 + + + + + + + + + = + 3 o 4 4 3 2 o 3 3 2 C e ' C e C e /Ce F e ' F e F e /Fe 0.059lg 0.059lg c c c c = >> 该反应进行相当完全 − = 12.9 6 0.059 1.44 0.68 lg ' K

SP前 溶液中存在Fe3+/Fe2+,Ce4+/Ce3+ 滴定加入的Ce4+几乎全部被Fe2+还原成Ce3+,Ce4+ 的浓度极小,根据滴定百分数,由铁电对来计算电 极电位值。 99.9 SP前0.1%时: ≈103 0.1 00e*+0.0598C C2=0.68+0.059l1g103=0.86
3+ 2+ 4+ 3+ S P前:溶液中存在 F e F e ,C e C e 3 10 0.1 99.9 0.1% 2 3 = + + F e F e C C SP前 时: V C C F e F e F e F e 0.059 lg 0.6 8 0.059 lg1 0 0.8 6 ' 3 2 3 = 3 2 + = + = + + + + 滴定加入的Ce4+ 几乎全部被Fe2+ 还原成Ce3+ ,Ce4+ 的浓度极小,根据滴定百分数,由铁电对来计算电 极电位值
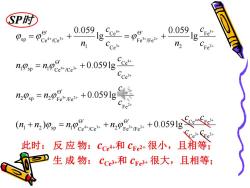
P时 0.059, 0.059 Ce+/Ce+ Cce二ΨFe3Fe2+人 -Ig- 11 n e n npsp=npcec+0.0591g Cce" n0p=n,0ge,+0.0591g年 C +%g,=n08+%02+0.0591gCC 此时:反应物:Cce+和Cre2+很小,且相等; 生成物:cce3+和ce3+很大,且相等;
SP时 + + + + + + + + + + + + + + + + + + + + + + + + + = + + = + = + = + = + 3 2 4 3 4 3 3 2 2 3 3 2 3 4 4 3 2 3 3 2 3 4 4 3 C e F e O C e F e 2 F e /Fe O 1 C e /Ce 1 2 s p F e O F e 2 F e /Fe 2 s p C e O C e 1 C e /Ce 1 s p F e F e 2 O F e /Fe C e C e 1 O C e /Ce s p ( ) 0.059lg 0.059lg 0.059lg lg 0.059 lg 0.059 c c c c n n n n c c n n c c n n c c c n c n 此时: 反 应 物:cCe4+和 cFe2+ 很小,且相等; 生 成 物: cCe3+和 cFe3+ 很大,且相等;

化学计量点时的溶液电位的通式: (n+n)=mp+n Psp np°+n,p9 n1+n2 仅适用于可逆的对称电位。 化学计量点电位:psp=(0.68+1.44)/(1+1) =2.12/2 =1.06V
化学计量点时的溶液电位的通式: 仅适用于可逆的对称电位 。 化学计量点电位: sp= (0.68 +1.44) / (1+1) = 2.12 / 2 = 1.06 V 1 2 O 2 2 O 1 1 s p O 2 2 O 1 2 s p 1 1 ( ) n n n n n n n n + + = + = +

SP后) 溶液中存在Fe3+/Fe2+,Ce+/Ce3+ 此时需要利用Ce4+/Ce3+电对来计算电位值。 当溶液中四价铈过量0.1%: SP后0.1%时: Cce 0.1 ≈10-3 100 C p=2ice+0.0591 e=1.44+0.0591g103=1.26V C e3+ 化学计量点前后电位突跃的位置由F2+剩余0.1% 和Ce4+过量0.1%时两点的电极电位所决定。即电位 突跃范围:0.86V~1.26
3+ 2+ 4+ 3+ S P后:溶液中存在 F e F e ,C e C e 3 10 100 0.1 0.1% 3 4 − = + + C e C e C C SP后 时: V C C C e C e C e C e 0.059 l g 1.4 4 0.059 l g1 0 1.2 6 3 3 4 = 4 3 + = + = − + + + + ‘ 此时需要利用Ce4+/Ce3+电对来计算电位值。 当溶液中四价铈过量0.1%: 化学计量点前后电位突跃的位置由 Fe2+ 剩余 0.1% 和 Ce4+过量 0.1% 时两点的电极电位所决定。即电位 突跃范围:0.86 V~1.26 V

滴定 百分数 COx/CRed 电极电位p/ 1.46 V Cre(皿/Ce(I) 0 10-1 0.62 50 100 0.68 1,06 91 101 0.74 99 102 0.80 0,86 99.9 103 0.86 0.76 100 1.06 0.66 (cce(v)/cce(m) 100.1 103 1.26 定突跃 0.56 101 10-2 1.32 0.46 110 10-1 1.38 0.3 020406080100120140160180200 20M 100 1.44 加入Ce4艹的量/%
滴定 百分数 cOx/cRed 电极电位 / V cFe(Ⅲ) /cFe(Ⅱ) 0 10-1 0.62 50 100 0.68 91 101 0.74 99 102 0.80 99.9 103 0.86 100 1.06 (cCe(Ⅳ) /cCe(Ⅲ) ) 100.1 10-3 1.26 101 10-2 1.32 110 10-1 1.38 200 100 1.44 滴 定 突 跃
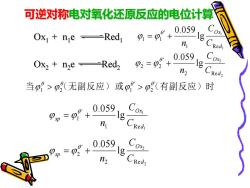
可逆对称电对氧化还原反应的电位计算 Ox ne -Red 0=0+ 0.059 n 0.059 Ox2 n2eRedz Cox n2 当p>p无副反应)或A>p(有副反应)时 ,g°+0059,。 n Pp=0+ C02 0.059gCed, n2
可逆对称电对氧化还原反应的电位计算 Ox1 + n1 e Red1 Ox2 + n2 e Red2 1 1 1 R e ' 1 1 lg 0.059 d O x C C n = + 2 2 2 R e ' 2 2 lg 0.059 d O x C C n = + 当 (无副反应) 或 (有副反应)时 ' 2 ' 1 2 1 > > 1 1 1 R e ' 1 lg 0.059 d O x sp C C n = + 2 2 2 R e ' 2 lg 0.059 d O x sp C C n = +
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(1/3).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 Acid-base titration.pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第五章 配位滴定法 Complex formation Titration.pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论(2/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论(1/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.3 有限量测量数据的统计处理(2/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.2 有效数字及其运算规则、2.3 有限量测量数据的统计处理(1/2).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第二章 误差和分析数据处理 2.1 测量值的准确度和精密度.ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical chemistry(主讲:刘利红).ppt
- 南方医科大学:《分析化学》课程教学资源(作业习题)分析化学(第8版)课后习题参考解答.pdf
- 南方医科大学:《分析化学》课程教学大纲 Analytical Chemistry.docx
- 山东第一医科大学(泰山医学院):《生物化学》课程各章习题集(打印版,含参考答案).pdf
- 山东第一医科大学(泰山医学院):《生物化学》课程实验指导 Biochemistry Experiment Direction(英文,打印版).pdf
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程实验指导(打印版,共七章).pdf
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程教学大纲(打印版,负责人:于兹喜).pdf
- 《医用化学》课程电子教案(PPT教学课件)第十八章 有机含氮化合物.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十九章 杂环化合物(aromatic heterocycles).ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十章 糖类.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十二章 氨基酸.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十一章 脂类.ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法(3/3).pptx
- 南方医科大学:《分析化学》课程教学资源(PPT课件)第八章 重量分析法(主讲:田元新).ppt
- 南方医科大学:《分析化学》课程教学资源(PPT课件)复习串讲课件.pptx
- 海南大学:《无机化学》课程教学大纲 Inorganic Chemistry.pdf
- 海南大学:《无机化学》课程教学资源(作业习题)第一章 气体(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第二章 热化学(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第三章 化学动力学基础(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第五章 酸碱平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第四章 化学平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第七章 氧化还原反应(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第六章 沉淀溶解平衡(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第九章 化学键与分子结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第八章 原子结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十章 固体结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十一章 配合物结构(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十三章 硼族碳族元素(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十二章 碱金属和碱土金属(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十五章 卤素元素与稀有气体(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十四章 氮族和氧族元素(含解答).doc
- 海南大学:《无机化学》课程教学资源(作业习题)第十七章 铜族锌族元素(含解答).doc
