《环境监测》课程实验指导书(共八个实验)

《环境监测》实验指导书河北理工大学资源与环境学院2009年12月
- 《环境监测》 实验指导书 河北理工大学资源与环境学院 2009 年 12 月
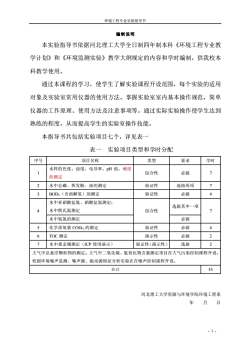
环境工程专业实验指导书编制说明本实验指导书依据河北理工大学全日制四年制本科《环境工程专业教学计划》和《环境监测实验》教学大纲规定的内容和学时编制,供我校本科教学使用。通过本课程的学习,使学生了解实验课程开设范围,每个实验的适用对象及实验室常用仪器的使用方法。掌握实验室室内基本操作规范,简单仪器的工作原理、使用方法及注意事项等。通过实际实验操作使学生达到熟练的程度,从而提高学生的实验室操作技能。本指导书共包括实验项目七个,详见表一表一实验项目类型和学时分配序号类型要求学时项目名称水样的色度、浊度、电导率、pH值、硬度71综合性必做的测定21验证性选做两项水中总磷、挥发酚、油的测定验证性必做34BODs(含溶解氧)的测定水中亚硝酸盐氮、硝酸盐氮测定;选做其中一项7水中凯氏氮测定综合性4水中氨氮的测定必做45验证性必做化学需氧量CODcr的测定演示性必做26TOC 测定选做22水中重金属测定(ICP使用演示)验证性(演示性)大气中总悬浮颗粒物的测定。大气中二氧化硫、氮氧化物含量测定项目在大气污染控制课程开设。校园环境噪声监测、噪声源、振动源特征分析实验在在噪声控制课程开设。合计33河北理工大学资源与环境学院环境工程系年月日.1-
环境工程专业实验指导书 - 1 - 编制说明 本实验指导书依据河北理工大学全日制四年制本科《环境工程专业教 学计划》和《环境监测实验》教学大纲规定的内容和学时编制,供我校本 科教学使用。 通过本课程的学习,使学生了解实验课程开设范围,每个实验的适用 对象及实验室常用仪器的使用方法。掌握实验室室内基本操作规范,简单 仪器的工作原理、使用方法及注意事项等。通过实际实验操作使学生达到 熟练的程度,从而提高学生的实验室操作技能。 本指导书共包括实验项目七个,详见表一 表一 实验项目类型和学时分配 序号 项目名称 类型 要求 学时 1 水样的色度、浊度、电导率、pH 值、硬度 的测定 综合性 必做 7 2 水中总磷、挥发酚、油的测定 验证性 选做两项 7 3 BOD5(含溶解氧)的测定 验证性 必做 4 4 水中亚硝酸盐氮、硝酸盐氮测定; 水中凯氏氮测定 综合性 选做其中一项 7 水中氨氮的测定 必做 5 化学需氧量 CODCr的测定 验证性 必做 4 6 TOC 测定 演示性 必做 2 7 水中重金属测定(ICP 使用演示) 验证性(演示性) 选做 2 大气中总悬浮颗粒物的测定。大气中二氧化硫、氮氧化物含量测定项目在大气污染控制课程开设。 校园环境噪声监测、噪声源、振动源特征分析实验在在噪声控制课程开设。 合计 33 河北理工大学资源与环境学院环境工程系 年 月 日

环境工程专业实验指导书实验一水样的色度、浊度、电导率、pH值、硬度的测定1.要求:本实验为综合性实验,要求学生在规定的课时内,完成对特定水样的色度、浊度、电导、pH值、硬度的测定。2.目的:(1)了解色度、浊度、电导率、pH值、硬度的含义。(2)掌握pH值、硬度原理和方法:掌握色度、浊度、电导率的测定方法。(3)通过实验使学生掌握目视比色法测定水的色度、浊度:掌握电导率测定仪的使用:实验一一1色度、浊度测定一、目的和要求(1了解色度、浊度的基本概念:(2)掌握色度、浊度的测定方法;二、原理水的色度、浊度、酸度和碱度均是衡量水质的重要要指标测定方法简述如下:色度是水样颜色深浅的度量。某些可溶性有机物、部分无机离子和有色悬浮微粒均可使水着色。水样的色度应以除去悬浮物后为准。色度通常采用铂钻比色法测定,即把氯铂酸钾和氯化钻配成标准色列,与被测水样水样的颜色进行比较,并规定浓度为1mg/L的铂所产生的颜色为1度。浊度是表示水中悬浮物对光线通过时所发生的阻碍程度,它与水样中存在颗粒物的含量、粒径大小、形状及颗粒表面对光散射特性等有关。水样中的的泥沙、粘土、有机物、无机物、浮游生物和共他微生物等悬浮物和胶体物质都可使水体浊度增加。我国采用1L蒸馏水中含有1mg二氧化硅所产生的浊度为1度。三、仪器与试剂(1)无色度、浊度水。将蒸馏水通过0.2微米滤膜过滤:弃去最初的250mL,以后用这样的水配制色度和浊度的标准溶液。(2)铂钻标准溶液。称取1.246g氯铂酸钾(K2PtC16)及1.000g氯化钴(CoC12-6H20).溶于200mL水中,加100mL浓盐酸,转入1000mL容里瓶后用水稀释至刻度,此标准溶液的色度相当于500度。(3)二氧化硅浊度溶液。称取约3g纯白陶土置于研钵中,加入少量水充分研磨成糊状.移入1000mL量筒中加水至标线,充分搅拌后静置24h,用虹吸法先弃去表面5cm深的液层,然后收集500mL,中间层的溶液。取50mL此悬浊液置于已经恒重的蒸发皿中,在水浴上蒸干,随后置于105℃烘箱内- 2 -
环境工程专业实验指导书 - 2 - 实验一 水样的色度、浊度、电导率、pH 值、硬度的测定 1.要求:本实验为综合性实验,要求学生在规定的课时内,完成对特定水样的色度、浊度、电 导、pH 值、硬度的测定。 2.目的: (1)了解色度、浊度、电导率、pH 值、硬度的含义。 (2)掌握 pH 值、硬度原理和方法;掌握色度、浊度、电导率的测定方法。 (3)通过实验使学生掌握目视比色法测定水的色度、浊度;掌握电导率测定仪的使用; 实验一-1 色度、浊度测定 一、目的和要求 (1)了解色度 、浊度的基本概念; (2)掌握色度、浊度的测定方法; 二、原理 水的色度、浊度、酸度和碱度均是衡量水质的重要要指标测定方法简述如下:色度是水样颜色 深浅的度量。某些可溶性有机物、部分无机离子和有色悬浮微粒均可使水着色。水样的色度应以除 去悬浮物后为准。色度通常采用铂钴比色法测定,即把氯铂酸钾和氯化钻配成标准色列,与被测水 样水样的颜色进行比较,并规定浓度为 1mg/L 的铂所产生的颜色为 1 度。 浊度是表示水中悬浮物对光线通过时所发生的阻碍程度,它与水样中存在颗粒物的含量、粒径 大小、形状及颗粒表面对光散射特性等有关。水样中的的泥沙、粘土、有机物、无机物、浮游生物 和共他微生物等悬浮物和胶体物质都可使水体浊度增加。我国采用 1L 蒸馏水中含有 1mg 二氧化硅所 产生的浊度为 1 度。 三、仪器与试剂 (1)无色度、浊度水。将蒸馏水通过 0.2 微米滤膜过滤.弃去最初的 250mL,以后用这样的水配 制色度和浊度的标准溶液。 (2)铂钴标准溶液。称取 1.246g 氯铂酸钾(K2PtCl6)及 1.000g 氯化钴(CoCl2·6H2O).溶于 200mL 水中,加 100mL 浓盐酸,转入 1000mL 容里瓶后用水稀释至刻度,此标准溶液的色度相当于 500 度。 (3)二氧化硅浊度溶液。称取约 3g 纯白陶土置于研钵中,加入少量水充分研磨成糊状.移入 1000mL量筒中加水至标线,充分搅拌后静置24h,用虹吸法先弃去表面5cm深的液层,然后收集500mL, 中间层的溶液。取 50mL 此悬浊液置于已经恒重的蒸发皿中,在水浴上蒸干,随后置于 105℃烘箱内

环境工程专业实验指导书供2h,冷却.称量求出每毫升悬浊液中含白陶土的质量(mg)。边摇边振:吸取含250mg白陶土的悬浊液于1000mL容量瓶中,加水至标线,此溶液振摇均匀后的浊度为250度。取此溶液100mL置于250mL容量瓶中,加水至标线得到浊度为100度的标准溶液,在各标准溶液中加入1g氯化汞保存,防止菌类生长。四、实验步骤1.色度的测定(1)取色度为500度的标准溶液1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00、12.00、14.00mL至于100mL比色管中,用水稀释至标线,其色度分别为5、10、15、20、25、30、35、40、45、50、60、70度。若封住管口,可长期保存。(2)取[100mL澄清水样(如果混浊,先经过离心处理,取上层清液)盛于100mL比色管中,与标准铂钴色度系列做目视比色,比色应在自然光线下进行,比色管底部衬一张白色纸张,或白色瓷板,比色管要稍微倾斜,使光线由液挂底部向上透过。如果水样色度超过70度,可用水稀释后比色。2.2.浊度的测定1)浊度为1~10mg/L的水样(1)吸取浊度为100mg/L的标准溶液0、1.00、2.00、4.00、6.00、8.00、10.00mL。置于100ml比色管中,加水至标线,混匀,其浊度依次为0、1.0、2.0、4.0、6.0、8.0、10.0度。(2)吸取100mL均匀水样置于100mL比色管中,和(1)配制的标准系列在黑色底板上进行目视比色。2)浊度为10~100mg/L的标准溶液0、10.0、20.0、30.0、40.0、50.0、60.0、70.0、80.0、90.0、100.0mL置于250mL容量瓶中,加水至标线,混匀,得到浊度为0、10、20、30.、40、50、60、70、80、90、100度的标准系列,转入250mL具塞的无色玻璃瓶中。2)吸取250mL水样,置于250mL具寒的无色玻璃瓶中,摇匀。将瓶底底放在有黑线的白纸上作为判别标志,眼睛从瓶前向后看、记录与水样有同样浊度的标准溶液度数。如水样浊度超过100度时,需稀释后再测定。五、数据处理1.色度-VX 500式中:C一一水样的色度,度:M一一相当于铂钻溶液用量,mL;- 3 -
环境工程专业实验指导书 - 3 - 供 2h,冷却.称量 求出每毫升悬浊液中含白陶土的质量(mg)。 边摇边振.吸取含 250mg 白陶土的悬浊液于1000mL 容量瓶中,加水至标线,此溶液振摇均 匀后的浊度为 250 度。取此溶液 100mL 置于 250mL 容量瓶中,加水至标线.得到浊度为 100 度的标 准溶液,在各标准溶液中加入 1g 氯化汞保存,防止菌类生长。 四、实验步骤 1.色度的测定 (1)取色度为 500 度的标准溶液 1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00、9.00、 10.00、12.00、14.00mL 至于 100mL 比色管中,用水稀释至标线,其色度分别为 5、10、15、20、25、 30、35、40、45、50、60、70 度。若封住管口,可长期保存。 (2)取[100mL 澄清水样(如果混浊,先经过离心处理,取上层清液)盛于 100mL 比色管中,与 标准铂钴色度系列做目视比色,比色应在自然光线下进行,比色管底部衬一张白色纸张,或白色瓷 板,比色管要稍微倾斜,使光线由液拄底部向上透过。如果水样色度超过 70 度,可用水稀释后比色。 2. 2.浊度的测定 1)浊度为 1~10mg/L 的水样 (1)吸取浊度为 100mg/L 的标准溶液 0、1.00、2.00、4.00、6.00、8.00、10.00mL。置于 100mL 比色管中,加水至标线,混匀,其浊度依次为 0、1.0、2.0、4.0、6.0、8.0、10.0 度。 (2)吸取 100mL 均匀水样置于 100mL 比色管中,和(1)配制的标准系列在黑色底板上进行目 视比色。 2)浊度为 10~100mg/L 的标准溶液 0、10.0、20.0、30.0、40.0、50.0、60.0、70.0、80.0、 90.0、100.0mL 置于 250mL 容量瓶中,加水至标线,混匀,得到浊度为 0、10、20、30.、40、50、 60、70、80、90、100 度的标准系列,转入 250mL 具塞的无色玻璃瓶中。 (2)吸取 250mL 水样,置于 250mL 具寒的无色玻璃瓶中.摇匀。将瓶底底放在有黑线的白纸上作 为判别标志,眼睛从瓶前向后看、记录与水样有同样浊度的标准溶液度数。如水样浊度超过 100 度 时,需稀释后再测定。 五、数据处理 1. 色度 式中:C——水样的色度,度; M——相当于铂钴溶液用量,mL;

环境工程专业实验指导书V—一水样体积,mL。2.浊度C= AX(B+Y)V式中:C——水样的浊度,度;A一—稀释后水样的浊度,度;B一一稀释水体积,ml;V一一原水样体积,ml。六、注意事项1.色度(1)PH对色度影响较大,pH高时往往色度加深,故在测量色度时应测量溶液底pH。(2)当水体受污染,水样的颜色与标准色列不一致时:应用文字描述颅色。(3)由于氯铂酸钾价格太贵,也可称取0.5000g铂丝,溶于适量王水中,于通风橱内,放在石棉网上加热使铂丝溶解生成氯铂酸,蒸发至干。加少许盐酸,加热使剩余的硝酸分解,如此反复处理数次。加入1.000g氯化钻(CoC12·6H20)和100mL纯水.再加100mL盐酸,穆人2000mL容量瓶内,用纯水定容所得标准液的色度为500度。2.浊度(1)配制浊度标准所用的标准品有硅藻土和高岭土,它们的成分都以A1203岭土及硅藻土配制的浊度标准液的吸光度相差很大、其结果可相差2一3倍。(2)水样的浊度也可用光度法进行测定即在波长为660nm处,用10mm比色皿测定浊度标淮溶液的吸光度,绘制标准曲线、然后在同样条件下测量水样的吸光波在标准曲线上查得相应的浊度值。(3)透明度的含义与浊度相反,但二者都反映水中杂质对透过光线的阻碍程度,当对浊度的精确废要求不高时,也可测定水样的透明度度,通过透明度与浊度换算表查得浊度。实验——22电导率测定一.目的1.了解电导率的含义。2.掌握电导率的测定方法。二.原理电导率是以数字表示溶液传导电流的能力。纯水电导率很小,当水中含无机酸、碱或盐时,电导率增加。电导率常用于间接推测水中离子成分的总浓度。水溶液的电导率取决于离子的性质和浓- 4 -
环境工程专业实验指导书 - 4 - V——水样体积,mL。 2.浊度 式中:C——水样的浊度,度; A——稀释后水样的浊度,度; B——稀释水体积,ml; V——原水样体积,ml。 六、注意事项 1.色度 (1)PH 对色度影响较大,pH 高时往往色度加深,故在测量色度时应测量溶液底 pH。 (2)当水体受污染,水样的颜色与标准色列不一致时.应用文字描述颅色。 (3)由于氯铂酸钾价格太贵,也可称取 0.5000g 铂丝,溶于适量王水中,于通风橱内,放在 石棉网上加热使铂丝溶解生成氯铂酸,蒸发至干。加少许盐酸,加热使剩余的硝酸分解,如此反复 处理数次。加入 1.000g 氯化钴(CoCl2·6H20)和 100mL 纯水.再加 100mL 盐酸,穆人 2000mL 容量瓶 内,用纯水定容.所得标准液的色度为 500 度。 2.浊度 (1)配制浊度标准所用的标准品有硅藻土和高岭土,它们的成分都以 Al2O3 岭土及硅藻土配制 的浊度标准液的吸光度相差很大、其结果可相差 2—3 倍。 (2)水样的浊度也可用光度法进行测定.即在波长为 660nm 处,用 10mm 比色皿测定浊度标淮溶液的吸光度,绘制标淮曲线、然后在同样条件下测量水样的吸光波, 在标准曲线上查得相应的浊度值。 (3)透明度的含义与浊度相反,但二者都反映水中杂质对透过光线的阻碍程度,当对浊度的 精确废要求不高时,也可测定水样的透明度度,通过透明度与浊度换算表查得浊度。 实验一-2 电导率测定 一.目的 ⒈了解电导率的含义。 ⒉掌握电导率的测定方法。 二.原理 电导率是以数字表示溶液传导电流的能力。纯水电导率很小,当水中含无机酸、碱或盐时,电 导率增加。电导率常用于间接推测水中离子成分的总浓度。水溶液的电导率取决于离子的性质和浓

环境工程专业实验指导书度、溶液的温度和粘度等。电导率的标准单位是S/m,一般实际使用单位为us/cm,此单位与10uQ/cm相当。单位间的互换为:1mS/m=0.01mS/cm=10uQ/cm=10uS/cm新蒸馏水电导率为0.5~2us/cm,存放一段时间后,由于空气中的二氧化碳或氨的溶入,电导率可上升至2~4us/cm;饮用水电导率在5~1500us/cm之间:海水电导率大约为30000us/cm,清洁水电导率约为100us/cm。电导率随温度变化而变化,温度每升高1℃,电导率增加约2%,通常规定25℃为测定电导率的标准温度。便携式电导率仪由于电导是电阻的倒数,因此,当两个电极插入溶液中,可以测出两电极间的电阻R,根据欧姆定律,温度一定时,这个电阻值与电极的间距L(cm)成正比,与电极间的截面积成反比:R=pL/A。由于电极面积A和间距L都是固定不变的,帮L/A是一常数,称电导池常数(Q)。比例常数p称作电阻率。其倒数1/p称为电导率,以K表示。S=1/R=1/pQS表示电导度,反映导电能力的强弱。所以,K=QS或K=Q/R当已知电导池常数,并测出电阻后,即可求出电导率。三.仪器便携式电导率仪、仪器配套的校准溶液四. 试剂1.纯水(电导率小于0.1mS/m)。2.氯化钾标准溶液C=0.0100mol/L称取0.7456g于105℃烘干2h并冷却的氯化钾,溶于纯水中,于25℃下定容至1000ml。此溶液在25℃时电导率为141.3mS/m。必要时可适当稀释,各种浓度氯化钾溶液的电导率(25℃)见下表电导率(mS/m)浓度(mol/l)0.00011.4947.390.00050.00114.70.00571.78五.步骤用水冲洗数次电导池,再用水样冲洗后,装满水样,重复数次,使电阻稳定在土2%范围内,取其平均值测定其电阻。实验一~3pH值测定一,目的1.了解pH值的含义。2.掌握复合电极法测定水样pH值的原理和方法。二.原理pH值为水中氢离子活度的负对数。-5 -
环境工程专业实验指导书 - 5 - 度、溶液的温度和粘度等。 电导率的标准单位是 S/m,一般实际使用单位为 us/cm,此单位与 10µΩ/cm 相当。 单位间的互换为: 1 mS/m=0.01 mS/cm=10µΩ/cm=10µS/cm 新蒸馏水电导率为 0.5~2us/cm,存放一段时间后,由于空气中的二氧化碳或氨的溶入,电导率可上升至 2~4 us/cm;饮用水电导率在 5~1500 us/cm 之间;海水电导率大约为 30000 us/cm,清洁水电导率约 为 100 us/cm。电导率随温度变化而变化,温度每升高 1℃,电导率增加约 2%,通常规定 25℃为测 定电导率的标准温度。 便携式电导率仪 由于电导是电阻的倒数,因此,当两个电极插入溶液中,可以测出两电极间的电阻 R,根据欧姆 定律,温度一定时,这个电阻值与电极的间距 L(cm)成正比,与电极间的截面积成反比: R = L / A 。 由于电极面积 A 和间距 L 都是固定不变的,帮 L/A 是一常数,称电导池常数(Q)。 比例常数 ρ 称作电阻率。其倒数 1/ρ 称为电导率,以 K 表示。 S=1/R=1/ρQ S 表示电导度,反映导电能力的强弱。所以,K=QS 或 K=Q/R 当已知电导池常数,并测出电阻后,即可求出电导率。 三. 仪器 便携式电导率仪、仪器配套的校准溶液 四. 试 剂 ⒈纯水(电导率小于 0.1 mS/m)。 ⒉氯化钾标准溶液 C=0.0100mol/L。 称取 0.7456g 于 105℃烘干 2h 并冷却的氯化钾,溶于纯水中,于 25℃下定容至 1000ml。此溶液 在 25℃时电导率为 141.3 mS/m。 必要时可适当稀释,各种浓度氯化钾溶液的电导率(25℃)见下表 浓度(mol/l) 电导率(mS/m) 0.0001 1.494 0.0005 7.39 0.001 14.7 0.005 71.78 五. 步 骤 用水冲洗数次电导池,再用水样冲洗后,装满水样,重复数次,使电阻稳定在±2%范围内,取 其平均值测定其电阻。 实验一~3pH 值测定 一.目的 ⒈ 了解 pH 值的含义。 ⒉ 掌握复合电极法测定水样 pH 值的原理和方法。 二.原理 pH 值为水中氢离子活度的负对数

环境工程专业实验指导书pH=-log 1oαnpH值可间接地表示水的酸碱程度。天然水的pH值一般在6一9范围内。由于pH值随水温变化而变化,测定时应在规定的温度下进行,或者校正温度。玻璃电极法是以玻璃电极为指示电极,饱和甘汞电极为参比电极组成的工作电池,此时电池可用下式表示:Ag,AgCIHC玻璃膜水样I(饱和)KCIHg2CI,Hg在一定条件下,上述电池的电动势与水样的pH值呈直线关系,可表示为:E=Eo+0.059pH(25℃)在实际工作中,不可能用上式直接计算pH值,而是用一个确定的标准缓冲溶液做基准,并比较包含水样和饱含标准缓冲液的两个工作电池的电动势来确定水样的pH值。三.仪器1.复合玻璃电极2.磁力搅拌器3.聚乙烯或聚四氟乙烯烧杯四.试剂标准缓冲溶液按下表规定的数量称取试剂,溶于25℃水中,在容量瓶内定容至1000ml。标准缓冲溶液标准物质pH(25℃)每1000ml水溶液中所含试剂的质量(25℃)基本标准3.5576.4g KHCaHaO6酒石酸氢钾(25℃饱和)柠檬酸二氢钾3.77611.41g KH2C6HsO74.008邻苯二甲酸氢钾10.12gKHC8HaO43.388g KH2PO."+3.533g Na2HPO.m磷酸二氢钾+磷酸氢二钠6.8651.179g KH2PO.+4.302g Na2HPO.m磷酸二氢钾+磷酸氢二钠7.413四硼酸钠9.1803.80g NazB,O710H20m10.012碳酸氢钠+碳酸钠2.92gNaHCO3+2.640Na2CO辅助标准1.67912.61g KH2C4H-2H20二水合四草酸12.454氢氧化钙(25℃饱和)1.5g Ca(OH)2注:(1)须在110—130℃烘干2h。(2)烘干温度不可超出60℃。(3)须用新煮过并冷却的无二氧化碳水配制。五.测定步骤1.按照所用仪器的使用说明书调试。2.用广泛试纸粗测水样pH值,选用与水样pH值相差不超过2个pH值单位的标准溶液校准仪器。3.把用蒸馏水清洗过的电极插入该标准液中,调节定位调节旋钮、使仪器显示读数与该标准液当时温度下的pH值相一致。4.从第一个标准溶液中取出电极用蒸馏水彻底清洗,用滤纸吸干,再插入第二个标准溶液中,其pH值约与前一个相差3个pH值单位。调节斜率旋钮使仪器显示读数与该标准液当时温度下的pH值相一致。5.重复3、4直至不用再调节定位或斜率两调节旋钮为止,仪器完成标定。6.当被测溶液与定位溶液温度相同时。把电极浸入被测溶液中,用玻璃棒搅拌溶液,使溶液均- 6 -
环境工程专业实验指导书 - 6 - pH= + − 10 H log pH 值可间接地表示水的酸碱程度。天然水的 pH 值一般在 6—9 范围内。由于 pH 值随水温变化 而变化,测定时应在规定的温度下进行,或者校正温度。 玻璃电极法是以玻璃电极为指示电极,饱和甘汞电极为参比电极组成的工作电池,此时电池可 用下式表示: Ag,AgCl|HCl|玻璃膜|水样||(饱和)KCl|Hg2Cl,Hg 在一定条件下,上述电池的电动势与水样的 pH 值呈直线关系,可表示为: E=E0+0.059pH (25℃) 在实际工作中,不可能用上式直接计算 pH 值,而是用一个确定的标准缓冲溶液做基准,并比 较包含水样和饱含标准缓冲液的两个工作电池的电动势来确定水样的 pH 值。 三. 仪器 ⒈复合玻璃电极 ⒉磁力搅拌器 ⒊聚乙烯或聚四氟乙烯烧杯 四. 试剂 标准缓冲溶液按下表规定的数量称取试剂,溶于 25℃水中,在容量瓶内定容至 1000ml。 标准缓冲溶液 标准物质 pH (25℃) 每 1000ml 水溶液中所含试剂的质量(25℃) 基本标准 酒石酸氢钾(25℃饱和) 3.557 6.4g KHC4H4O6 柠檬酸二氢钾 3.776 11.41g KH2C6H5O7 邻苯二甲酸氢钾 4.008 10.12g KHC8H4O4 磷酸二氢钾+磷酸氢二钠 6.865 3.388g KH2PO4 ⑴ +3.533g Na2HPO4 ⑴⑵ 磷酸二氢钾+磷酸氢二钠 7.413 1.179g KH2PO4 ⑴ +4.302g Na2HPO4 ⑴⑵ 四硼酸钠 9.180 3.80g Na2B4O7 •10H2O ⑶ 碳酸氢钠+碳酸钠 10.012 2.92g NaHCO3+2.640Na2CO3 辅助标准 二水合四草酸 1.679 12.61g KH2C4H8•2H2O ⑵ 氢氧化钙(25℃饱和) 12.454 1.5g Ca(OH)2 注:⑴须在 110—130℃烘干 2h。 ⑵烘干温度不可超出 60℃。 ⑶须用新煮过并冷却的无二氧化碳水配制。 五. 测定步骤 ⒈ 按照所用仪器的使用说明书调试。 ⒉ 用广泛试纸粗测水样 pH 值,选用与水样 pH 值相差不超过 2 个 pH 值单位的标准溶液校准仪 器。 ⒊ 把用蒸馏水清洗过的电极插入该标准液中,调节定位调节旋钮、使仪器显示读数与该标准液 当时温度下的 pH 值相一致。 ⒋ 从第一个标准溶液中取出电极用蒸馏水彻底清洗,用滤纸吸干,再插入第二个标准溶液中, 其 pH 值约与前一个相差 3 个 pH 值单位。调节斜率旋钮使仪器显示读数与该标准液当时温度下的 pH 值相一致。 ⒌ 重复 3、4 直至不用再调节定位或斜率两调节旋钮为止,仪器完成标定。 ⒍ 当被测溶液与定位溶液温度相同时。把电极浸入被测溶液中,用玻璃棒搅拌溶液,使溶液均

环境工程专业实验指导书匀,在显示屏上读出溶液的稳定pH值。7.当被测溶液和定位溶液温度不同时,用蒸馅水清洗电极头部,用被测溶液清洗一次,用温度计测出被测溶液的温度值,调节“温度调节旋钮,使白线对准被测溶液的温度值。把电极浸入被测溶液中,用玻璃棒搅拌溶液,使溶液均匀,在显示屏上读出溶液的稳定pH值。六.pH校正曲线的绘制(玻璃电极法)用电极法测定水样PH值所必需的玻璃电极除了易碎外,还易“老化”。而后者对测定结果的影响往往不易察觉。因此,在测定前有必要作pH校正曲线,以衡量玻璃电极是否“老化”。如测定稍有误差也可借此得到校正。1.首先准备酸性、中性、碱性三种pH缓冲溶液。如pH4.00(或pH4.003)、pH7.00(或pH6.864)、pH9.00(或pH9.182)。(pH缓冲试剂有市售,也可自行配制)。2.将玻璃电极在纯水中浸泡活化一昼夜,与甘汞电极一起分别与pH计连接。然后以其插入中性pH缓冲溶液中。校零、定位。再分别测定pH4.00和pH9.00。记录实测值,然后以标准缓冲溶液的pH值为纵坐标(校正值),以实测值为横坐标在方格坐标上描点,从定位电(pH7.00)分别连接另外两点并适当延长,即为pH校正曲线。a6pH实测值图1H校正曲线当实测pH值与相应的pH缓冲溶液的pH值相差较大时,说明电极反应迟钝,“老化”严重,需要更换新电极。3.玻璃电极和甘汞电极外形示意图如下:-7-
环境工程专业实验指导书 - 7 - 匀,在显示屏上读出溶液的稳定 pH 值。 ⒎ 当被测溶液和定位溶液温度不同时,用蒸馏水清洗电极头部,用被测溶液清洗一次,用温度 计测出被测溶液的温度值,调节“温度”调节旋钮,使白线对准被测溶液的温度值。把电极浸入被测 溶液中,用玻璃棒搅拌溶液,使溶液均匀,在显示屏上读出溶液的稳定 pH 值。 六. pH 校正曲线的绘制(玻璃电极法) 用电极法测定水样 pH 值所必需的玻璃电极除了易碎外,还易“老化”。而后者对测定结果的影响往往 不易察觉。因此,在测定前有必要作 pH 校正曲线,以衡量玻璃电极是否“老化”。如测定稍有误差, 也可借此得到校正。 ⒈首先准备酸性、中性、碱性三种 pH 缓冲溶液。如 pH4.00(或 pH4.003)、pH7.00(或 pH6.864)、 pH9.00(或 pH9.182)。(pH 缓冲试剂有市售,也可自行配制)。 ⒉将玻璃电极在纯水中浸泡活化一昼夜,与甘汞电极一起分别与 pH 计连接。然后以其插入中 性 pH 缓冲溶液中。校零、定位。再分别测定 pH4.00 和 pH9.00。记录实测值,然后以标准缓冲溶液 的 pH 值为纵坐标(校正值),以实测值为横坐标在方格坐标上描点,从定位电(pH7.00)分别连接 另外两点并适当延长,即为 pH 校正曲线。 当实测 pH 值与相应的 pH 缓冲溶液的 pH 值相差较大时,说明电极反应迟钝,“老化”严重,需 要更换新电极。 ⒊ 玻璃电极和甘汞电极外形示意图如下:

环境工程专业实验指导书2RHed纤维家附图1玻璃电极示意图附图2复合玻瑞电报示意图附图3甘录电极示意图1、玻璃膜、2、内充液1、玻璃膜2、盐桥液出口3、电极杆3、Ag/AgCI内参比电极4、Ag/AgCI内参比电极4、盐桥液5、加液口5、电极导线6、电极导线66六.注意事项1.仪器使用前要标定,一般连续使用时每天要标定一次。经标定后,定位调节旋钮及斜率旋钮不应再有变动。2.复合电极取下电极套后,应避免电极的敏感玻璃泡与硬物接触,硬物接触,因为任何破损或擦毛都使电极失效。3.测量后,及时将电极保护套套上,电极套内应放少量内参比补充液以保持电极球泡的润湿,切忌浸泡在蒸馏水中。实验一~5、水的硬度测定一、实验目的1.简单了解配位滴定法中以EDTA为滴定剂测定水的硬度的原理,并了解测定水的硬度的操作方法。2.测定水的硬度。3.进一步练习移液管、滴定管的使用及滴定操作。二、实验原理1.水硬度的定义水的硬度决定于钙、镁等盐类的含量,由于钙镁等的酸式盐的存在而引起的硬度叫做碳酸盐硬度。当煮沸时,这些盐类分解,大部分生成碳酸盐沉淀而除去。习惯上把它叫做暂时硬度。例如:Ca(HCO3)2 = CaCO;+CO2 +H2O由钙、镁的氯化物、硫酸盐、硝酸盐等引起的硬度叫做非碳酸盐硬度。由于这些盐类不可能借煮沸生成沉淀而除去,因此习惯上把它叫做永久硬度。碳酸盐硬度和非碳酸盐硬度之和就是水的总硬度。硬水不适宜于工业上使用,如锅炉里用了硬水,经长期烧煮后,能生成锅垢,既浪费燃料,又易阻塞管道,造成重大事故。有几种常用的硬度单位:一种是以每dm水中所含Ca2+(或相当量Mg2+)的毫摩尔数表示的,- 8 -
环境工程专业实验指导书 - 8 - 六.注意事项 ⒈ 仪器使用前要标定,一般连续使用时每天要标定一次。经标定后,定位调节旋钮及斜率旋钮 不应再有变动。 ⒉ 复合电极取下电极套后,应避免电极的敏感玻璃泡与硬物接触,硬物接触,因为任何破损或 擦毛都使电极失效。 ⒊ 测量后,及时将电极保护套套上,电极套内应放少量内参比补充液以保持电极球泡的润湿, 切忌浸泡在蒸馏水中。 实验一~5、水的硬度测定 一、实验目的 1.简单了解配位滴定法中以 EDTA 为滴定剂测定水的硬度的原理,并了解测定水的硬度的操作 方法。 2.测定水的硬度。 3.进一步练习移液管、滴定管的使用及滴定操作。 二、实验原理 1.水硬度的定义 水的硬度决定于钙、镁等盐类的含量,由于钙镁等的酸式盐的存在而引起的硬度叫做 碳酸盐硬度。当煮沸时,这些盐类分解,大部分生成碳酸盐沉淀而除去。习惯上把它叫做暂时硬度。 例如: Ca(HCO3)2 CaCO3+CO2 +H2O 由钙、镁的氯化物、硫酸盐、硝酸盐等引起的硬度叫做非碳酸盐硬度。由于这些盐类不可能借煮沸 生成沉淀而除去,因此习惯上把它叫做永久硬度。碳酸盐硬度和非碳酸盐硬度之和就是水的总硬度。 硬水不适宜于工业上使用,如锅炉里用了硬水,经长期烧煮后,能生成锅垢,既浪费燃料,又 易阻塞管道,造成重大事故。 有几种常用的硬度单位:一种是以每 dm3 水中所含 Ca2+(或相当量 Mg2+)的毫摩尔数表示的

环境工程专业实验指导书以1dm2水中含有0.5毫摩尔Ca2+为1度;一种是以1dm2水中含10毫克Ca0为1度,称为德国硬度,以DH表示。8DH以下为软水,8~10DH为中等硬水,16~30DH为硬水,硬度大于30DH的属于很硬的水;另外也有以每升水中所含的钙、镁化合物换算成CaCO的毫克数表示的。本实验采用德国硬度表示水的硬度。2.配位滴定法测定水的硬度。配位滴定法是以配位反应为基础的滴定分析方法,螯合物又是目前该方法中应用最广的一类配位化合物。因为它的稳定性强,适当控制就能得到所需的配位化合物,有的螯合剂对金属离子有选择性。乙二胺四乙酸是具有羧基和氨基的螯合剂,能与许多阳离子形成稳定的螯合物,因此被广泛用作配位滴定法中的滴定剂。乙二胺四乙酸简称EDTA或EDTA酸,用H4Y表示。通常把它的溶解度较大的二钠盐也称EDTA,实际使用中常用H2Y-表示。EDTA与金属离子等摩尔发生反应,生成具有多个五元环的稳定的整合物。铬黑T是偶氮类染料,能与金属离子生成稳定的有色配位化合物。它既是一种配位剂,又是一种显色剂,因而可以指示滴定终点,当pH=6.3~11.55时,铬黑T显蓝色。EDTA在pH为8.5~11.5的缓冲溶液中能与Ca2+、Mg2+形成无色的整合物,指示剂铬黑T在同样条件下也能与Ca2+、Mg2+形成酒红色的配位化合物。在开始滴定前,溶液中Ca2+、Mg?+离子先与指示剂配位而显酒红色:当用EDTA滴定时,EDTA首先与溶液中游离的Ca2+、Mg2+离子进行配位,生成更稳定的无色整合物:继续加入EDTA滴定剂,当游离的Ca2+、Mg2*离子全部与EDTA配位后,由于Ca2+、Mg2+离子与指示剂形成的配位化合物不如与EDTA生成的螯合物稳定,原来Ca+、Mg2+离子与铬黑T生成的配位化合物会转化成与EDTA配位的螯合物,因此络黑T又游离了出来,溶液就由酒红色变成为游离络黑T的蓝色,此时即为滴定终点。其反应简式如下:EDTAMEDTA+InM+InMn =金属离子指示剂配位化合物鉴合物Ca'*CaCaEREA 5-115Mg+HIn2-(MgIn)-(MgEDTA) + HI.2-铬黑T(蓝色)(蓝色)(酒红色)按下式公式可计算水的总硬度(度):总硬度(DH)=C*VmxMca0×10V水样10(7-1)测定水的总硬度时,用NH·H2O-NH4CI缓冲液调节pH值。以铬黑T为指示剂,用EDAT标准溶液滴定至溶液显蓝色为止。三、实验仪器与试剂仪器:250cm3锥形瓶,50cm2、25cm2移液管,50cm酸式滴定管,200cm2烧杯,100cm3量筒,洗耳球,蝴蝶夹,铁架台,洗瓶试剂:水样1,水样2,水样3,铬黑T指示剂,NH3·H2O-NH4CI缓冲溶液100cm3,无水乙醇90cm,0.01mol·dm3钙镁标准溶液,0.01mol·dm23EDTA溶液四、实验步骤1.EDTA溶液的标定用25.00cm3移液管精确吸取0.01mol·dm-3钙镁标准溶液,放入250cm3锥形瓶中,再加入NH3·H2O-NH4CI缓冲溶液5cm3及络黑T3滴,用EDTA溶液滴定至溶液由酒红色转变为蓝色,记录滴定时消耗EDTA溶液的体积,平行滴定三次,滴定误差不得超过0.25cm。取平均值,按下式计算EDTA溶液的物质的量浓度:CEDTs(mol-dm~)=25.00×0.01VEDTA(cm")(7-2)- 9 -
环境工程专业实验指导书 - 9 - EDTA M + In MIn MEDTA+In 以 1 dm3 水中含有 0.5 毫摩尔 Ca2+为 l 度;一种是以 1 dm3 水中含 10 毫克 CaO 为 1 度,称为德国硬 度,以 DH 表示。8DH 以下为软水,8~10DH 为中等硬水,16~30DH 为硬水,硬度大于 30DH 的 属于很硬的水;另外也有以每升水中所含的钙、镁化合物换算成 CaCO3 的毫克数表示的。本实验采 用德国硬度表示水的硬度。 2.配位滴定法测定水的硬度。 配位滴定法是以配位反应为基础的滴定分析方法,螯合物又是目前该方法中应用最广的一类配 位化合物。因为它的稳定性强,适当控制就能得到所需的配位化合物,有的螫合剂对金属离子有选 择性。乙二胺四乙酸是具有羧基和氨基的螯合剂,能与许多阳离子形成稳定的螯合物,因此被广泛 用作配位滴定法中的滴定剂。 乙二胺四乙酸简称EDTA或EDTA酸,用H4Y表示。通常把它的溶解度较大的二钠盐也称EDTA, 实际使用中常用 H2Y2-表示。EDTA 与金属离子等摩尔发生反应,生成具有多个五元环的稳定的螯合 物。 铬黑 T 是偶氮类染料,能与金属离子生成稳定的有色配位化合物。它既是一种配位剂,又是一 种显色剂,因而可以指示滴定终点,当 pH=6.3~11.55 时,铬黑 T 显蓝色。 EDTA 在 pH 为 8.5~11.5 的缓冲溶液中能与 Ca2+、Mg2+形成无色的鳌合物,指示剂铬黑 T 在同 样条件下也能与 Ca2+、Mg2+形成酒红色的配位化合物。在开始滴定前,溶液中 Ca2+、Mg2+离子先 与指示剂配位而显酒红色;当用 EDTA 滴定时,EDTA 首先与溶液中游离的 Ca2+、Mg2+离子进行配 位,生成更稳定的无色螯合物;继续加入 EDTA 滴定剂,当游离的 Ca2+、Mg2+离子全部与 EDTA 配 位后,由于 Ca2+、Mg2+离子与指示剂形成的配位化合物不如与 EDTA 生成的螯合物稳定,原来 Ca2 +、Mg2+离子与铬黑 T 生成的配位化合物会转化成与 EDTA 配位的螯合物,因此络黑 T 又游离了出 来,溶液就由酒红色变成为游离络黑 T 的蓝色,此时即为滴定终点。其反应简式如下: 金属离子 指示剂 配位化合物 鳌合物 2 2 Ca Mg + + + HIn 2- ( Ca Mg In) 1- EDTA PH 8.5 11.5 = − ( Ca Mg EDTA) + HIn 2- 铬黑 T (蓝色) (酒红色) (蓝色) 按下式公式可计算水的总硬度(度): C V EDTA EDTA MCaO 3 10 V 10 水样 总硬度(DH)= (7-1) 测定水的总硬度时,用 NH3·H2O-NH4Cl 缓冲液调节 pH 值。以铬黑 T 为指示剂,用 EDAT 标 准溶液滴定至溶液显蓝色为止。 三、实验仪器与试剂 仪器:250cm3 锥形瓶,50 cm3、25 cm3 移液管,50 cm3 酸式滴定管,200 cm3 烧杯,100 cm3 量 筒,洗耳球,蝴蝶夹,铁架台,洗瓶 试剂:水样 1,水样 2,水样 3,铬黑 T 指示剂,NH3·H2O-NH4Cl 缓冲溶液 100 cm3,无水乙 醇 90 cm3,0.01 mol·dm-3 钙镁标准溶液,0.01 mol·dm-3 EDTA 溶液 四、实验步骤 1.EDTA 溶液的标定 用 25.00cm3 移液管精确吸取 0.01 mol·dm-3 钙镁标准溶液,放入 250cm3 锥形瓶中,再加入 NH3·H2O-NH4Cl 缓冲溶液 5 cm3 及络黑 T 3 滴,用 EDTA 溶液滴定至溶液由酒红色转变为蓝色,记 录滴定时消耗 EDTA 溶液的体积,平行滴定三次,滴定误差不得超过 0.25cm3。取平均值,按下式计 算 EDTA 溶液的物质的量浓度: 3 3 25.00 0.01 mol dm cm EDTA EDTA c V − ( )= ( ) (7-2)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《环境监测》课程教学资源(授课教案及讲稿,共十九讲).doc
- 《环境监测》课程教学大纲 environmental monitoring.doc
- 《水污染控制工程》课程教学大纲(二).pdf
- 《环境工程原理》课程教学资源(PPT课件)第02章 质量衡算与能量衡算.ppt
- 《环境工程原理》课程教学资源(PPT课件)第01章 绪论(华北理工大学:刘玮).ppt
- 《环境工程原理》课程教学资源(PPT课件)第04章 热量传递.ppt
- 《环境工程原理》课程教学资源(PPT课件)第03章 流体流动.ppt
- 《环境工程原理》课程教学资源(PPT课件)第05章 质量传递.ppt
- 《环境工程原理》课程教学资源(PPT课件)第06章 沉降.ppt
- 《环境工程原理》课程教学资源(PPT课件)第10章 其他分离过程.ppt
- 《环境工程原理》课程教学资源(PPT课件)第09章 吸附.ppt
- 《环境工程原理》课程教学资源(PPT课件)第07章 过滤.ppt
- 《环境工程原理》课程教学资源(PPT课件)第08章 吸收.ppt
- 《环境工程原理》课程作业习题(含解答)第02章 质量衡算与能量衡算.pdf
- 《环境工程原理》课程作业习题(含解答)第01章 绪论.pdf
- 《环境工程原理》课程作业习题(含解答)第03章 流体流动.pdf
- 《环境工程原理》课程作业习题(含解答)第06章 沉降.pdf
- 《环境工程原理》课程作业习题(含解答)第04章 热量传递.pdf
- 《环境工程原理》课程作业习题(含解答)第05章 质量传递.pdf
- 《环境工程原理》课程作业习题(含解答)第07章 过滤.pdf
- 《环境监测》课程实验教学大纲(适用专业:环境工程).doc
- 《环境监测》课程教学资源(试卷习题)课后习题与答案.pdf
- 《环境监测》课程教学资源(知识点)重点难点及考点分析.doc
- 《环境监测》课程教学资源(PPT课件)第18讲 环境监测质量保证(2/3).ppt
- 《环境监测》课程教学资源(PPT课件)第16讲 噪声监测(2/2).ppt
- 《环境监测》课程教学资源(PPT课件)第19讲 环境监测质量保证(3/3).ppt
- 《环境监测》课程教学资源(PPT课件)第17讲 环境监测质量保证(1/3).ppt
- 《环境监测》课程教学资源(PPT课件)第13讲 大气降水监测.ppt
- 《环境监测》课程教学资源(PPT课件)第13讲 工业污染源监测.ppt
- 《环境监测》课程教学资源(PPT课件)第15讲 噪声监测(1/2).ppt
- 《环境监测》课程教学资源(PPT课件)第14讲 固体废物监测.ppt
- 《环境监测》课程教学资源(PPT课件)第10讲 水质-有机物测定(2/2).ppt
- 《环境监测》课程教学资源(PPT课件)第12讲 空气和废气(2/2).ppt
- 《环境监测》课程教学资源(PPT课件)第13讲 颗粒物监测.ppt
- 《环境监测》课程教学资源(PPT课件)第11讲 空气和废气(1/2).ppt
- 《环境监测》课程教学资源(PPT课件)第09讲 水质-有机物测定(1/2).ppt
- 《环境监测》课程教学资源(PPT课件)第08讲 水质-非金属无机物测定(3/3).ppt
- 《环境监测》课程教学资源(PPT课件)第07讲 水质-非金属无机物测定(2/3).ppt
- 《环境监测》课程教学资源(PPT课件)第04讲 原子吸收分光光度法.ppt
- 《环境监测》课程教学资源(PPT课件)第06讲 水质-非金属无机物测定(1/3).ppt
