《医学基础化学》课程PPT教学课件(医用基础化学)第七章 化学反应速率 Rate of a Chemical Reaction

第七章化学反应速率Rateof aChemicalReaction
第七章 化学反应速率 Rate of a Chemical Reaction

内容提要1:化学反应速率的表示方法2.反应机理和元反应①简单反应与复合反应2元反应与反应分子数③质量作用定律与速率方程式3.具有简单级数的反应及其特点①一级反应2二级反应③零级反应
内容提要 1. 化学反应速率的表示方法 2. 反应机理和元反应 ① 简单反应与复合反应 ② 元反应与反应分子数 ③ 质量作用定律与速率方程式 3. 具有简单级数的反应及其特点 ① 一级反应 ② 二级反应 ③ 零级反应

内容提要4.化学反应速率理论简介D碰撞理论与活化能②过渡态理论简介5.温度对化学反应速率的影响①Arrhenius方程式2温度对化学反应速率影响的原因6.催化剂对化学反应速率的影响催化剂及催化作用2催化作用理论③生物催化剂一酶
内容提要 4. 化学反应速率理论简介 ① 碰撞理论与活化能 ② 过渡态理论简介 5. 温度对化学反应速率的影响 ① Arrhenius方程式 ② 温度对化学反应速率影响的原因 6. 催化剂对化学反应速率的影响 ① 催化剂及催化作用 ② 催化作用理论 ③ 生物催化剂-酶

教学基本要求掌握反应速率、元反应、速率控制步骤、有效碰撞、活化分子,活化能、反应分子数、反应级数、催化剂的概念2.熟悉化学反应速率方程式及质量作用定律的含义。掌握一级反应的特征及计算3.熟悉温度对化学反应速率的影响,了解催化作用
教学基本要求 1. 掌握反应速率、元反应、速率控制步骤、有效 碰撞、活化分子、活化能、反应分子数、反应 级数、催化剂的概念。 2. 熟悉化学反应速率方程式及质量作用定律的含 义。掌握一级反应的特征及计算。 3. 熟悉温度对化学反应速率的影响,了解催化作 用

第一节化学反应速率的表示方法一化学反应速率(rateofachemicalreaction)定义:单位体积内反应进度随时间的变化率def 1 d_1 dnB - I dceDV dtV VgdtVB dt单位:mol-L-1.时间-1速率皆为正值,化学计量数V对反应物取负值对产物取正值例:N2+3H22NH3dc(N,)1 dc(H2)1 dc(NH)V=32dtdtdt
第一节 化学反应速率的表示方法 一、化学反应速率(rate of a chemical reaction) ◼ 定义:单位体积内反应进度随时间的变化率。 • 单位:molL -1 时间-1 • 速率皆为正值,化学计量数νB对反应物取负值、 对产物取正值。 • 例: N2 + 3H2 2NH3 dt dc dt dn V t V v B B B B def 1 1 d 1 d = = = t c t c t c v d d (NH ) 2 1 d d (H ) 3 1 d d (N ) 2 2 3 = − = − =
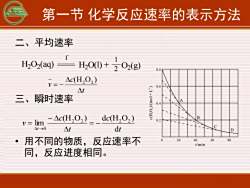
第一节化学反应速率的表示方法二、平均速率1H,O2(aq)H,O() +202(g)0.8Ac(H,0,)V=0.6(T.[0W)/COHAt三、瞬时速率0.Bdc(H,02)Ac(H,O)0.2limV=1CdtAtAt>0D20604080用不同的物质,反应速率不0t/min同,反应进度相同
第一节 化学反应速率的表示方法 二、平均速率 三、瞬时速率 • 用不同的物质,反应速率不 同,反应进度相同。 H2 O2 (aq) H2 O(l) + 1 2 O2 (g) I - t c v = − (H O ) 2 2 t c t c v t d (H O ) d (H O ) lim 2 2 2 2 0 = − − = →

第二节反应机理和元反应简单反应与复合反应简单反应:由一步完成的反应CO(g) + H,O (g)=CO2 (g) +H2 (g)2复合反应:经过多步完成的反应例:H2(g) + I(g) = 2Hl (g)由两步组成I2(g) = 21 (g)H(g) + 2I(g) = 2HI (g)
第二节 反应机理和元反应 一、简单反应与复合反应 1. 简单反应 :由一步完成的反应 CO(g) + H2O (g) = CO2 (g) + H2 (g) 2. 复合反应:经过多步完成的反应 例: H2 (g) + I2 (g) = 2HI (g) 由两步组成 I2 (g) = 2I (g) H2 (g) + 2I(g) = 2HI (g)

第二节反应机理和元反应一、简单反应与复合反应3.反应机理:化学反应进行的实际步骤,即实现化学反应的各步骤的微观过程例:总反应H2(g) + I(g) =2HI (g)快反应I2(g) = 2I (g)慢反应H2(g) + 2I(g) = 2HI (g)慢反应限制了整个复合反应的速率,故称速率控制步骤
第二节 反应机理和元反应 一、简单反应与复合反应 3. 反应机理:化学反应进行的实际步骤,即实现化 学反应的各步骤的微观过程。 例:总反应 H2 (g) + I2 (g) = 2HI (g) I2 (g) = 2I (g) 快反应 H2 (g) + 2I(g) = 2HI (g) 慢反应 • 慢反应限制了整个复合反应的速率,故称速率 控制步骤

第二节反应机理和元反应二、元反应和反应分子数1.元反应(elementaryreaction):一步就能完成的化学反应2.反应分子数(molecularityofreaction):元反应中反应物微粒数之和单分子反应 I (g) =21 (g)双分子反应CO(g) +H,O (g) =CO2 (g) + H2 (g)三分子反应 H2(g)+2I (g)=2HI(g)由于四分子同时相遇的机会极小,更高分子数的反应没有出现
第二节 反应机理和元反应 二、元反应和反应分子数 1. 元反应(elementary reaction):一步就能完成的 化学反应。 2. 反应分子数(molecularity of reaction):元反应中反 应物微粒数之和。 单分子反应 I2 (g) = 2I (g) 双分子反应 CO(g) + H2O (g) = CO2 (g) + H2 (g) 三分子反应 H2 (g) + 2I (g) = 2HI (g) • 由于四分子同时相遇的机会极小,更高分子数 的反应没有出现

第二节反应机理和元反应三、质量作用定律与速率方程式l:质量作用定律(lawofmassaction)温度一定时,元反应的反应速率与各反应物浓度以计量系数为指数的幂的乘积成正比aA+bB-→dD+eEv=kca(A)cb(B)例如NO2(g)+CO(g) 二 NO(g)+CO2(g)V= k c(NO,) c(CO)
第二节 反应机理和元反应 三、质量作用定律与速率方程式 1. 质量作用定律(law of mass action) • 温度一定时,元反应的反应速率与各反应物浓度 以计量系数为指数的幂的乘积成正比: aA+bB→dD+eE v = k c a (A) c b (B) 例如 v = k c(NO2 ) c(CO) NO2 (g)+CO(g) NO(g)+CO2 (g)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《医学基础化学》课程PPT教学课件(医用基础化学)第一章 绪论 Introduction.pptx
- 《医学有机化学》课程教学课件(讲稿)第七章 羧酸及其衍生物.pdf
- 《医学有机化学》课程教学课件(讲稿)第十二章 糖类化合物.pdf
- 《医学有机化学》课程教学课件(讲稿)第十四章 氨基酸、肽和蛋白质.pdf
- 《医学有机化学》课程学习指导(复习要点)有机化合物的性质(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(复习要点)有机化合物的结构(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(复习要点)有机化合物的命名结构(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(知识要点)第02章 链烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第03章 环烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第01章 绪论.pdf
- 《医学有机化学》课程学习指导(知识要点)第06章 醛酮醌.pdf
- 《医学有机化学》课程学习指导(知识要点)第07章 羧酸及其衍生物.pdf
- 《医学有机化学》课程学习指导(知识要点)第05章 醇酚醚.pdf
- 《医学有机化学》课程学习指导(知识要点)第04章 卤代烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第12章 糖类.pdf
- 《医学有机化学》课程学习指导(知识要点)第08章 羟基酸和酮酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第10章 含氮有机化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第09章 立体异构.pdf
- 《医学有机化学》课程学习指导(知识要点)第11章 芳香杂环化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第14章 氨基酸、蛋白质和核酸.pdf
- 《医学基础化学》课程PPT教学课件(医用基础化学)第三章 电解质溶液 Electrolyte Solutions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第九章 原子结构和元素周期律 Atomic Structure and Periodic Properties of Elements.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第二章 稀薄溶液的依数性 Colligative Properties of Diluted Solutions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第五章 胶体 Colloid.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第八章 氧化还原反应和电极电位 Oxidation-Reduction Reactions and Electrode Potential.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第六章 化学反应热及反应的方向和限度 Reaction Heat, Directions and Limit of Chemical Reactions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十一章 配位化合物 Coordination Compounds.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十三章 可见分光光度法和紫外分光光度法 Visible Spectrophotometry and Ultraviolet Spectrophotometry.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十二章 滴定分析 Volumetric Analysis.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十四章 现代仪器分析简介 Modern Instrumental Analysis.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十章 共价键与分子间力 Covalent Bond and Intermolecular Forces.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第四章 缓冲溶液 Buffer Solution.pptx
- 内蒙古科技大学:《材料化学》课程教学大纲 Material Chemistry.pdf
- 内蒙古科技大学:《材料化学》课程授课教案(任课教师:蔡颖).doc
- 《材料化学导论》课程教学大纲 Introduction to Materials Chemistry.pdf
- 《材料化学导论》课程授课教案(讲稿)第22讲 7.4-7.5陶瓷基复合材料、树脂基复合材料.pdf
- 《材料化学导论》课程授课教案(讲稿)第21讲 7.1-7.3 复合材料的定义、分类和特点.pdf
- 《材料化学导论》课程授课教案(讲稿)第23讲 8纳米材料.pdf
- 《材料化学导论》课程授课教案(讲稿)第19讲 6.3高分子材料的特性和应用.pdf
- 《材料化学导论》课程授课教案(讲稿)第18讲 6.1聚合物的结构和特征.pdf
