《医学基础化学》课程PPT教学课件(医用基础化学)第九章 原子结构和元素周期律 Atomic Structure and Periodic Properties of Elements

第九章原子结构和元素周期律Atomic Structure and PeriodicPropertiesofElements
第九章 原子结构和元素周期律 Atomic Structure and Periodic Properties of Elements

内容提要1.核外电子运动状态及特性氢光谱和氢原子的Bohr模型电子的波粒二象性测不准原理2.氢原子的波函数量子数原子轨道的角度分布原子轨道的径向分布
内容提要 1. 核外电子运动状态及特性 ① 氢光谱和氢原子的Bohr模型 ② 电子的波粒二象性 ③ 测不准原理 2. 氢原子的波函数 ① 量子数 ② 原子轨道的角度分布 ③ 原子轨道的径向分布

内容提要3.多电子原子的原子结构多电子原子的能级原子的电子组态4.原子的电子组态与元素周期表原子的电子组态与元素周期表元素性质的周期性变化规律5.元素和人体健康
内容提要 3. 多电子原子的原子结构 ① 多电子原子的能级 ② 原子的电子组态 4. 原子的电子组态与元素周期表 ① 原子的电子组态与元素周期表 ② 元素性质的周期性变化规律 5. 元素和人体健康

教学基本要求1.掌握4个量子数:掌握原子轨道、电子云的角度分布图:了解径向分布函数图的意义和特征。2.熟悉近似能级:掌握Paili不相容原理、能量最低原理、Hund规则和电子组态3.熟悉电子组态与元素周期表的关系:了解原子半径、电负性的变化规律。4.了解Bohr的原子结构理论。了解波粒二象性;熟悉波函数和概率密度。了解元素和健康的关系
教学基本要求 1. 掌握4个量子数;掌握原子轨道、电子云的角度 分布图;了解径向分布函数图的意义和特征。 2. 熟悉近似能级;掌握Paili不相容原理、 能量最 低原理、Hund规则和电子组态。 3. 熟悉电子组态与元素周期表的关系;了解原子 半径、电负性的变化规律。 4. 了解Bohr的原子结构理论。了解波粒二象性; 熟悉波函数和概率密度。了解元素和健康的关 系
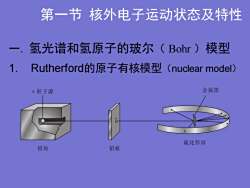
第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型1.FRutherford的原子有核模型(nuclearmodel)金属箔粒子源硫化锌屏铅块铅板
第一节 核外电子运动状态及特性 一. 氢光谱和氢原子的玻尔( Bohr )模型 1. Rutherford的原子有核模型(nuclear model)

第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型2.氢原子的线状光谱(linespectrum)白光散射时,观察到可见光区的连续光谱,但H原子受激发射所得光谱却是不连续的线状光谱,在可见光区有四条谱线WZO400450500550600650700750A/nm
第一节 核外电子运动状态及特性 一. 氢光谱和氢原子的玻尔( Bohr )模型 2. 氢原子的线状光谱(line spectrum) 白光散射时,观察到可见光区 的连续光谱,但H原子受激发 射所得光谱却是不连续的线状 光谱,在可见光区有四条谱线

第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型3.氢光谱的波长规律L=RH元niO式中,入是波长,n为正整数,且n2大于n1。Rμ = 1.096776 ×107 m-1
第一节 核外电子运动状态及特性 一. 氢光谱和氢原子的玻尔( Bohr )模型 3. 氢光谱的波长规律 = − 2 2 2 1 H 1 ~ 1 1 n n R 7 1 H 1.096776 10 m ~ − R = 式中,λ是波长,n为正整数,且n2大于n1

第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型4Bohr的氢原子模型入电子沿固定轨道绕核运动不吸收也不辐射能量,称为定态。轨道能量称为能级。RE:-(eV)-13.62nnn=1时能量最低,为基态其它能量较高的状态都称主量子数n=1,2,3....。为激发态
第一节 核外电子运动状态及特性 4. Bohr 的氢原子模型 ① 电子沿固定轨道绕核运动, 不吸收也不辐射能量,称 为定态。轨道能量称为能 级。 主量子数n=1, 2, 3,.。 n =1时能量最低,为基态, 其它能量较高的状态都称 为激发态。 一. 氢光谱和氢原子的玻尔( Bohr )模型 (eV) 1 13.6 2 2 n n R E = − = −

第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型Bohr的氢原子模型4.2原子由一种定态(能级E1)跃迁到另一种定态(能级E2)。吸收能量辐射能量跃迁所吸收或辐射光子的能量等于跃迁前后能级的能量差:n-4n-3n-2m-E=RHAE=hV=|E2-E11E=-0.25RHE=-0.11R普朗克常量h=6.626×10-34J·S,E=-0.062Rv是光子频率
第一节 核外电子运动状态及特性 4. Bohr 的氢原子模型 ② 原子由一种定态(能级E1)跃迁到 另一种定态(能级E2)。 跃迁所吸收或辐射光子的能量等于 跃迁前后能级的能量差: ΔE = hν = | E2 –E1 | 普朗克常量 h = 6.626×10-34 J·s, ν是光子频率。 一. 氢光谱和氢原子的玻尔( Bohr )模型

第一节核外电子运动状态及特性一.氢光谱和氢原子的玻尔(Bohr)模型4.Bohr的氢原子模型Bohr运用量子化观点,成功地解释了氢原子的稳定性和不连续光谱。但未能冲破经典物理学的束缚,不能解释多电子原子光谱,甚至不能说明氢原子光谱的精细结构。Bohr理论属于旧量子论。电子等微观粒子的运动不遵守经典物理学规律,必须用量子力学方法来描述
第一节 核外电子运动状态及特性 一. 氢光谱和氢原子的玻尔( Bohr )模型 4. Bohr 的氢原子模型 Bohr运用量子化观点,成功地解释了氢原子的 稳定性和不连续光谱。但未能冲破经典物理学 的束缚,不能解释多电子原子光谱,甚至不能 说明氢原子光谱的精细结构。Bohr理论属于旧 量子论。电子等微观粒子的运动不遵守经典物 理学规律,必须用量子力学方法来描述
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《医学基础化学》课程PPT教学课件(医用基础化学)第三章 电解质溶液 Electrolyte Solutions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第七章 化学反应速率 Rate of a Chemical Reaction.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第一章 绪论 Introduction.pptx
- 《医学有机化学》课程教学课件(讲稿)第七章 羧酸及其衍生物.pdf
- 《医学有机化学》课程教学课件(讲稿)第十二章 糖类化合物.pdf
- 《医学有机化学》课程教学课件(讲稿)第十四章 氨基酸、肽和蛋白质.pdf
- 《医学有机化学》课程学习指导(复习要点)有机化合物的性质(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(复习要点)有机化合物的结构(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(复习要点)有机化合物的命名结构(PPT讲稿).ppt
- 《医学有机化学》课程学习指导(知识要点)第02章 链烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第03章 环烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第01章 绪论.pdf
- 《医学有机化学》课程学习指导(知识要点)第06章 醛酮醌.pdf
- 《医学有机化学》课程学习指导(知识要点)第07章 羧酸及其衍生物.pdf
- 《医学有机化学》课程学习指导(知识要点)第05章 醇酚醚.pdf
- 《医学有机化学》课程学习指导(知识要点)第04章 卤代烃.pdf
- 《医学有机化学》课程学习指导(知识要点)第12章 糖类.pdf
- 《医学有机化学》课程学习指导(知识要点)第08章 羟基酸和酮酸.pdf
- 《医学有机化学》课程学习指导(知识要点)第10章 含氮有机化合物.pdf
- 《医学有机化学》课程学习指导(知识要点)第09章 立体异构.pdf
- 《医学基础化学》课程PPT教学课件(医用基础化学)第二章 稀薄溶液的依数性 Colligative Properties of Diluted Solutions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第五章 胶体 Colloid.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第八章 氧化还原反应和电极电位 Oxidation-Reduction Reactions and Electrode Potential.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第六章 化学反应热及反应的方向和限度 Reaction Heat, Directions and Limit of Chemical Reactions.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十一章 配位化合物 Coordination Compounds.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十三章 可见分光光度法和紫外分光光度法 Visible Spectrophotometry and Ultraviolet Spectrophotometry.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十二章 滴定分析 Volumetric Analysis.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十四章 现代仪器分析简介 Modern Instrumental Analysis.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第十章 共价键与分子间力 Covalent Bond and Intermolecular Forces.pptx
- 《医学基础化学》课程PPT教学课件(医用基础化学)第四章 缓冲溶液 Buffer Solution.pptx
- 内蒙古科技大学:《材料化学》课程教学大纲 Material Chemistry.pdf
- 内蒙古科技大学:《材料化学》课程授课教案(任课教师:蔡颖).doc
- 《材料化学导论》课程教学大纲 Introduction to Materials Chemistry.pdf
- 《材料化学导论》课程授课教案(讲稿)第22讲 7.4-7.5陶瓷基复合材料、树脂基复合材料.pdf
- 《材料化学导论》课程授课教案(讲稿)第21讲 7.1-7.3 复合材料的定义、分类和特点.pdf
- 《材料化学导论》课程授课教案(讲稿)第23讲 8纳米材料.pdf
- 《材料化学导论》课程授课教案(讲稿)第19讲 6.3高分子材料的特性和应用.pdf
- 《材料化学导论》课程授课教案(讲稿)第18讲 6.1聚合物的结构和特征.pdf
- 《材料化学导论》课程授课教案(讲稿)第20讲 6.4功能高分子材料.pdf
- 《材料化学导论》课程授课教案(讲稿)第17讲 5.2半导体材料.pdf
