西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第三章 蛋白质化学 第三节 蛋白质结构与功能的关系

西北农林科技大学 emistnre 生物, 动物科技学院生物化学课程组 第三节蛋白质猪构 与功能的关素 返回到章
生物 化学 动物科技学院生物化学课程组 西北农林科技大学 第三节 蛋白质结构 与功能的关系 返回到章

生物 5865 化学 第三节 110 26 天然状态,有 老的吴索 催化活性 95 返回到章 40 尿索,B-巯基乙醇 SH 65 HS 1 一级结构 1 HS 58 40 非折叠状态, 核酸酶复性 SH SH 无活性,SS HS 26 84 被还原成半胱 蛋白原激活 氮酸残基 o 分子病 分子进化 去除尿素及B一巯基乙醇 2高级结构 6 84 26 天然状态,-SS 110 恢复面且正确配对 95 40
生物 化学 第三节 蛋白质结构与功能的关系 牛胰核糖核酸酶变性与复性 牛胰核糖核酸酶,是胰脏中降解RNA的 一种核酸酶,由124个氨基酸残基组成, 有四对二硫健。 20世纪60年代,Anfinsen通过其变性复 性实验,证明了氨基酸顺序是蛋白质特 定的三级结构核生物功能的基础。 一级结构 高级结构 核酸酶复性 蛋白原激活 分子病 分子进化 (1) (2) (3) 1 (4) 返回到章

芝物 化学 第三节蛋白质结构与功能的关素 胰岛素原的激活 级绘 核酸 A链 6lv-1le-Yal-Glu-6la-Cys-Cys-Thy-Ser-lle-ys-Ser-Leu-Tyr-6ln-Leu-Glu-Asi-Ty:-Cxs-Asi 蛋白 123456189101121314151671819 21 分为 分子 2 高级强B链 Phe-Val-Asa-6In-HIs-Lea-C1-C1y-5er-His-Leu-Val-Glu-Ala-Leu-T)r-Leu-tal-Cys-Gly-Glu-to-Gly-Pie-Pe-lyr-ly:-P:o-Lys-lht 23466789011123415161718192021222321252%2:29290 为胰岛素原的激活
生物 化学 第三节 蛋白质结构与功能的关系 胰岛素原的激活 胰岛素(Insulin)由51个氨基酸残基 组成,分为A、B两条链。A链21个氨基 酸残基,B链30个氨基酸残基。A、B两 条链之间通过两个二硫键联结在一起, A链另有一个链内二硫键。 在胰岛β细胞分泌颗粒中,胰岛素原经 蛋白酶裂解,形成等摩尔由AB链组成的 胰岛素和C肽,然后分泌并进入血液,称 为胰岛素原的激活。 一级结构 高级结构 核酸酶复性 蛋白原激活 分子病 分子进化 (1) (2) (3) 1 (4)

生 化学 第三节蛋白质结构写功能的关素 级结构 血红蛋白分子病 核酸酶复性 在镰刀状红细胞贫血患者中,由于基 蛋白原激活 因突变导致血红蛋白β-链第六位氨基酸 分子病 残基由谷氨酸改变为缬氨酸,血红蛋白 分子进化 的亲水性明显下降,从而发生聚集,使 2 高级结构 红细胞变为镰刀状
生物 化学 第三节 蛋白质结构与功能的关系 血红蛋白分子病 在镰刀状红细胞贫血患者中,由于基 因突变导致血红蛋白β-链第六位氨基酸 残基由谷氨酸改变为缬氨酸,血红蛋白 的亲水性明显下降,从而发生聚集,使 红细胞变为镰刀状。 一级结构 高级结构 核酸酶复性 蛋白原激活 分子病 分子进化 (1) (2) (3) 1 (4)

物 化号 第三节蛋白质结构与功能的关素 级结构 细一 在 核酸酶复性 型 蛋白原激活 分子病 两酒 分子进化 2 高级结构 有惟动小 的比蚕勺 43
生物 化学 第三节 蛋白质结构与功能的关系 细胞色素c的一级结构与进化 细胞色素C是动植物细胞的线粒体中普遍存在 的一种呼吸色素,在呼吸作用中起着电子转移 作用。它是一种含亚铁--的球蛋白,由含有 100多个氨基酸残基的一条多肽链组成。细胞 色素C的测定表明:人与黑猩猩的细胞色素C的 氨基酸序列完全相同,差异数为0;人与马相比, 差异数为12;与龟相比,差异数为15;与天蚕 蛾相比,差异数为31;与小麦相比,差异数为 43;与红色螺菌相比,差异数为65。 一级结构 高级结构 核酸酶复性 蛋白原激活 分子病 分子进化 (1) (2) (3) 1 (4)

生物 化学 第三节蛋白质传构与功能的关素 级结构 核糖核酸酶变性与复性 2 高级结构 变性复性试验说明蛋白质的一级结 核酸酶复性 构决定蛋白质高级结构,从而决定其 肌红蛋白 功能。 血红蛋白 蛋白质功能是高级结构完整性的体 构象病 现
生物 化学 第三节 蛋白质结构与功能的关系 核糖核酸酶变性与复性 变性复性试验说明蛋白质的一级结 构决定蛋白质高级结构,从而决定其 功能。 蛋白质功能是高级结构完整性的体 现。 一级结构 高级结构 核酸酶复性 肌红蛋白 血红蛋白 构象病 (1) (2) (3) 1 (4)

芝物 化学 第三节蛋白质结构与功能的关素 E7 Hg93】 02(His 64) 级结构 Heme 2 高级结构 核酸酶复性 G helix 肌红蛋白 血红蛋白 F8 构象病 (His93)、 (H64 Heme H helix -E helix
生物 化学 第三节 蛋白质结构与功能的关系 肌红蛋白(myoglobin) 肌红蛋白是第一个被确定的具有三级 结构的蛋白质,主要生物学功能是结合 氧,是哺乳动物肌肉中储氧的蛋白质。 肌红蛋白由一条多肽链组成,呈扁平的 棱形,含有一个血红素辅基,有8段-螺 旋,血红素居于分子内部的空穴中,其 上的丙酸与蛋白质的碱性氨基酸形成盐 键,Fe与F8上的组氨酸形成配位键。 一级结构 高级结构 核酸酶复性 肌红蛋白 血红蛋白 构象病 (1) (2) (3) 1 (4)

生物 化学 第三节蛋白质结构写功能的关素 级结构 2 高级结构 血红蛋白的功能 酸酶复 血红蛋白是脊椎动物红细胞主要组 肌红蛋白 成部分,它的主要功能是运输氧和二 血红蛋白 氧化碳,维持血液pH值的稳定等作用。 1 功能 结构 别构 构象病
生物 化学 第三节 蛋白质结构与功能的关系 血红蛋白的功能 血红蛋白是脊椎动物红细胞主要组 成部分,它的主要功能是运输氧和二 氧化碳,维持血液pH值的稳定等作用。 一级结构 高级结构 核酸酶复性 肌红蛋白 血红蛋白 构象病 功能 结构 别构 (1) (2) (3) 1 (4) ① ② ③
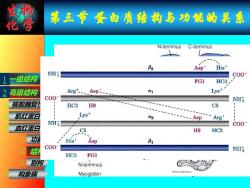
物 化学 第三节蛋白质结构与功能的关素 N-terminus C-terminus B2 Asp His NH C00 级结构 FG1 HC3 高级结构 Argt Asp- Q1 Lys+ C00 NHS 核酸酶美 HC3 H9 C5 肌红蛋 Lys+ 02 AspArg' NH3 C00 血红蛋右 C5 H9 HC3 功 His' Asp 81 C00 ② NII HC3 FG1 别构 N-terminus 3 构象病 Myoglobin Amino terminus
生物 化学 第三节 蛋白质结构与功能的关系 血红蛋白的结构 血红蛋白是由四个亚基构成的四级结构, 呈四面体结构,每个亚基的三级结构与肌 红蛋白极为相似。 成人α2β2;胎儿α2γ2;早期胚胎 α2ε2。 四个亚基之间被8对盐键所稳定。 一级结构 高级结构 核酸酶复性 肌红蛋白 血红蛋白 构象病 功能 结构 别构 (1) (2) (3) 1 (4) ① ② ③

生物 花学 第三节蛋白质结构写功能的关素 Oxvhemoalohin 蛋白质分子与调节分子结合,导致蛋白质分子构象 级结构 改变,而使蛋白质分子功能发生改变的现象称为变 构效应。 高级结构 氧分压、CO2浓度、pH及BPG的影响可以使血红蛋 白的输氧效率达到最高。 肌红蛋白 血红蛋店 构象病
生物 化学 第三节 蛋白质结构与功能的关系 血红蛋白的别构作用 Fe的第六配位键可以与不同的分子结合: 无氧时,与水结合为去氧血红蛋白(Hb);有 氧时,与氧结合为氧合血红蛋白(HbO2 )。一 氧化碳(CO)也能与血红素Fe原子结合,它 与血红蛋白结合的能力是O2的200倍。 血红蛋白与氧的结合是可逆的,解离平衡 受氧分压、CO2浓度和pH等因素影响,氧的 分压和pH较高,CO2浓度较低时,有利于血 红蛋白与氧的结合,反之,则有利于解离。 BPG(2,3-二磷酸甘油酸)则抑制氧的结合。 一级结构 高级结构 核酸酶复性 肌红蛋白 血红蛋白 构象病 功能 结构 别构 血红蛋白与氧的解离曲线为“S”形 F8 93 E7 64 蛋白质分子与调节分子结合,导致蛋白质分子构象 改变,而使蛋白质分子功能发生改变的现象称为变 构效应。 氧分压、CO2浓度、pH及BPG的影响可以使血红蛋 (1) 白的输氧效率达到最高。 (2) (3) 1 (4) ① ② ③
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第三章 蛋白质化学 第二节 蛋白质的分子结构 PROTEN STRUCTURE.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第三章 蛋白质化学 第一节 蛋白质的分子组成.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第三章 蛋白质化学概述 Chemistry of Protein.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第二章 生命的化学特征.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第一章 生物化学绪论概述 Introduction(主讲老师:王建刚).ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(试卷习题)第九章 物质代谢的联系与调节、第十章 DNA的生物合成——复制、第十一章 RNA的生物合成——转录.pdf
- 西北农林科技大学:《动物生物化学》课程教学资源(试卷习题)第六章 糖代谢、第七章 脂类代谢、第八章 生物氧化、第九章 氨基酸代谢、第十章 核苷酸代谢.pdf
- 西北农林科技大学:《动物生物化学》课程教学资源(试卷习题,含答案)第一章 绪论、第二章 生命的化学特征、第三章 蛋白质、第四章 核酸化学、第五章 酶.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(授课教案)第十章 激素与细胞信号转导(Cell Communication and Signal Transduction).pdf
- 西北农林科技大学:《动物生物化学》课程教学大纲 Animal Biochemistry(负责人:张智英).pdf
- 《生物大分子波谱学原理》课程教学资源(文献资料)Studying “Invisible” Excited Protein States in Slow Exchange with a Major State Conformation.pdf
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7h New Protein NMR Technique.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7g 3D NOESY 7.2 异核编辑谱.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7f Side Chain Assignment.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7e HNCACB and HN(CO)CACB.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7d HNCA and HN(CO)CA 7.4 三共振谱.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7c HNCO and HN(CA)CO 7.3 主链三共振序列指认 7.4 三共振谱.ppt
- 《生物大分子波谱学原理》课程教学资源(参考资料)Chapter 7b Supplement - HSQC titration.pdf
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7b Sensitivity Enhanced HSQC and Trosy HSQC.ppt
- 中国科学技术大学:《生物大分子波谱学原理》课程PPT教学课件(讲稿)Chapter 7a HSQC and HMQC 7.1 异核相关谱.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第三章 蛋白质化学 第四节 蛋白质的理化性质与分离纯化.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学概述 Chemistry of Enzyme.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第一节 酶分子的结构与功能.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第二节 酶促反应的特点与机制.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第三节 酶促反应动力学.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第四节 酶的调节.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第五节 酶的分类与命名.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第六节 酶的分离纯化及其活性测定.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第四章 酶化学 第七节 酶的应用.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第五章 维生素 Vitamin.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢 第一节 概述.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢 第二节 糖的无氧分解.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢 第三节 糖的有氧氧化.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢 第四节 糖的其他代谢途径.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢 第五节 血糖及其调节.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第七章 生物氧化 第一节 新陈代谢概论.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第七章 生物氧化 第二节 生物氧化.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第七章 生物氧化 第三节 ATP与高能化合物.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第七章 生物氧化 第四节 呼吸链与电子传递.ppt
- 西北农林科技大学:《动物生物化学》课程教学资源(PPT课件)第七章 生物氧化 第五节 氧化磷酸化.ppt
