中国矿业大学出版社:《矿物学》课程规划教材PDF电子书(第二部分,共十三章)

第二篇矿物学通论.1
·1· 第二篇 矿物学通论
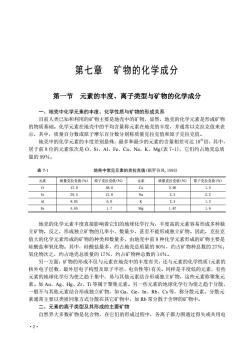
第七章矿物的化学成分第一节元素的丰度、离子类型与矿物的化学成分一、地壳中化学元素的丰度、化学性质与矿物的形成关系目前人类已知和利用的矿物主要是地壳中的矿物,显然,地壳的化学元素是形成矿物的物质基础。化学元素在地壳中的平均含量称元素在地壳的丰度,并通常以克拉克值来表示,其中,质量百分数或原子摩尔百分数分别称质量克拉克值和原子克拉克值。地壳中的化学元素的丰度差别悬殊,最多和最少的元素的含量相差可达108倍,其中居于前8位的元素依次是O、Si、Al、Fe、Ca、Na、K、Mg(表7-1),它们约占地壳总质量的99%。表 7-1地壳中常见元素的克拉克值(据罗谷风,1993)元素元素质量克拉克值(%)原子克拉克值(%)质量克拉克值(%)原子克拉克值(%)047.058.0Ca2.961.5Si29.521.0Na2.52.2AI8.056. 0K2. 51. 31.6Fe4. 651.7Mg1. 87地壳的化学元素丰度直接影响着它们的地球化学行为,丰度高的元素容易形成多种独立矿物,反之,形成独立矿物的几率小、数量少,甚至不能形成独立矿物。因此,克拉克值大的化学元素形成的矿物的种类和数量多,由地壳中前8种化学元素形成的矿物主要是硅酸盐和氧化物。其中,硅酸盐最多,约占地壳总质量的80%,约占矿物种总数的27%;氧化物次之,约占地壳总质量的17%,约占矿物种总数的14%。另一方面,矿物的形成不仅与元素在地壳中的丰度有关,还与元素的化学性质(元素的核外电子层数、最外层电子构型及原子半径、电负性等)有关。同样是丰度低的元素,有些元素的地球化学行为使之趋于集中,易与其他元素结合形成独立矿物,这些元素称聚集元素。如Au、Ag、Hg、Zr、Ti等属于聚集元素。另一些元素的地球化学行为使之趋于分散,一般不与其他元素结合形成独立矿物,如Ga、Ge、In、Rb、Cs等,称分散元素。分散元素通常主要以类质同象方式分散在其它矿物中,如Rb常分散于含钾的矿物中。二、元素的离子类型及其形成的主要矿物自然界大多数矿物是化合物,在它们的形成过程中,各离子都力图通过得失或共用电.2
·2· 第七章 矿物的化学成分 第一节 元素的丰度、离子类型与矿物的化学成分 一、地壳中化学元素的丰度、化学性质与矿物的形成关系 目前人类已知和利用的矿物主要是地壳中的矿物,显然,地壳的化学元素是形成矿物 的物质基础。化学元素在地壳中的平均含量称元素在地壳的丰度,并通常以克拉克值来表 示,其中,质量百分数或原子摩尔百分数分别称质量克拉克值和原子克拉克值。 地壳中的化学元素的丰度差别悬殊,最多和最少的元素的含量相差可达 1018倍,其中, 居于前 8 位的元素依次是 O、Si、Al、Fe、Ca、Na、K、Mg(表 7-1),它们约占地壳总质 量的 99%。 表 7-1 地壳中常见元素的克拉克值(据罗谷风,1993) 元素 质量克拉克值(%) 原子克拉克值(%) 元素 质量克拉克值(%) 原子克拉克值(%) O 47.0 58.0 Ca 2.96 1.5 Si 29.5 21.0 Na 2.5 2.2 Al 8.05 6.0 K 2.5 1.3 Fe 4.65 1.7 Mg 1.87 1.6 地壳的化学元素丰度直接影响着它们的地球化学行为,丰度高的元素容易形成多种独 立矿物,反之,形成独立矿物的几率小、数量少,甚至不能形成独立矿物。因此,克拉克 值大的化学元素形成的矿物的种类和数量多,由地壳中前 8 种化学元素形成的矿物主要是 硅酸盐和氧化物。其中,硅酸盐最多,约占地壳总质量的 80%,约占矿物种总数的 27%; 氧化物次之,约占地壳总质量的 17%,约占矿物种总数的 14%。 另一方面,矿物的形成不仅与元素在地壳中的丰度有关,还与元素的化学性质(元素的 核外电子层数、最外层电子构型及原子半径、电负性等)有关。同样是丰度低的元素,有些 元素的地球化学行为使之趋于集中,易与其他元素结合形成独立矿物,这些元素称聚集元 素。如 Au、Ag、Hg、Zr、Ti 等属于聚集元素。另一些元素的地球化学行为使之趋于分散, 一般不与其他元素结合形成独立矿物,如 Ga、Ge、In、Rb、Cs 等,称分散元素。分散元 素通常主要以类质同象方式分散在其它矿物中,如 Rb 常分散于含钾的矿物中。 二、元素的离子类型及其形成的主要矿物 自然界大多数矿物是化合物,在它们的形成过程中,各离子都力图通过得失或共用电

子使最外电子层达到稳定构型,即形成具有2、8、18个电子的电子层。晶体结构主要由其组成的原子或离子的性质所决定,其中起主导作用的因素就是原子或离子的最外层电子的构型。组成矿物的阴离子主要是O°-、s,其次是F-、CI,其它阴离子较少见,而阳离子则为数众多。根据最外层电子的构型,将阳离子分为情性气体型、铜型和过渡型3类,形成这3类离子的元素在周期表上的分布如表7-2。表 7-2离子类型分布表LiBeBCN0F1AIsiPcINaMgsKCaGaGeAsSeBrScAVCr.MnFeCoNiCuZn.RbSrYZrNbRuRhPdMoTecdInSnSbTe1AgPt CsBaLa*HfTaWReOsIAuTIPbBiPoAtHgI IIRaAc*FrLa*一铜系元素:Ac*一钢系元素。一情性气体型离子区:II一钢型离子区:Ⅲ一过渡型离子区。1.情性气体型离子及其形成的主要矿物情性气体型离子是指具有与情性气体原子相同的电子构型,即最外层具有2个电子(1s或8个电子(nsnp)的离子,主要包括IA、IⅡIA和IIA~VIA部分元素的离子,其中,碱金属、碱土金属元素的电负性较小,易形成阳离子:而非金属元素的电负性大,易形成阴离子。它们在自然界主要形成离子键或以离子键为主的化合物,多为氧化物、含氧盐和卤化物矿物。2.铜型离子及其形成的主要矿物铜型离子是指最外层具有18个电子(nsnp'nd)的离子(如Cu*),以及次外层和最外层共有18+2个电子(nsnpnd(n+1)s)的离子(如Pb2),主要包括IB、IIB及其右侧的一些元素的离子,与电价和半径相似的其他类型的阳离子相比,电负性高,当它们与电负性不太大的阴离子结合时,形成向共价键、金属键过渡的离子键,在自然界主要形成硫化物及其类似化合物。3.过渡型离子及其形成的主要矿物过渡型离子是指最外层电子数为9~17之间(nsnpnd~)的离子,即介于情性气体型离子和铜型离子之间的离子。包括IIB~VIB及VI类大部分元素的离子。视最外层电子数接近8或18,它们分别具有向情性气体型离子或铜型离子过渡的性质。位于Mn左侧元素的离子亲氧性强,易形成氧化物和含氧盐;位于Fe右侧元素的离子亲硫性强,易形成硫化物居于中间的Mn和Fe,则与氧、硫都能组成化合物,究竞形成何种化合物主要取决于氧化还原条件。·3
·3· 子使最外电子层达到稳定构型,即形成具有 2、8、18 个电子的电子层。晶体结构主要由其 组成的原子或离子的性质所决定,其中起主导作用的因素就是原子或离子的最外层电子的 构型。 组成矿物的阴离子主要是 O 2-、S 2-,其次是 F -、Cl-,其它阴离子较少见,而阳离子 则为数众多。根据最外层电子的构型,将阳离子分为惰性气体型、铜型和过渡型 3 类,形 成这 3 类离子的元素在周期表上的分布如表 7-2。 表 7-2 离子类型分布表 Li Be B C N O F Na Mg Ⅰ Al Si P S Cl K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Sr Y Zr Nb Mo Te Ru Rh Pd Ag Cd In Sn Sb Te I Cs Ba La* Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Fr Ra Ac* Ⅲ Ⅱ La*—镧系元素;Ac*—锕系元素。Ⅰ—惰性气体型离子区;Ⅱ—铜型离子区;Ⅲ—过渡型离子区。 1. 惰性气体型离子及其形成的主要矿物 惰性气体型离子是指具有与惰性气体原子相同的电子构型,即最外层具有 2 个电子(1s 2 ) 或 8 个电子(ns 2 np 6 )的离子,主要包括ⅠA、ⅡA 和ⅢA~ⅦA 部分元素的离子,其中,碱金 属、碱土金属元素的电负性较小,易形成阳离子;而非金属元素的电负性大,易形成阴离 子。它们在自然界主要形成离子键或以离子键为主的化合物,多为氧化物、含氧盐和卤化 物矿物。 2. 铜型离子及其形成的主要矿物 铜型离子是指最外层具有 18 个电子(ns 2 np 6 nd10)的离子(如 Cu+ ),以及次外层和最外层 共有 18+2 个电子(ns 2 np 6 nd10(n+1)s 2 )的离子(如 Pb 2+ ),主要包括ⅠB、ⅡB 及其右侧的一 些元素的离子,与电价和半径相似的其他类型的阳离子相比,电负性高,当它们与电负性 不太大的阴离子结合时,形成向共价键、金属键过渡的离子键,在自然界主要形成硫化物 及其类似化合物。 3. 过渡型离子及其形成的主要矿物 过渡型离子是指最外层电子数为 9~17 之间(ns 2 np 6 nd1~9 )的离子,即介于惰性气体型离 子和铜型离子之间的离子。包括ⅢB~ⅦB 及Ⅷ类大部分元素的离子。视最外层电子数接近 8 或 18,它们分别具有向惰性气体型离子或铜型离子过渡的性质。位于 Mn 左侧元素的离 子亲氧性强,易形成氧化物和含氧盐;位于 Fe 右侧元素的离子亲硫性强,易形成硫化物; 居于中间的 Mn 和 Fe,则与氧、硫都能组成化合物,究竟形成何种化合物主要取决于氧化 还原条件

第二节胶体矿物及其特征一、胶体和胶体矿物的概念在化学中,将一种或多种物质分散在另一种物质中,所形成的体系称分散系,其中,被分散的物质称分散相或分散质;分散相周围的物质称分散媒或分散剂。胶体是由两相或多相物质组成、分散相颗粒直径为1~100nm的分散系。自然界存在两种胶体,即水胶溶体和水胶凝体,前者是指以水为分散媒,并且分散媒远多于固体分散相的胶体,简称水溶胶或溶胶:后者是指以水为分散媒,固体分散相远多于分散媒的胶体,简称水凝胶或凝胶。水胶溶体可以通过脱水向水胶凝体转化。胶体矿物是天然形成的水胶凝体,严格说胶体矿物并不是真正的矿物,因为它不是单一相而是两相或多相体系:另外,其固态分散相可以为晶质,也可以为非晶质。当分散相为晶质时,可将胶体矿物看做纳米级矿物与不定量的吸附水构成的混合体系,即便如此,由于晶质分散相颗粒细小,而且颗粒间的取向杂乱无规律性,仍呈现非晶质的光学特点。胶体矿物通常被视为含吸附水的准矿物。蛋白石、胶磷矿等是常见的胶体矿物。二、胶体矿物的特征由于胶体矿物上述构成的特殊性,使其具有以下特征:1.吸附性由于分散相颗粒细小而使胶体矿物具有巨大的比表面积和表面能,兼分散相表面电荷不平衡,使其具有很强的吸附异号电荷离子的能力,以降低其表面能。同时,由于分散相的种类不同、周围介质条件不同或介质条件发生变化,胶体矿物对吸附的物质具有选择性和可交换性。2.化学成分具有可变性胶体矿物化学成分的可变性,一是表现在胶体矿物中的分散相与分散媒之间的数量不固定,二是因被吸附离子的可交换性所致。3.不稳定性由于分散相的表面能很高和表面电荷不平衡,胶体矿物的稳定性较差,随着时间的推移和地质环境的改变,尤其是当温度、压力升高,胶体矿物容易通过脱水、各分散相定向合并等方式,向隐晶质乃至显晶质转化,以达到相对稳定。这种转化过程称胶体陈化或老化,胶体矿物经陈化后形成的矿物称变胶体矿物。第三节矿物中水的赋存形式水是许多矿物形成的重要媒介,如NaCI在盐湖中结晶成石盐:同时,水也是许多矿物本身的化学成分,而还会影响或决定矿物的物理性质。如含水矿物一般具有相对密度小、硬度低,且大多为表生成因的特点。矿物中水对矿物物理性质的影响,主要取决于水的赋存形式。根据水在矿物中的赋存形式及其与晶体结构的关系,可将矿物中的水分为三种基本类型:一是与晶体结构无关的吸附水:二是与晶体结构有一定关系的层间水和沸石水;三是参与晶体结构的结晶水和结*4·
·4· 第二节 胶体矿物及其特征 一、胶体和胶体矿物的概念 在化学中,将一种或多种物质分散在另一种物质中,所形成的体系称分散系,其中, 被分散的物质称分散相或分散质;分散相周围的物质称分散媒或分散剂。 胶体是由两相或多相物质组成、分散相颗粒直径为 1~100 nm 的分散系。自然界存在 两种胶体,即水胶溶体和水胶凝体,前者是指以水为分散媒,并且分散媒远多于固体分散 相的胶体,简称水溶胶或溶胶;后者是指以水为分散媒,固体分散相远多于分散媒的胶体, 简称水凝胶或凝胶。水胶溶体可以通过脱水向水胶凝体转化。 胶体矿物是天然形成的水胶凝体,严格说胶体矿物并不是真正的矿物,因为它不是单 一相而是两相或多相体系;另外,其固态分散相可以为晶质,也可以为非晶质。当分散相 为晶质时,可将胶体矿物看做纳米级矿物与不定量的吸附水构成的混合体系,即便如此, 由于晶质分散相颗粒细小,而且颗粒间的取向杂乱无规律性,仍呈现非晶质的光学特点。 胶体矿物通常被视为含吸附水的准矿物。蛋白石、胶磷矿等是常见的胶体矿物。 二、胶体矿物的特征 由于胶体矿物上述构成的特殊性,使其具有以下特征: 1. 吸附性 由于分散相颗粒细小而使胶体矿物具有巨大的比表面积和表面能,兼分散相表面电荷 不平衡,使其具有很强的吸附异号电荷离子的能力,以降低其表面能。同时,由于分散相 的种类不同、周围介质条件不同或介质条件发生变化,胶体矿物对吸附的物质具有选择性 和可交换性。 2. 化学成分具有可变性 胶体矿物化学成分的可变性,一是表现在胶体矿物中的分散相与分散媒之间的数量不 固定,二是因被吸附离子的可交换性所致。 3. 不稳定性 由于分散相的表面能很高和表面电荷不平衡,胶体矿物的稳定性较差,随着时间的推 移和地质环境的改变,尤其是当温度、压力升高,胶体矿物容易通过脱水、各分散相定向 合并等方式,向隐晶质乃至显晶质转化,以达到相对稳定。这种转化过程称胶体陈化或老 化,胶体矿物经陈化后形成的矿物称变胶体矿物。 第三节 矿物中水的赋存形式 水是许多矿物形成的重要媒介,如 NaCl 在盐湖中结晶成石盐;同时,水也是许多矿 物本身的化学成分,而且还会影响或决定矿物的物理性质。如含水矿物一般具有相对密度 小、硬度低,且大多为表生成因的特点。 矿物中水对矿物物理性质的影响,主要取决于水的赋存形式。根据水在矿物中的赋存 形式及其与晶体结构的关系,可将矿物中的水分为三种基本类型:一是与晶体结构无关的 吸附水;二是与晶体结构有一定关系的层间水和沸石水;三是参与晶体结构的结晶水和结

构水。一、吸附水吸附水是以中性水分子HO的形式被机械地吸附于矿物颗粒表面或缝隙中的水。吸附水可呈气态、液态或固态,不参加矿物的晶格,不属于矿物固有的化学成分,因而一般不写入矿物的化学式。吸附水在矿物中的含量不固定,随所处环境的温度、湿度等条件的改变而变化,常压下温度达到100~110℃,吸附水基本上全部逸散。胶体矿物中的胶体水是吸附水的一种特殊形式,在胶体矿物中作为分散媒被吸附于各分散相表面。有些水分子被极化而与分散相之间具有较强的吸附力,因而胶体水的逸散温度较一般的吸附水的逸散温度上限要高,通常为100~250℃。鉴于胶体水是胶体矿物的固有特征,因此,将胶体水列入胶体矿物的化学式中。二、层间水、沸石水1.层间水层间水是以中性水分子HO的形式存在于某些层状硅酸盐矿物结构单元层之间的水。在这些矿物中,各结构单元层具有过剩的负电价,它们借助吸引某些阳离子来相互连接,而这些阳离子又吸附了极性水分子,这种结构单元层之间的水分子,即层间水。不同层状硅酸盐矿物的结构单元层过剩的电价不同,它们之间的阳离子类型和层间水的含量亦不同:此外,相同层状硅酸盐矿物在不同地质环境中其层间水的多少也不同,在温度低或湿度大的条件下层间水较多,相反条件下则层间水含量减少。层间水多少的变化不会导致结构单元层的破坏,但可引起矿物结构单元层间距的增大或缩小,从而引起垂直结构单元层方向的晶胞常数Co及其相关物理性质的变化。例如,蒙脱石在常温下可吸取超过自身体积数倍的层间水,表现出明显的吸水膨胀性;蛭石被加热时,由于其层间水汽化表现出显著的热膨胀性。层间水逸出的温度较低,一般加热几十摄氏度便开始逸出,至110℃左右即大量失去。2.沸石水沸石水是以存在于沸石族矿物架状晶格中宽大孔道内的中性水分子H2O。因沸石晶格内可容纳水分子的空腔不一定全部被充满,故沸石水的含量不固定。但由于沸石晶格可容纳水分子的空腔是一定的,所以沸石水的含量有一个确定的上限值,且上限值与其他组分的关系符合定比定律。沸石水的含量随温度、湿度而变化,其含量的多少不会引起晶格的破环,只会引起矿物的相对密度、透明度、折射率等某些物理性质发生变化。沸石水一般在温度增高至80~110℃时大部分逸出,但有些沸石水与所在孔道壁离子的静电引力较强,脱水的温度可达400℃。三、结晶水、结构水1.结晶水结晶水是以HO形式占据矿物晶体结构中的固定配位位置,且数量固定、与其他组分含量符合定比定律的水。结晶水往往出现在具有大半径络阴离子的含氧盐矿物中。因为在大半径阴离子团的紧密堆积中,具有较大空隙,为适应这一“宽松环境”,在结晶过程中,一些小半径的阳离子.5
·5· 构水。 一、吸附水 吸附水是以中性水分子 H2O 的形式被机械地吸附于矿物颗粒表面或缝隙中的水。吸附 水可呈气态、液态或固态,不参加矿物的晶格,不属于矿物固有的化学成分,因而一般不 写入矿物的化学式。吸附水在矿物中的含量不固定,随所处环境的温度、湿度等条件的改 变而变化,常压下温度达到 100~110 ℃,吸附水基本上全部逸散。 胶体矿物中的胶体水是吸附水的一种特殊形式,在胶体矿物中作为分散媒被吸附于各 分散相表面。有些水分子被极化而与分散相之间具有较强的吸附力,因而胶体水的逸散温 度较一般的吸附水的逸散温度上限要高,通常为 100~250 ℃。鉴于胶体水是胶体矿物的 固有特征,因此,将胶体水列入胶体矿物的化学式中。 二、层间水、沸石水 1. 层间水 层间水是以中性水分子 H2O 的形式存在于某些层状硅酸盐矿物结构单元层之间的水。 在这些矿物中,各结构单元层具有过剩的负电价,它们借助吸引某些阳离子来相互连接, 而这些阳离子又吸附了极性水分子,这种结构单元层之间的水分子,即层间水。 不同层状硅酸盐矿物的结构单元层过剩的电价不同,它们之间的阳离子类型和层间水 的含量亦不同;此外,相同层状硅酸盐矿物在不同地质环境中其层间水的多少也不同,在 温度低或湿度大的条件下层间水较多,相反条件下则层间水含量减少。层间水多少的变化 不会导致结构单元层的破坏,但可引起矿物结构单元层间距的增大或缩小,从而引起垂直 结构单元层方向的晶胞常数 c0及其相关物理性质的变化。例如,蒙脱石在常温下可吸取超 过自身体积数倍的层间水,表现出明显的吸水膨胀性;蛭石被加热时,由于其层间水汽化 表现出显著的热膨胀性。 层间水逸出的温度较低,一般加热几十摄氏度便开始逸出,至 110 ℃左右即大量失去。 2. 沸石水 沸石水是以存在于沸石族矿物架状晶格中宽大孔道内的中性水分子 H2O。因沸石晶格 内可容纳水分子的空腔不一定全部被充满,故沸石水的含量不固定。但由于沸石晶格可容 纳水分子的空腔是一定的,所以沸石水的含量有一个确定的上限值,且上限值与其他组分 的关系符合定比定律。 沸石水的含量随温度、湿度而变化,其含量的多少不会引起晶格的破坏,只会引起矿 物的相对密度、透明度、折射率等某些物理性质发生变化。沸石水一般在温度增高至 80~ 110 ℃时大部分逸出,但有些沸石水与所在孔道壁离子的静电引力较强,脱水的温度可达 400 ℃。 三、结晶水、结构水 1. 结晶水 结晶水是以 H2O 形式占据矿物晶体结构中的固定配位位置,且数量固定、与其他组分 含量符合定比定律的水。 结晶水往往出现在具有大半径络阴离子的含氧盐矿物中。因为在大半径阴离子团的紧 密堆积中,具有较大空隙,为适应这一“宽松环境”,在结晶过程中,一些小半径的阳离子

在不改变自身电价的情况下,与H2O形成水化阳离子,再与大半径阴离子团构成稳定矿物。结晶水失去后,矿物的晶格将会破坏而转变为另一种矿物。如单斜晶系的石膏CaSO·2H2O逸出全部结晶水后将转变为斜方晶系的硬石膏CaSO。不同矿物中的结晶水与晶格联系的牢固程度不同,因此,其逸出温度也不同,一般逸出温度介于200~600℃,但有些矿物结晶水逸出的温度可低于100℃。2.结构水结构水也称化合水,是以(OH)-、H+或(HsO)+等离子形式存在于矿物中,在晶体结构中占有确定的配位位置,与矿物其他组分含量呈固定比例关系的“水”。其中,以(OH)最为常见。结构水是矿物中最牢固的“水”,它的脱水温度较其它类型水的脱水温度要高得多,一般在600~1000℃。结构水主要存在于氢氧化物和层状结构硅酸盐矿物中,如水镁石Mg(OH)2、高岭石Al[SiO1o](OH)等。需要指出,在矿物的化学成分分析数据中,有时会出现H2O+和H2O-。H2O+称正水,通常是指结晶水,即在>110℃条件下从矿物中逃逸的水;H20-称负水,通常是指未参加晶格的吸附水,即在样品加热到110℃前即行逃逸的水。对于那些与晶格有关的层间水、沸石水及少部分结晶水,因为它们也是在110C前逸出晶格,在分析这些矿物样品时,需要用特殊方法处理样品中的水。第四节矿物的化学式一、矿物化学成分的相对确定性在矿物的化学成分中,各组分之间通常呈一定的比例关系,即遵守定比定律(或倍比定律)。矿物化学成分间遵守定比定律的性质称矿物的化学计量性。需要指出,由于类质同象替代及替代量的可变性,导致矿物的化学成分并不是固定的但若将呈类质同象替代关系的元素作为一个整体看待,则许多矿物仍遵守定比定律。例如,在闪锌矿(ZnFe)S中,不论Zn和Fe的相对量如何,二者之和与S之间仍满足定比定律。化学成分之间遵守定比定律的矿物称化学计量矿物。化学组分不符合定比定律的矿物称非化学计量矿物。其主要原因是矿物晶体内部存在某种晶格缺陷或结构上的不均匀性。例如,方铁矿的理想化学式为FeO,但在其形成过程中,由于氧化还原条件方面的原因,一些Fe3+替代了Fe,为了保持电中性,便相应地减少了晶格中的Fe原子数,造成某些Fe原子的位置出现空位。结果使方铁矿的实际化学成分为Fei~O;磁黄铁矿Fei~S也是典型的非化学计量矿物。自然界的非化学计量矿物远少于化学计量矿物。二、矿物化学式(一)矿物化学式的概念如前所述,矿物的化学成分在一定范围内是可变的,但从相对的观点而言,每一种矿物的化学成分又是一定的。矿物的化学式就是矿物化学成分的表达式。确切地说,矿物的化学式是按一定原则来反映矿物化学组成的元素种类及其数量比,有时还反映矿物晶体结·6·
·6· 在不改变自身电价的情况下,与 H2O 形成水化阳离子,再与大半径阴离子团构成稳定矿物。 结晶水失去后,矿物的晶格将会破坏而转变为另一种矿物。如单斜晶系的石膏 CaSO4·2H2O 逸出全部结晶水后将转变为斜方晶系的硬石膏 CaSO4。不同矿物中的结晶水 与晶格联系的牢固程度不同,因此,其逸出温度也不同,一般逸出温度介于 200~600 ℃, 但有些矿物结晶水逸出的温度可低于 100 ℃。 2. 结构水 结构水也称化合水,是以(OH) -、H +或(H3O) +等离子形式存在于矿物中,在晶体结构 中占有确定的配位位置,与矿物其他组分含量呈固定比例关系的“水”。其中,以(OH) - 最为常见。 结构水是矿物中最牢固的“水”,它的脱水温度较其它类型水的脱水温度要高得多,一 般在 600~1 000 ℃。结构水主要存在于氢氧化物和层状结构硅酸盐矿物中,如水镁石 Mg(OH)2、高岭石 Al4[Si4O10](OH)8等。 需要指出,在矿物的化学成分分析数据中,有时会出现 H2O +和 H2O -。H2O +称正水, 通常是指结晶水,即在>110 ℃条件下从矿物中逃逸的水;H2O -称负水,通常是指未参加 晶格的吸附水,即在样品加热到 110 ℃前即行逃逸的水。对于那些与晶格有关的层间水、 沸石水及少部分结晶水,因为它们也是在 110 ℃前逸出晶格,在分析这些矿物样品时,需 要用特殊方法处理样品中的水。 第四节 矿物的化学式 一、矿物化学成分的相对确定性 在矿物的化学成分中,各组分之间通常呈一定的比例关系,即遵守定比定律(或倍比定 律)。矿物化学成分间遵守定比定律的性质称矿物的化学计量性。 需要指出,由于类质同象替代及替代量的可变性,导致矿物的化学成分并不是固定的, 但若将呈类质同象替代关系的元素作为一个整体看待,则许多矿物仍遵守定比定律。例如, 在闪锌矿(Zn,Fe)S 中,不论 Zn 和 Fe 的相对量如何,二者之和与 S 之间仍满足定比定律。 化学成分之间遵守定比定律的矿物称化学计量矿物。 化学组分不符合定比定律的矿物称非化学计量矿物。其主要原因是矿物晶体内部存在 某种晶格缺陷或结构上的不均匀性。例如,方铁矿的理想化学式为 FeO,但在其形成过程 中,由于氧化还原条件方面的原因,一些 Fe3+替代了 Fe2+,为了保持电中性,便相应地减 少了晶格中的 Fe 原子数,造成某些 Fe 原子的位置出现空位。结果使方铁矿的实际化学成 分为 Fe1~xO;磁黄铁矿 Fe1~xS 也是典型的非化学计量矿物。自然界的非化学计量矿物远少 于化学计量矿物。 二、矿物化学式 (一)矿物化学式的概念 如前所述,矿物的化学成分在一定范围内是可变的,但从相对的观点而言,每一种矿 物的化学成分又是一定的。矿物的化学式就是矿物化学成分的表达式。确切地说,矿物的 化学式是按一定原则来反映矿物化学组成的元素种类及其数量比,有时还反映矿物晶体结

构特点及元素间结合关系的表达式。(二)化学式的种类1.实验式实验式是表示矿物中化学组成元素的种类及其数量比的化学式。例如,石盐、方铅矿、磁铁矿、绿柱石的实验式分别为NaCl、PbS、FeFe2+O4、BesAl2SicO18。对于含氧盐及某些氧化物矿物,其实验式也可写作氧化物的组合形式,如上述的磁铁矿和绿柱石可分别写为FeO·Fe2O3、3BeO·Al2Os·6SiO2。实验式的特点:计算简单,书写方便,便于记忆,但不能反映矿物成分中各组分之间的关系以及晶体结构方面的特点。例如,在绿柱石中,实际上不存在以BeO、AlO和SiO2形式出现的独立组分。2.晶体化学式晶体化学式是指不但能表明矿物中化学组成元素的种类及其数量比,还能反映各种元素在晶体结构中的存在形式及其相互关系的化学式,亦称结构式。如锆石的晶体化学式为Zr[SiO],表明Zr"+和[SiO]在晶体结构中各自作为一种结构单元存在:再如绿柱石的晶体化学式为BeAlz[SiO1s],表明了[SiO18]12-、Al+、Be+分别为晶体结构中的结构单元。在矿物学中,常用的是晶体化学式。(三)晶体化学式的书写原则1.单质单质矿物的晶体结构相对简单,其晶体化学式与实验式一样,即只写出元素符号即可,如自然铜Cu,金刚石C,自然硫S。2.化合物①阳离子在前,阴离子在后,如石盐NaCl。②具有两种或多种阳离子的复盐矿物,阳离子按电价递增顺序自左至右排列,对于电价相同的不同阳离子,则依碱性递减顺序自左至右排列。如:绿柱石BesAl2[SicO1s]、磁铁矿FeFe2O(前面的铁离子为十2价,后面的铁离子为十3价)、白云石CaMg[CO3]2。③络阴离子须用方括号括之,例如上述的绿柱石、白云石。④若有附加阴离子(包括结构水等),一般放在主要阴离子或主要络阴离子之后,如:磷灰石Cas[PO,]sF。③互为类质同象的元素用圆括号括之,并按含量递减顺序前后排列,并以逗号隔开如(Zn,Fe)S。对于完全类质同象系列矿物,还可用两端员组分表示,如斜长石的晶体化学式为Na[AISisOs]一Ca[Al2SizOs],对于该类质同象系列中某一确定化学成分的过渡成员,其晶体化学式可表示为:nNa[AISi:Os](100一n)Ca[Al2SizOs]。③矿物中水的书写方式:除层间水和结构水有不同表示方法外,一般都写在化学式的最后,并用点号与其它部分隔开。胶体水因含水量不固定,故以nH2O表示之,如蛋白石的化学式写为SiO2·nH2O。层间水在化学式中通常有两种表示方法,一是以nHO的形式写在化学式的最后,如蒙脱石的化学式写为:Na(Al2-,Mg)[(Si,AI)Oo](OH)2nH2O;另一种表示方法是将层.7
·7· 构特点及元素间结合关系的表达式。 (二)化学式的种类 1. 实验式 实验式是表示矿物中化学组成元素的种类及其数量比的化学式。例如,石盐、方铅矿、 磁铁矿、绿柱石的实验式分别为 NaCl、PbS、Fe2+ Fe2 3+O4、Be3Al2Si6O18。对于含氧盐及某 些氧化物矿物,其实验式也可写作氧化物的组合形式,如上述的磁铁矿和绿柱石可分别写 为 FeO·Fe2O3、3BeO·Al2O3·6SiO2。 实验式的特点:计算简单,书写方便,便于记忆,但不能反映矿物成分中各组分之间 的关系以及晶体结构方面的特点。例如,在绿柱石中,实际上不存在以 BeO、Al2O3和 SiO2 形式出现的独立组分。 2. 晶体化学式 晶体化学式是指不但能表明矿物中化学组成元素的种类及其数量比,还能反映各种元 素在晶体结构中的存在形式及其相互关系的化学式,亦称结构式。 如锆石的晶体化学式为 Zr[SiO4],表明 Zr4+和[SiO4]在晶体结构中各自作为一种结构 单元存在;再如绿柱石的晶体化学式为 Be3Al2[Si6O18],表明了[Si6O18] 12-、Al3+、Be2+分别 为晶体结构中的结构单元。在矿物学中,常用的是晶体化学式。 (三)晶体化学式的书写原则 1. 单质 单质矿物的晶体结构相对简单,其晶体化学式与实验式一样,即只写出元素符号即可, 如自然铜 Cu,金刚石 C,自然硫 S。 2. 化合物 ① 阳离子在前,阴离子在后,如石盐 NaCl。 ② 具有两种或多种阳离子的复盐矿物,阳离子按电价递增顺序自左至右排列,对于电 价相同的不同阳离子,则依碱性递减顺序自左至右排列。如:绿柱石 Be3Al2[Si6O18]、磁铁 矿 FeFe2O4(前面的铁离子为+2 价,后面的铁离子为+3 价)、白云石 CaMg[CO3]2。 ③ 络阴离子须用方括号括之,例如上述的绿柱石、白云石。 ④ 若有附加阴离子(包括结构水等),一般放在主要阴离子或主要络阴离子之后,如: 磷灰石 Ca5[PO4]3F。 ⑤ 互为类质同象的元素用圆括号括之,并按含量递减顺序前后排列,并以逗号隔开, 如(Zn,Fe)S。 对于完全类质同象系列矿物,还可用两端员组分表示,如斜长石的晶体化学式为 Na[AlSi3O8]—Ca[Al2Si2O8],对于该类质同象系列中某一确定化学成分的过渡成员,其晶 体化学式可表示为:nNa[AlSi3O8](100-n)Ca[Al2Si2O8]。 ⑥ 矿物中水的书写方式:除层间水和结构水有不同表示方法外,一般都写在化学式的 最后,并用点号与其它部分隔开。 胶体水因含水量不固定,故以 nH2O 表示之,如蛋白石的化学式写为 SiO2·nH2O。 层间水在化学式中通常有两种表示方法,一是以 nH2O 的形式写在化学式的最后,如 蒙脱石的化学式写为:Nax(Al2-x,Mgx)[(Si,Al)4O10](OH)2·nH2O;另一种表示方法是将层
间水以(H2O),的形式写在层间阳离子之后,如蒙脱石的化学式还可写为:Nax(H2O)n【(Al2~x,Mg)[(Si,AI),O1oJ(OH)2)。后一种书写方法的优点是可以更清楚地反映矿物化学组成的密切关系和结构层次,其中中括号表示硅氧骨干,大括号表示结构单元层。沸石水在HO前标明其含量的上限值,写在化学式最后,如钠沸石的化学式写为:Naz[AlSisOro]:2H,O。结晶水按其与其他组分的定比关系书写,如石膏的化学式写为:Ca[SO]·2H2O。在结构水中,(OH)按一般附加阴离子位置书写,H或(H:O)等则按一般阳离子的位置书写。(四)矿物化学式的计算通常给出的矿物化学式是每种矿物的理想化学式或矿物化学通式。由于矿物的化学成分是可以在一定范围内变化的,所以,在矿物学研究中,常常需要对具体产地的矿物实际化学式进行计算,以更详尽地表示该矿物的化学成分和详细了解类质同象情况。另外,根据实际矿物的晶体化学式与理想化学式的偏离情况,还有助于获得矿物及其所在岩石或矿床成因方面的信息,进而指导找矿。矿物的实际化学式是根据单矿物的化学分析数据计算得到的。所分析的样品应有一定的纯度,分析数据一般以元素或氧化物的质量百分数WB/%给出,而且分析误差应≤1%。实验式的计算比较简单,晶体化学式的计算则相对麻烦,须有矿物的晶体化学知识及X射线结构分析资料。1.简单化学式的计算①将矿物化学分析数据所得的各元素或氧化物及其质量百分数(WB/%)列表,并检查化学分析精度,要求各组分质量之和在(100土1)%范围内(表7-3、7-4,第1、2列)。②查出各元素的相对原子质量或各氧化物的相对分子质量(表7-3、7-4,第3列)。③以各元素或氧化物的质量百分数除以相对原子质量或各氧化物的相对分子质量,求得各组分的相对原子数或相对分子数(表7-3、7-4,第4列)。④将各组分的相对原子数或相对分子数近似地化简成简单整数比(表7-3、7-4,第5列)。③写出矿物的化学式(表7-3、7-4,第6列)。表 7-3某黄铜矿的化学式计算组分质量分数(WB/%)相对原子量相对原子数原子数简单整数比化学式Cu34.4063. 550. 541 3IFe39. 47155. 850.545 6CuFeS:s35. 051. 093 3232. 06合计99. 922.复杂化学式的计算对于化学成分较为复杂的硅酸盐等矿物,在计算化学式时,很难将各组分相对原子数或相对分子数近似地化简成简单整数比。在这种情况下,通常采用阴离子法或阳离子法进.8
·8· 间水以(H2O)n 的形式写在层间阳离子之后,如蒙脱石的化学式还可写为:Nax(H2O)n {(Al2~x,Mgx)[(Si,Al)4O10](OH)2}。后一种书写方法的优点是可以更清楚地反映矿物化学 组成的密切关系和结构层次,其中中括号表示硅氧骨干,大括号表示结构单元层。 沸石水在 H2O 前标明其含量的上限值,写在化学式最后,如钠沸石的化学式写为: Na2[Al2Si3O10]·2H2O。 结晶水按其与其他组分的定比关系书写,如石膏的化学式写为:Ca[SO4]·2H2O。 在结构水中,(OH) -按一般附加阴离子位置书写,H +或(H3O) +等则按一般阳离子的位 置书写。 (四)矿物化学式的计算 通常给出的矿物化学式是每种矿物的理想化学式或矿物化学通式。由于矿物的化学成 分是可以在一定范围内变化的,所以,在矿物学研究中,常常需要对具体产地的矿物实际 化学式进行计算,以更详尽地表示该矿物的化学成分和详细了解类质同象情况。另外,根 据实际矿物的晶体化学式与理想化学式的偏离情况,还有助于获得矿物及其所在岩石或矿 床成因方面的信息,进而指导找矿。 矿物的实际化学式是根据单矿物的化学分析数据计算得到的。所分析的样品应有一定 的纯度,分析数据一般以元素或氧化物的质量百分数 WB/%给出,而且分析误差应≤1%。 实验式的计算比较简单,晶体化学式的计算则相对麻烦,须有矿物的晶体化学知识及 X 射 线结构分析资料。 1. 简单化学式的计算 ① 将矿物化学分析数据所得的各元素或氧化物及其质量百分数(WB/%)列表,并检查 化学分析精度,要求各组分质量之和在(100±1)%范围内(表 7-3、7-4,第 1、2 列)。 ② 查出各元素的相对原子质量或各氧化物的相对分子质量(表 7-3、7-4,第 3 列)。 ③ 以各元素或氧化物的质量百分数除以相对原子质量或各氧化物的相对分子质量,求 得各组分的相对原子数或相对分子数(表 7-3、7-4,第 4 列)。 ④ 将各组分的相对原子数或相对分子数近似地化简成简单整数比(表 7-3、7-4,第 5 列)。 ⑤ 写出矿物的化学式(表 7-3、7-4,第 6 列)。 表 7-3 某黄铜矿的化学式计算 组分 质量分数(WB/%) 相对原子量 相对原子数 原子数简单整数比 化学式 Cu 34.40 63.55 0.541 3 1 Fe 39.47 55.85 0.545 6 1 CuFeS2 S 35.05 32.06 1.093 3 2 合计 99.92 2. 复杂化学式的计算 对于化学成分较为复杂的硅酸盐等矿物,在计算化学式时,很难将各组分相对原子数 或相对分子数近似地化简成简单整数比。在这种情况下,通常采用阴离子法或阳离子法进
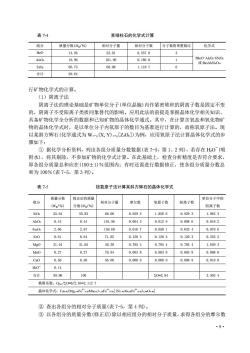
表 7-4某绿柱石的化学式计算组分质量分数(Wz/%)相对分子量相对分子数分子数简单整数比化学式Beo313.9525.010.55783BeO-Al:O6SiO2AlOs18.96101.960.186 01或BesAlSiOrs6SiO.66.7360.081.110 7合计99.64行矿物化学式的计算。(1)阴离子法阴离子法的理论基础是矿物单位分子(单位晶胞)内作紧密堆积的阴离子数是固定不变的,阴离子不受阳离子类质同象替代的影响。应用此法的前提是掌握晶体化学相关知识、具备矿物化学全分析的数据和已知矿物的晶体化学通式。其中,在计算含氧盐和氧化物矿物的晶体化学式时,是以单位分子内氧原子的数目为基准进行计算的,故称氧原子法。现以某斜方辉石(化学通式为W1-(X,Y)1+[Z.O.])为例,应用氧原子法计算晶体化学式的步骤如下:①据化学分析资料,列出各组分质量分数数据(表7-5,第1、2列),若存在HO-(吸附水),将其剔除,不参加矿物的化学式计算。在此基础上,检查分析精度是否符合要求,即各组分质量总和应在(100土1)%范围内:有时还需进行数据修正,使各组分质量分数总和为100%(表7-5,第3列)表 7-5按氧原子法计算某斜方辉石的晶体化学式质量分数修正后的质量单位分子中的组分相对分子量摩尔数氧原子数阳离子数阳离子数(W/%)分数(Wg/%)SiO255.6455. 8360.080.929 31.858 60.92931.963 3AlOs0. 440. 44101. 960. 004 30.012 90. 008 60. 018 22. 662. 67Fe:Os159. 680.01670. 050 10. 033 40.070 6Feo8. 618.6471. 850.120 30.120 30.120 30. 255 231.5431.6540.30Mgo0.78540.785 40. 785 41.659 30.270.2770. 94Mno0.003 80.00380.00380.008 00. 50Cao0.5056. 080.008 90. 008 90.008 90. 018 8Ho-0. 14合计99.80100ZO=2.843.993 4换算系数:Ogm/2O=6/2.84=2.1127晶体化学式:Ca.e(Mgi.Fe*faMna.o)LFe+aas[(Sin.sAla.iFe*a.m)zwOk.m]②查出各组分的相对分子质量(表7-5,第4列)。③以各组分的质量分数(修正后)除以相应组分的相对分子质量,求得各组分的摩尔数.9
·9· 表 7-4 某绿柱石的化学式计算 组分 质量分数(WB/%) 相对分子量 相对分子数 分子数简单整数比 化学式 BeO 13.95 25.01 0.557 8 3 3BeO·Al2O3·6SiO2 或 Be3Al2Si6O18 Al2O3 18.96 101.96 0.186 0 1 SiO2 66.73 60.08 1.110 7 6 合计 99.64 行矿物化学式的计算。 (1)阴离子法 阴离子法的理论基础是矿物单位分子(单位晶胞)内作紧密堆积的阴离子数是固定不变 的,阴离子不受阳离子类质同象替代的影响。应用此法的前提是掌握晶体化学相关知识、 具备矿物化学全分析的数据和已知矿物的晶体化学通式。其中,在计算含氧盐和氧化物矿 物的晶体化学式时,是以单位分子内氧原子的数目为基准进行计算的,故称氧原子法。现 以某斜方辉石(化学通式为 W1-p(X,Y)1+p[Z2O6])为例,应用氧原子法计算晶体化学式的步 骤如下: ① 据化学分析资料,列出各组分质量分数数据(表 7-5,第 1、2 列),若存在 H2O - (吸 附水),将其剔除,不参加矿物的化学式计算。在此基础上,检查分析精度是否符合要求, 即各组分质量总和应在(100±1)%范围内;有时还需进行数据修正,使各组分质量分数总 和为 100%(表 7-5,第 3 列)。 表 7-5 按氧原子法计算某斜方辉石的晶体化学式 组分 质量分数 (WB/%) 修正后的质量 分数(WB/%) 相对分子量 摩尔数 氧原子数 阳离子数 单位分子中的 阳离子数 SiO2 55.64 55.83 60.08 0.929 3 1.858 6 0.929 3 1.963 3 Al2O3 0.44 0.44 101.96 0.004 3 0.012 9 0.008 6 0.018 2 Fe2O3 2.66 2.67 159.68 0.016 7 0.050 1 0.033 4 0.070 6 FeO 8.61 8.64 71.85 0.120 3 0.120 3 0.120 3 0.255 2 MgO 31.54 31.65 40.30 0.785 4 0.785 4 0.785 4 1.659 3 MnO 0.27 0.27 70.94 0.003 8 0.003 8 0.003 8 0.008 0 CaO 0.50 0.50 56.08 0.008 9 0.008 9 0.008 9 0.018 8 H2O - 0.14 合计 99.80 100 ΣO=2.84 3.993 4 换算系数:Of.u./ΣO=6/2.84=2.112 7 晶体化学式:Ca0.02(Mg1.66Fe2+ 0.26Mn0.01)1.93Fe3+ 0.05[(Si1.96Al0.02Fe3+ 0.02)2.00O6.00] ② 查出各组分的相对分子质量(表 7-5,第 4 列)。 ③ 以各组分的质量分数(修正后)除以相应组分的相对分子质量,求得各组分的摩尔数

(即各组分的相对分子数,表7-5,第5列)。④以各组分的摩尔数乘以相应组分中的氧原子系数,如AlO:的氧原子系数为3,得到各组分的氧原子数(表7-5,第6列)。将各组分氧原子数相加,得到各组分氧原子数的总和ZO(表7-5,第6列合计栏)。③由于氧离子极少被其他元素替代,故以矿物通式中的氧原子理论数Of为基准,通过Ofu/ZO,求得换算系数(表7-5,倒数第2行)。以各组分摩尔数乘以相应的组分阳离子系数,如Al2O的阳离子系数为2,得各组分的阳离子数(表7-5,第7列)。③以各组分的阳离子数乘以换算系数(Ofu/ZO),得到单位分子中的相应组分的阳离子数(表7-5,第8列),如SiO2的单位分子中阳离子数为:0.9293×2.1127=1.9633。③根据晶体化学知识(主要是类质同象替代关系)和矿物的化学通式,将各阳离子分配到相应的晶格位置,即本例矿物化学通式Wi-p(X,Y)1+p[Z,O]中W、X、Y、Z的位置。其中,W代表Nat、Ca+;X代表Mg+、Fe2+、Mn2+等:Y代表Fe、Cr+、A+、Ti+等;Z主要是Si+、AI+,偶有Fe3+、Cr+、Ti+等。其中,AI+在Y、Z的位置均较常见,并通常优先考虑将AI+分配在Z的位置上。本例中的全部AI+均占据四面体位置,Si+十AI+的离子数仍小于通式Z离子数,故全部A均应占据四面体位置,其余不足部分由Fe3+补充,即占据四面体位置的Fe+数为:21.96—0.02=0.02。按矿物的化学通式,检验阴、阳离子电价是否平衡。①写出矿物的晶体化学式(表7-5,末行)。晶体化学式中要详细注明变价离子的电价、互相类质同象等元素的详细比例数字(按单位分子中的阳离子数由大到小排序)。此时,呈类质同象替代关系的元素符号间,不再以逗号相隔。(2)阳离子法仍以上述斜方辉石为例,介绍以阳离子法进行矿物化学式计算的步骤:①据化学分析资料,列出各组分质量分数数据(WB/%)(表7-6,第1、2列)。相关要求同阴离子法。并求得修正后各组分质量分数数据(表7-6,第3列)。②查出各组分的相对分子质量(表7-6,第4列)。③以各组分的质量分数(修正后)除以相应组分的相对分子质量,求得各组分的摩尔数(表7-6,第5列)。④以各组分的摩尔数乘以相应组分中的阳离子系数,得到各组分的阳离子数(表7-6,第6列)。③将各组分阳离子数相加,得到各组分阳离子数的总和ZMe(表7-6,第6列),本例ZMe=1.8897。③以矿物单位分子(即矿物化学通式)内阳离子理论数Mefu(本例为4)为基准,通过Mef.u/ZMe,求得换算系数,本例为2.1167(表7-6,倒数第2行)。③以各组分阳离子数乘以换算系数,得到矿物单位分子中各组分的阳离子数(表7-6,第 7 列)。③根据矿物的化学通式(本例为Wi-(X,Y)i+p[Z.O]),将各阳离子分配到相应的晶格位置(同前述氧离子法)。·10
·10· (即各组分的相对分子数,表 7-5,第 5 列)。 ④ 以各组分的摩尔数乘以相应组分中的氧原子系数,如 Al2O3的氧原子系数为 3,得 到各组分的氧原子数(表 7-5,第 6 列)。 ⑤ 将各组分氧原子数相加,得到各组分氧原子数的总和 ΣO(表 7-5,第 6 列合计栏)。 ⑥ 由于氧离子极少被其他元素替代,故以矿物通式中的氧原子理论数 Of.u.为基准,通 过 Of.u./∑O,求得换算系数(表 7-5,倒数第 2 行)。 ⑦ 以各组分摩尔数乘以相应的组分阳离子系数,如 Al2O3的阳离子系数为 2,得各组 分的阳离子数(表 7-5,第 7 列)。 ⑧ 以各组分的阳离子数乘以换算系数(Of.u./ΣO),得到单位分子中的相应组分的阳离 子数(表 7-5,第 8 列),如 SiO2的单位分子中阳离子数为:0.929 3×2.112 7=1.963 3。 ⑨ 根据晶体化学知识(主要是类质同象替代关系)和矿物的化学通式,将各阳离子分配 到相应的晶格位置,即本例矿物化学通式 W1-p(X,Y)1+p[Z2O6]中 W、X、Y、Z 的位置。其 中,W 代表 Na+、Ca2+;X 代表 Mg2+、Fe2+、Mn2+等;Y 代表 Fe3+、Cr3+、Al3+、Ti4+等; Z 主要是 Si4+、Al3+,偶有 Fe3+、Cr3+、Ti4+等。其中,Al3+在 Y、Z 的位置均较常见,并通 常优先考虑将 Al3+分配在 Z 的位置上。本例中的全部 Al3+均占据四面体位置,Si4++Al3+ 的离子数仍小于通式 Z 离子数,故全部 Al3+均应占据四面体位置,其余不足部分由 Fe3+补 充,即占据四面体位置的 Fe3+数为:2-1.96-0.02=0.02。 ⑩ 按矿物的化学通式,检验阴、阳离子电价是否平衡。 ⑪ 写出矿物的晶体化学式(表 7-5,末行)。晶体化学式中要详细注明变价离子的电价、 互相类质同象等元素的详细比例数字(按单位分子中的阳离子数由大到小排序)。此时,呈 类质同象替代关系的元素符号间,不再以逗号相隔。 (2)阳离子法 仍以上述斜方辉石为例,介绍以阳离子法进行矿物化学式计算的步骤: ① 据化学分析资料,列出各组分质量分数数据(WB/%)(表 7-6,第 1、2 列)。相关要 求同阴离子法。并求得修正后各组分质量分数数据(表 7-6,第 3 列)。 ② 查出各组分的相对分子质量(表 7-6,第 4 列)。 ③ 以各组分的质量分数(修正后)除以相应组分的相对分子质量,求得各组分的摩尔数 (表 7-6,第 5 列)。 ④ 以各组分的摩尔数乘以相应组分中的阳离子系数,得到各组分的阳离子数(表 7-6, 第 6 列)。 ⑤ 将各组分阳离子数相加,得到各组分阳离子数的总和∑Me(表 7-6,第 6 列),本例 ∑Me=1.889 7。 ⑥ 以矿物单位分子(即矿物化学通式)内阳离子理论数 Mef.u.(本例为 4)为基准,通过 Mef.u./∑Me,求得换算系数,本例为 2.116 7(表 7-6,倒数第 2 行)。 ⑦ 以各组分阳离子数乘以换算系数,得到矿物单位分子中各组分的阳离子数(表 7-6, 第 7 列)。 ⑧ 根据矿物的化学通式(本例为 W1-p(X,Y)1+p[Z2O6]),将各阳离子分配到相应的晶格 位置(同前述氧离子法)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《结晶学与矿物学》课程教学资源(实验指导)实验一 晶体的投影.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验二 对称.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验三 对称.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验四 单形.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验五 聚形分析.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验六 等轴晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验七 四方晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验八 三方、六方晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验九 低级晶族的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验十 晶体内部结构的对称要素及空间群.ppt
- 《结晶学与矿物学》课程教学资源(前沿进展)晶体生长先进工艺 Addendum - Plasmonic nanosensors with inverse sensitivity by means of enzyme-guided crystal growth.pdf
- 《结晶学与矿物学》课程教学资源(重点难点)结晶学重点知识.ppt
- 《结晶学与矿物学》课程教学资源(重点难点)根据晶体化学知识判断正反尖晶石结构.ppt
- 《结晶学》课程教学资源(教案讲义)第一章 晶体与非晶体的概念.pdf
- 《结晶学》课程教学资源(教案讲义)第二章 晶体生长的基本规律.pdf
- 《结晶学》课程教学资源(教案讲义)第三章 晶体的面角恒等和投影.pdf
- 《结晶学》课程教学资源(教案讲义)第四章 晶体的宏观对称.pdf
- 《结晶学》课程教学资源(教案讲义)第五章 晶体定向与结晶符号.pdf
- 《结晶学》课程教学资源(教案讲义)第六章 单形和聚形.pdf
- 《结晶学》课程教学资源(教案讲义)第七章 实际晶体的形态.pdf
- 中国矿业大学出版社:《矿物学》课程规划教材PDF电子书(第一篇 结晶学基础,共六章).pdf
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)10 矿物的物理性质.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)11 矿物的成因标型.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)13 矿物的命名和分类.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)14 自然元素矿物大类.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)15 硫化物及其类似化合物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)16 氧化物和氢氧化物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)17 含氧盐矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)18 卤化物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)03 晶体定向和晶面符号.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)04 单形与聚形.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)05 晶体内部结构和生长简介.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)06 晶体的规则连生.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)07 晶体化学基础知识.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)08 矿物的化学成分.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)09 矿物的形态.ppt
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 2.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 4.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 9.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识1.doc
