《结晶学与矿物学》课程教学资源(步进教程,PPT课件)07 晶体化学基础知识

第六章晶体化学基础知识晶体化学:研究晶体结构和晶体的化学组成与晶体形态、物理性质、化学性质之间关系和规律的一门科学
第六章 晶体化学基础知识 晶体化学:研究晶体结构和晶体的化学组成与 晶体形态、物理性质、化学性质之间关系和规 律的一门科学
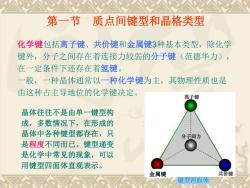
第一节质点间键型和晶格类型化学键包括离子键、共价键和金属键3种基本类型,除化学键外,分子之间存在着连接力较弱的分子键(范德华力),在一定条件下还存在着氢键一般,一种晶体通常以一种化学键为主,其物理性质也是由这种占主导地位的化学键决定离子键晶体往往不是由单一键型构成,多数情况下,在形成的晶体中各种键型都存在,只分子间力.是程度不同而已。键型递变是化学中常见的现象,可以用键型四面体直观表示。共价键金属键键型四面体
第一节 质点间键型和晶格类型 化学键包括离子键、共价键和金属键3种基本类型,除化学 键外,分子之间存在着连接力较弱的分子键(范德华力), 在一定条件下还存在着氢键。 一般,一种晶体通常以一种化学键为主,其物理性质也是 由这种占主导地位的化学键决定。 晶体往往不是由单一键型构 成,多数情况下,在形成的 晶体中各种键型都存在,只 是程度不同而已。键型递变 是化学中常见的现象,可以 用键型四面体直观表示。 键型四面体 金属键

晶体结构有4种晶格类型:以离子键或离子键占主导地位构成的离子晶格:以共价键构成的原子晶格;以金属键构成的金属晶格;以分子键构成的分子晶格。其中,在分子晶格中,分子之间由范德华力相联系,而分子内部的原子之间则以共价键相连接同一晶格类型的矿物有许多共同物理性质不同晶格类型的矿物则表现出明显的差异
❖ 晶体结构有4种晶格类型:以离子键或离子键 占主导地位构成的离子晶格;以共价键构成 的原子晶格;以金属键构成的金属晶格;以 分子键构成的分子晶格。其中,在分子晶格 中,分子之间由范德华力相联系,而分子内 部的原子之间则以共价键相连接。 ❖ 同一晶格类型的矿物有许多共同物理性质, 不同晶格类型的矿物则表现出明显的差异

质点间的键性用元素的电负性来判别,元素X的电负性是衡量原子得失电子能力大小的尺度,电负性越大得到电子的能力越强,即非金属性越强:反之,失去电子的倾向越大当两种元素的电负性差值很大时形成离子键对于电负性大或较大且数值相同的两原子形成典型的共价键;当两种元素的电负性介于上述两种情况之间,则形成过渡型化学键电负性都较小的一些同种金属元素则以金属键相结合
❖ 质点间的键性用元素的电负性来判别,元素 的电负性是衡量原子得失电子能力大小的尺 度,电负性越大得到电子的能力越强,即非 金属性越强;反之,失去电子的倾向越大。 当两种元素的电负性差值很大时形成离子键; 对于电负性大或较大且数值相同的两原子, 形成典型的共价键;当两种元素的电负性介 于上述两种情况之间,则形成过渡型化学键; 电负性都较小的一些同种金属元素则以金属 键相结合

不同晶格类型主要特征对比表晶格类型特点离子晶格原子晶格金属晶格分子晶格一般由电负性高由电负性很低的金属元素和组成晶格由电负性都较高的元由电负性都较低的元素的元素以共价键电负性很高的非金属元素结的元素素结合而成结合而成组成分子再构成合而成晶格结构单位间由分子键联系各离子键结合结合力决定干由共价键结合而成,由自由电子联结(金属的结合力一般很强键),具中等强度分子,一般较弱离子电价和半径,一般较强共价键具方向性和饱离子一般呈球形,正、负离分子常呈非球形和性,原子只能在一常作等大球体最紧密堆结构特点子尽量相间分布,排列尽量最紧密堆积,但积定方向结合,排列常紧密堆积形式复杂不紧密透明一半透明透明一半透明、玻璃光学性质不透明、金属光泽透明、玻璃光泽光泽一金刚光泽金刚光泽硬度低一中等,强延展力学性质硬度很低硬度中一高,具脆性硬度很高,具脆性性溶于有机溶剂在极性溶剂(如水)中溶解溶解度不溶于水不溶于水度较大不溶于水不良导体良导体不良导体电学性质不良导体
特 点 晶格类型 离子晶格 原子晶格 金属晶格 分子晶格 组成晶格 的元素 由电负性很低的金属元素和 电负性很高的非金属元素结 合而成 由电负性都较高的元 素结合而成 由电负性都较低的元素 结合而成 一般由电负性高 的元素以共价键 组成分子再构成 晶格 结构单位间 的结合力 离子键结合,结合力决定于 离子电价和半径,一般较强 由共价键结合而成, 一般很强 由自由电子联结(金属 键),具中等强度 由分子键联系各 分子,一般较弱 结构特点 离子一般呈球形,正、负离 子尽量相间分布,排列尽量 紧密 共价键具方向性和饱 和性,原子只能在一 定方向结合,排列常 不紧密 常作等大球体最紧密堆 积 分子常呈非球形 最紧密堆积,但 堆积形式复杂 光学性质 透明、玻璃光泽 透明—半透明、玻璃 光泽—金刚光泽 不透明、金属光泽 透明—半透明, 金刚光泽 力学性质 硬度中—高,具脆性 硬度很高,具脆性 硬度低—中等,强延展 性 硬度很低 溶解度 在极性溶剂(如水)中溶解 度较大 不溶于水 不溶于水 溶于有机溶剂, 不溶于水 电学性质 不良导体 不良导体 良导体 不良导体 不同晶格类型主要特征对比表

第二节球体的紧密堆积将晶体内的质点(原子、离子)作为球体来考虑,以共价键为主的原子晶格,由于共价键具有方向性和饱和性,其原子不能作紧密堆积。在离子晶格和金属晶格中,由于其化学键没有方向性和饱和性,离子或原子趋向于与尽可能多的质点接触,以便达到引力与斥力平衡,使体系内能最小,晶体处于最稳定状态球体的最紧密堆积,可分为等大球体的最紧密堆积和不等大球的紧密堆积
将晶体内的质点(原子、离子)作为球体来考虑。 以共价键为主的原子晶格,由于共价键具有方向性和饱 和性,其原子不能作紧密堆积。 在离子晶格和金属晶格中,由于其化学键没有方向性和 饱和性,离子或原子趋向于与尽可能多的质点接触,以便达 到引力与斥力平衡,使体系内能最小,晶体处于最稳定状态。 球体的最紧密堆积,可分为等大球体的最紧密堆积和不 等大球的紧密堆积。 第二节 球体的紧密堆积
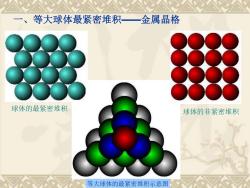
等大球体最紧密堆积一金属晶格球体的最紧密堆积球体的非紧密堆积等大球体的最紧密堆积示意图
等大球体的最紧密堆积示意图 球体的非紧密堆积 一、等大球体最紧密堆积——金属晶格 球体的最紧密堆积

1.堆积方式(1)在直线上的排列::一个靠一个的串珠状链式排列(2)在平面上排列第1层堆积(A):在一个平面作最紧密堆积时,只有一种方式即每个球体与周围六个球体接触,并在球体之间形成两类数目相同,指向上下相反且相间分布的弧形三角形空隙:堆积中的三种位置分别标注为:A位:第一层球所在位:B位:三角尖向上的空隙:C位:三角尖向下的空隙。三种位置标注.swf尖角向上二尖角向下
1. 堆积方式 (1)在直线上的排列:一个靠一个的串珠状链式排列。 (2)在平面上排列 第1层堆积(A):在一个平面作最紧密堆积时,只有一种方式, 即每个球体与周围六个球体接触,并在球体之间形成两类数目 相同,指向上下相反且相间分布的弧形三角形空隙;堆积中的 三种位置分别标注为:A位:第一层球所在位;B位:三角尖向 上的空隙;C位:三角尖向下的空隙。三种位置标注.swf 尖 角 向 上 尖 角 向 下 尖 角 向 上 尖 角 向 下 B C A
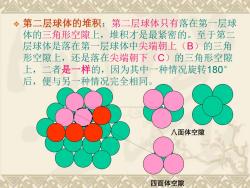
,第二层球体的堆积:第二层球体只有落在第一层球体的三角形空隙上,堆积才是最紧密的。至于第二层球体是落在第一层球体中尖端朝上(B)的三角形空隙上,还是落在尖端朝下(C)的三角形空隙上,二者是一样的,因为其中一种情况旋转180后,便与另一种情况完全相同八面体空隙四面体空隙
❖ 第二层球体的堆积:第二层球体只有落在第一层球 体的三角形空隙上,堆积才是最紧密的。至于第二 层球体是落在第一层球体中尖端朝上(B)的三角 形空隙上,还是落在尖端朝下(C)的三角形空隙 上,二者是一样的,因为其中一种情况旋转180° 后,便与另一种情况完全相同。 八面体空隙 四面体空隙

:第三层球体的堆积:有两种方式,第一种堆积方式是第三层球体的堆积位置与第一层球体的位置完全相同,当在其上堆积第四层球体时,其位置与第二层球体的位置完全相同,依次类推,球体按ABABAB...·..每两层重复一次的规律堆积即球体在四面体空隙上进行第三层堆积.SWf六方最紧密堆积
❖ 第三层球体的堆积:有两种方式,第一种堆积方式是第三层 球体的堆积位置与第一层球体的位置完全相同,当在其上堆 积第四层球体时,其位置与第二层球体的位置完全相同,依 次类推,球体按ABABAB.每两层重复一次的规律堆积, 即球体在四面体空隙上进行。 A B A B 第三层堆积.swf
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)06 晶体的规则连生.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)05 晶体内部结构和生长简介.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)04 单形与聚形.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)03 晶体定向和晶面符号.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)18 卤化物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)17 含氧盐矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)16 氧化物和氢氧化物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,讲稿)15 硫化物及其类似化合物矿物大类.pdf
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)14 自然元素矿物大类.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)13 矿物的命名和分类.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)11 矿物的成因标型.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)10 矿物的物理性质.ppt
- 中国矿业大学出版社:《矿物学》课程规划教材PDF电子书(第一篇 结晶学基础,共六章).pdf
- 中国矿业大学出版社:《矿物学》课程规划教材PDF电子书(第二部分,共十三章).pdf
- 《结晶学与矿物学》课程教学资源(实验指导)实验一 晶体的投影.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验二 对称.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验三 对称.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验四 单形.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验五 聚形分析.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验六 等轴晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)08 矿物的化学成分.ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)09 矿物的形态.ppt
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 2.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 4.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识 9.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识1.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识10.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识11.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识12.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识13.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识3.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识5.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识6.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识7.doc
- 《结晶学与矿物学》课程教学资源(图片集)矿物赏识8.doc
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)01 晶体与晶体的基本性质(山东理工大学:高玉娟).ppt
- 《结晶学与矿物学》课程教学资源(步进教程,PPT课件)02 晶体的对称.ppt
- 《材料物理性能》课程教学资源(PPT课件)第五章 材料的光学性能.ppt
- 《结晶学与矿物学》课程教学资源(课件讲稿)第一章 晶体与晶体的基本性质.pdf
- 《结晶学与矿物学》课程教学资源(课件讲稿)第三章 晶体定向和晶面符号.pdf
