重庆工商大学:《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法

第四章酸碱滴定法 500 400 300 2025/3/19
2025/3/19 1
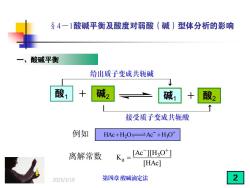
§4一1酸碱平衡及酸度对弱酸(碱)型体分析的影响 酸碱平衡 给出质子变成共轭碱 酸1 碱2 碱1 酸2 接受质子变成共轭酸 例如 HAc+H20≥Ac+H30t 离解常数 Ka=[Ac IIH3O+] [HAc] 2025/3/19 第四章酸碱滴定法 2
2025/3/19 §4-1 一、酸碱平衡 例如 离解常数 3 a [Ac ][H O ] K [HAc] − + = 1 1 2 + 2 + HAc H O Ac H O 2 3 − + + +

对共轭碱 Ac+H2O、≌HAc+OH 同样有离解常数 Kb= [HAC][OH [Ac] 因此 Ka·Kb=Kw 对多元酸同样存在A3-+H0+一HA2-+OH Kw 3 HA2-+H3O+、=H2A+OH Kb2 Ka2 H2A+H3O+H3A+OH- Kb3 Kw 可以看出 Kai= Kw Kbj (i+j=n+1) 2025/3/19 第四章酸碱滴定法 3
2025/3/19 对共轭碱 Ac H O HAc OH 2 − − + + 同样有离解常数 b [HAc][OH ] K [Ac ] − − = 因此 K K K a b w = 对多元酸同样存在 3 2 w 3 b1 a 3 K A H O HA OH K K − + − − + + = 2 w 3 2 b2 a 2 K HA H O H A OH K K − + − − + + = w 2 3 3 b3 a1 K H A H O H A OH K K − + − + + = 可以看出 w ai bj K K (i j n 1) K = + = +

二、酸度对弱酸(碱) 型体分析的影响 在弱酸(碱)溶液中,酸(碱)以各种型体存在的平衡浓 度与其分析浓度(总浓度)的比值,称为分布系数。 [HAc] 6.=[Ac] CHAC Ac 由物料关系知道 CHAC =[HAc]+[Ac 如果已知了分布系数,便可以求得溶液中酸碱组分的平衡 浓度 2025/3/19 第四章酸碱滴定法 4
2025/3/19 在弱酸(碱)溶液中, 酸(碱)以各种型体存在的平衡浓 度与其分析浓度(总浓度)的比值, 称为分布系数。 二、酸度对弱酸(碱)型体分析的影响 HAc HAc Ac Ac HAc C Ac C = − = − − [ ] , [ ] 如果已知了分布系数, 便可以求得溶液中酸碱组分的平衡 浓度 HAc c [HAc] [Ac ] − = + 由物料关系知道

讨论 1. 一元弱酸(碱)溶液中各种型体的分布 以HAc为例,若HAc的总浓度为C,则 CHA =[HA]+[A-] 由平衡式知道 [A-]=[HAIKa [H] 由分布系数的定义 δHA= [HA][H'] CHA [H*]+Ka A]= Ka CHA [H*]+Ka 2025/3/19 第四章酸碱滴定法 5
2025/3/19 1. c [HA] [A ] HA − = + 以HAc为例,若HAc的总浓度为C,则 由平衡式知道 a [HA]K [A ] [H ] − + = 由分布系数的定义 HA HA a [HA] [H ] c [H ] K + + = = + a A HA a [A ] K c [H ] K − − + = = +

显然 δHA+δA=1 对于一元弱碱,可以类似的推导: 8=WH,]_ [H] Ko NH* C [H+]+K。[OH]+K。 [NH]- Ka [OH-] C[H*]+K。 [OH]+K。 仍然 H,+⊙4= 2025/3/19 第四章酸碱滴定法 6
2025/3/19 对于一元弱碱, 可以类似的推导: 显然 HA A + =− 1 N H4 + = = + = + + + + − [ ] [ ] [ ] [ ] NH C H H K K a OH K b b 4 N H3 = = + = + + − − [ ] [ ] [ ] [ ] NH C K H K OH OH K a a b 3 仍然 NH 3 + + = NH4 1
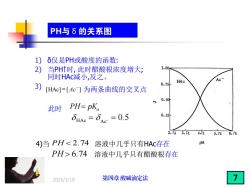
PH与δ的关系图 1)δ仅是PH或酸度的函数: 2) 当PH↑时,此时醋酸根浓度增大; 1.00 同时HAc减小,反之。 HAc 3) 0.75 [HAc]=[Ac]为两条曲线的交叉点 0.50 此时 PH=pK。 SHAC=Se =0.5 0.25 2.743.744.745.746.74 4)当PH6.74溶液中几乎只有醋酸根存在 2025/3/19 第四章酸碱滴定法
2025/3/19 1) δ仅是PH或酸度的函数: 2) 当PH↑时, 此时醋酸根浓度增大; 同时HAc减小,反之。 3) [HAc] = [ Ac ] − 为两条曲线的交叉点 此时 PH = pKa HAc Ac = - = 0.5 4)当 PH 2.74 溶液中几乎只有HAc存在 PH 6.74 溶液中几乎只有醋酸根存在

2. 多元弱酸溶液中各种型的分布 H,CO,为例 C=[HCO]+[HCO J+[CO] 则 Bneo=IthCo_ (HI C [H+[H]Ka +KaKa, Bno -LHCO1 [H]K. [H'P+[H]Ka +Ka Kas Boo=IGo-1 KaKas [H+]2+[H*]Ka +Ka Ka 显然 8mco+Buco +Bco=1 2025/3/19 第四章酸碱滴定法 8
2025/3/19 2. H2 C2 O4 为例 C = H C O + HC O + C O − − [ ] [ ] [ ] 2 2 4 2 4 2 4 2 则 H C O a a a H C O C H H H K K K 2 2 4 1 1 2 2 2 4 2 2 = = + + + + + [ ] [ ] [ ] [ ] HC O a a a a HC O C H K 2 4 H H K K K 1 1 1 2 2 4 2 − = = + + − + + + [ ] [ ] [ ] [ ] C O a a a a a C O C K K 2 4 H H K K K 2 1 2 1 1 2 2 4 2 2 − = = + + − + + [ ] [ ] [ ] 显然 H C O 2 2 4 HC2 O4 C2 O4 + − + 2− = 1
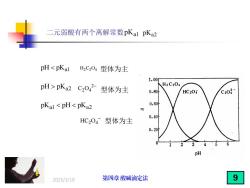
二元弱酸有两个离解常数pKal pKa2 pHpKa2C2O42型体为主 H2C204 0.80 HC20 C20 pKal <pH<pKa2 0.60 0.40 HC204型体为主 0.20 .45 pH 2025/3/19 第四章酸碱滴定法 9
2025/3/19 二元弱酸有两个离解常数 pKa1 pKa2 pH pK a1 H C O 2 2 4 型体为主 pH pK a2 2 C O2 4 − pK pH pK a1 a2 HC O2 4 − 型体为主 型体为主

§4一2酸碱溶液中H+浓度计算 一、 处理水溶液中酸碱平衡的方法 1. 物料平衡式 在平衡时,某物质的各种存在型体的浓度之和必然等于该物质的总浓 度,这一规律称为物料平衡或质量平衡.它的数学表达式为MBE. 例如:c(mol/)HPO: C=[HPO]+[HPO ]+HPO]+[PO] 2×10-3(mol)Cu(NO)2+0.2(mol-1r)WH3 0.2=[NH3]+[CNH)2+]+2[CNH3)22+]++5[CNH3)52+] 2025/3/19 第四章酸碱滴定法 10
2025/3/19 §4-2 H 在平衡时, 某物质的各种存在型体的浓度之和必然等于该物质的总浓 度, 这一规律称为物料平衡或质量平衡. 它的数学表达式为MBE. 1. c(mol / l)H PO : 3 4 c = H PO + H PO + HPO + PO − − − [ ] [ ] [ ] [ ] 3 4 2 4 4 2 4 3 3 1 1 2 10 ( ) ( ) 0.2( ) mol l Cu NO mol l NH 3 2 3 − − − + 0 2 3 3 2 5 2 3 2 2 3 5 2 . =[ ]+[ ( ) ]+ [ ( ) ]+ + [ ( ) ] + + + NH Cu NH Cu NH Cu NH
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第二章 误差与分析数据的处理.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概述.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第一章 绪论(主讲:方明建).ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第八章 化学分析中的分离方法.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第五章 络合滴定法 Complexometric Titration.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析的一般步骤及复杂试样分析.ppt
- 重庆工商大学:《分析化学》课程教学资源(PPT课件)第七章 重量分析法.ppt
- 重庆工商大学:《分析化学》课程作业习题(含解答)第九章 分离方法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第六章 氧化还原滴定法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第八章 分离方法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第七章 重量法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第四章 酸碱滴定法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第五章 络合滴定法.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第二章 误差与分析数据的处理.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第三章 滴定分析概论.doc
- 重庆工商大学:《分析化学》课程作业习题(含解答)第八章 复杂物质分析.doc
- 重庆工商大学:《分析化学》课程授课教案(讲义)第九章 分离方法.doc
- 重庆工商大学:《分析化学》课程授课教案(讲义)第七章 重量法.doc
- 重庆工商大学:《分析化学》课程授课教案(讲义)第四章 酸碱滴定法.doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《功能高分子》课程教学大纲(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《功能高分子》课程考试大纲(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《功能高分子材料研究方法》课程教学大纲(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《材料分析方法》课程考试大纲(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化学》课程教学大纲(应化、化学教育).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化学》课程考试大纲(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化工导论》课程教学大纲(化工).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化工导论》课程考试大纲(化工).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《功能高分子》课程授课教案(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《材料分析测试技术》课程授课教案(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《材料化学》课程授课教案(应化).doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化学》课程授课教案.doc
- 石河子大学:《高分子化学》课程教学资源(大纲教案)《高分子化工导论》课程授课教案(应化).doc
- 《高分子化学》课程教学资源(讲稿)材料研究方法(共四章,含绪论).doc
- 《高分子化学》课程教学资源(PPT课件)第一章 绪论 macromolecule chemistry(石河子大学:魏忠).ppt
- 《高分子化学》课程教学资源(PPT课件)第七章 配位聚合 Coordination Polymerization.ppt
- 《高分子化学》课程教学资源(PPT课件)第三章 自由基聚合 Free Radical Polymerization.ppt
- 《高分子化学》课程教学资源(PPT课件)第九章 聚合物的化学反应.ppt
- 《高分子化学》课程教学资源(PPT课件)第二章 缩聚和逐步聚合 Condensation and step polymerization.ppt
- 《高分子化学》课程教学资源(PPT课件)第五章 聚合方法 Polymerization Types.ppt
