内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第四节 电解与库仑分析

第四章 一、电解分析的基本原理 电化学分析法 二、库仑分析法 三、恒电流库仑分析— 第四节 库仑滴定 四、微库仑分析技术 电解与库仑分析 简介 下页 紫助 越回
第四章 电化学分析法 第四节 电解与库仑分析 简介 一、电解分析的基本原理 二、库仑分析法 三、恒电流库仑分析── 库仑滴定 四、微库仑分析技术
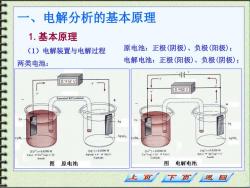
电解分析的基本原理 1.基本原理 (1)电解装置与电解过程 原电池:正极(阴极)、负极(阳极); 两类电池: 电解电池:正极(阳极)、负极(阴极); 0.42V 0.HS0 V aturated KCI solutio AgNO 1C21=0.0200M {Ag*1=0.0200M 1Ag1=0.0200M Culs)Cu-"(aq)+2e Ag(ag)+e=Ag(s) Agis)Ag'taq)+e Anode Cathode Cathode Anode 图 原电池 图 电解电池 下页 返回
一、电解分析的基本原理 1.基本原理 (1)电解装置与电解过程 两类电池: 原电池:正极(阴极)、负极(阳极); 电解电池:正极(阳极)、负极(阴极);
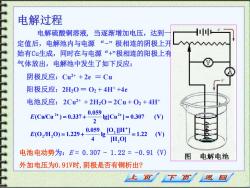
电解过程 电解硫酸铜溶液,当逐渐增加电压,达到 定值后,电解池内与电源“-”极相连的阴极上开 始有Cū生成,同时在与电源“+”极相连的阳极上有 气体放出,电解池中发生了如下反应: 阴极反应:Cu2++2e=Cu 阳极反应:2H20=02+4H++4e 电池反应:2C2++2H20=2Cu+02+4H ECwCu)=037+"959e1Cr1=307 (V) E0,H,0=129+0.0s9g0,l1-=1.22 4gH,0 电池电动势为:E=0.307-1.22=-0.91(V) 图电解电池 外加电压为0.91V时,阴极是否有铜析出? 下页 返回
电解过程 电解硫酸铜溶液, 当逐渐增加电压,达到一 定值后,电解池内与电源 “-” 极相连的阴极上开 始有Cu生成,同时在与电源“+”极相连的阳极上有 气体放出,电解池中发生了如下反应: 阴极反应:Cu2+ + 2e = Cu 阳极反应:2H2O = O2 + 4H+ +4e 电池反应:2Cu2+ + 2H2O = 2Cu + O2 + 4H+ 电池电动势为:E = 0.307 - 1.22 = -0.91 (V) 外加电压为0.91V时,阴极是否有铜析出? 1.22 (V) [H O] [O ][H ] lg 4 0.059 (O /H O) 1.229 lg[Cu ] 0.307 (V) 2 0.059 (Cu/Cu ) 0.337 2 2 2 2 2 2 = + = = + = + + + E E

(2)理论分解电压与析出电位 a.理论分解电压: 根据能斯特方程计算,使反应进行,需要提 供的最小外加电压(D点) 0.5 b.实际分解电压(析出电位) () .4 0.3 实际开始发生电解反应时的电压,其值大 0.2 于理论分解电压(D点) 0. c.产生差别的原因 1.0 2.0 3.0 外加电压(Y) 超电位(n)、电解回路的电压降(R a'理论计算曲线 a实测曲线 D'理论分解电压 D实际分解电压 的存在。则外加电压应为: 图4-20电解C溶液的电流-电压曲线 E外=(E阳+I阳 0- (E阴+阴) +iR 理论分解电压小于实际分解电压的原因是由于超电位的存在,但超 电位是如何产生的呢? 返回
(2)理论分解电压与析出电位 a. 理论分解电压: 根据能斯特方程计算,使反应进行,需要提 供的最小外加电压(D’点) 。 b. 实际分解电压(析出电位) 实际开始发生电解反应时的电压,其值大 于理论分解电压(D点)。 c. 产生差别的原因 超电位(η)、电解回路的电压降(iR) 的存在。则外加电压应为: E外 = (E阳 + η阳)- (E阴 + η阴) + iR 理论分解电压小于实际分解电压的原因是由于超电位的存在,但超 电位是如何产生的呢?

(3) 浓差极化 产生超电位的原因: 电极极化 电极极化:电解时,电极上有净电流流过时,电极电位 偏离其平衡电位的现象。 电极极化包括:浓差极化和电化学极化 电极扩散层 溶液 浓差极化: 电流流过电极,表面 用国 用用⊕ @o0 形成浓度梯度。使正极电位增大,负极电 0。 国用田国 位减小。 e 88806 减小浓差极化的方法: ① a.减小电流,增加电极面积; 国用国 0-10 A b.搅拌,有利于扩散 扩散层与浓差极化 回可
(3)浓差极化 产生超电位的原因: 电极极化 电极极化:电解时,电极上有净电流流过时,电极电位 偏离其平衡电位的现象。 电极极化包括:浓差极化和电化学极化 浓差极化: 电流流过电极,表面 形成浓度梯度。使正极电位增大,负极电 位减小。 减小浓差极化的方法: a.减小电流,增加电极面积; b.搅拌,有利于扩散

(4)电化学极化 电化学极化:电荷迁越相界面的放电所需的超电位。 产生的原因:电极反应速度慢,电极上聚集了一定的 电荷。 上页 下页返回
(4)电化学极化 电化学极化:电荷迁越相界面的放电所需的超电位。 产生的原因:电极反应速度慢,电极上聚集了一定的 电荷
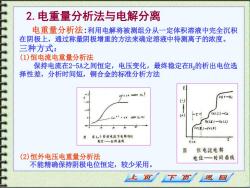
2.电重量分析法与电解分离 电重量分析法:利用电解将被测组分从一定体积溶液中完全沉积 在阴极上,通过称量阴极增重的方法来确定溶液中待测离子的浓度。 三种方式: (1)恒电流电重量分析法 保持电流在2-5A之间恒定,电压变化,最终稳定在H,的析出电位选 择性差,分析时间短,铜合金的标准分析方法 242e 2H1H: -Z- ca(I)-Cu Cu'+e =tu(s) () Ca)-u(1) Fe()-Fe(E) 在1,5安培电流下电解织的 电位一时问面线 图 恒电流电解 (2)恒外电压电重量分析法 电位—一时间曲线 不能精确保持阴极电位恒定,较少采用。 上页 返回
2.电重量分析法与电解分离 电重量分析法:利用电解将被测组分从一定体积溶液中完全沉积 在阴极上,通过称量阴极增重的方法来确定溶液中待测离子的浓度。 三种方式: (1)恒电流电重量分析法 保持电流在2-5A之间恒定,电压变化,最终稳定在H2的析出电位选 择性差,分析时间短,铜合金的标准分析方法 (2)恒外电压电重量分析法 不能精确保持阴极电位恒定,较少采用
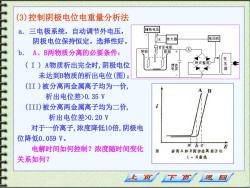
(3)控制阴极电位电重量分析法 a.三电极系统,自动调节外电压, 辅助电压 阴极电位保持恒定。选择性好。 R 做大器 电动机 甘汞电极 b. A、B两物质分离的必要条件: 阴极 阳极 (I)A物质析出完全时,阴极电位 电容 未达到B物质的析出电位(图); (II)被分离两金属离子均为一价, 析出电位差>0.35V (III)被分离两金属离子均为二价, 析出电位差>0.20V 对于一价离子,浓度降低10倍,阴极电 位降低0.059V。 电解时间如何控制?浓度随时间变化 a b c E 分离A和B两种金属离子的 关系如何? 1-卫曲线 下页 返回
(3)控制阴极电位电重量分析法 a. 三电极系统,自动调节外电压, 阴极电位保持恒定。选择性好。 b. A、B两物质分离的必要条件: ( I ) A物质析出完全时,阴极电位 未达到B物质的析出电位(图); (II )被分离两金属离子均为一价, 析出电位差>0.35 V (III)被分离两金属离子均为二价, 析出电位差>0.20 V 对于一价离子,浓度降低10倍,阴极电 位降低0.059 V。 电解时间如何控制?浓度随时间变化 关系如何?

电解时间的控制 控制阴极电位电重量分析过程中如 何控制电解时间?电流-时间曲线。 DA 贵 i,=ine i=i610- Q=Tidr 浓度与时间关系为: C,=Cn10- 时间 A: 电极面积;D:扩散系数; :溶液体积;:扩散层厚度 电解完成99.9%所需的时间为: 当/i=0.001时,认为电解完全。 043d tg9.9%=7.06/D4 c=1-X=10 Co 电解完成的程度与起始 电解完成X所需时间为: 浓度无关。与溶液体积成正 Vδg(1-X) 比,与电极面积成反比。 Ix=- 0.43DA 返 回可
电解时间的控制 电解完成99.9%所需的时间为: t 99.9% = 7.0V/DA 电解完成的程度与起始 浓度无关。与溶液体积V成正 比,与电极面积A成反比。 控制阴极电位电重量分析过程中如 何控制电解时间? 电流-时间曲线。 Kt t Kt t t V DA t c c i i e i i − − − = = = 10 10 0 0 0 浓度与时间关系为: A:电极面积;D:扩散系数; V:溶液体积;:扩散层厚度 当i t /i0=0.001时,认为电解完全。 DA V X t X X c c X t V DA t 0.43 lg 1 1 10 0.43 0 ( ) 电解完成 所需时间为: − = − = − = −

二、库仑分析法 1.基本原理 法拉第第一定律: 物质在电极上析出产物的质量W与电解池的电量O成正 比。 法拉第第二定律: W= O M n 式中:M为物质的摩尔质量(g),Q为电量(1库仑=1安培 ×1秒),F为法拉第常数(1F=96487库仑),n为电极反应 中转移的电子数。 下页 返回
二、库仑分析法 1. 基本原理 法拉第第一定律: 物质在电极上析出产物的质量W与电解池的电量Q成正 比。 法拉第第二定律: n M F Q W = 式中:M为物质的摩尔质量(g),Q为电量(1库仑=1安培 ×1秒),F为法拉第常数(1F=96487库仑),n为电极反应 中转移的电子数
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第三节 电位分析法及应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第二节 电极的构造和原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第一节 电化学分析法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第四节 滴定分析法应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第三节 滴定分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第二节 化学平衡.ppt
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第四章 酸碱滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十章 红外分光光度法简介.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十二章 气相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十一章 色谱法基本概念及经典液相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第六章 配位滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第八章 电化学分析法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第五章 沉淀滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第九章 紫外-可见分光光度法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第二章 误差和分析数据处理.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第三章 滴定分析法概论.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第七章 氧化还原滴定法.pptx
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第1章 绪论 Instrumental analysis(主讲:杨红兵).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(2/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(1/2).ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第五节 极谱与伏安分析法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第六节 电导分析法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第一节 光度法基本原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 分析化学的作用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第三节 显色与测量条件的选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第四节 分光光度测量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第五节 有机物紫外光谱解析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第一节 原子吸收分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第二节 原子吸收分光光度仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第三节 干扰及其消除.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第四节 条件选择与定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第一节 色谱法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第二节 气相色谱仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分析化学的分类与进展.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第三节 色谱理论基础.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第六节 毛细管色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第七节 液相色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第八节 离子色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第九节 高效毛细管电泳.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第一节 概述.ppt
