内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第二节 电极的构造和原理

第四章 一、电极与电极分类 电化学分析法 二、离子选择性电极 的种类和结构 第二节 三、离子选择电极的 电极的构造和原理 特性 下页 螺助 越回
第四章 电化学分析法 第二节 电极的构造和原理 一、电极与电极分类 二、离子选择性电极 的种类和结构 三、离子选择电极的 特性
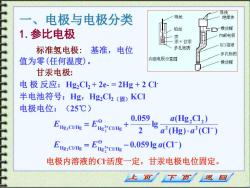
导线 、 电极与电极分类 导线 绝缘体 1.参比电极 铂丝 y橡皮帽 汞 内部电极 +甘汞 标准氢电极: 基准,电位 多孔物质 KC1溶液 多孔物质 值为零(任何温度)。 内部电极示意图 橡皮帽 甘汞电极: 电极反应:Hg2Cl2+2e-=2Hg+2CI 半电池符号:Hg,Hg2C2(固)KC1 电极电位:(25℃) 0.059 E,电=E3e+ g a(Hg2Cl2) 2 a(Hg).a2(CI) E.C=Eec-0.059ga(Cl- 电极内溶液的C活度一定,甘汞电极电位固定。 上页 下页 返回
一、电极与电极分类 甘汞电极: 电 极 反应:Hg2Cl2 + 2e- = 2Hg + 2 Cl- 半电池符号:Hg,Hg2Cl2(固)KCl 电极电位:(25℃) 电极内溶液的Cl-活度一定,甘汞电极电位固定。 0.059lg (Cl ) (Hg) (Cl ) (Hg Cl ) lg 2 0.059 O Hg Cl/Hg Hg Cl/Hg 2 2 O 2 2 Hg Cl/Hg Hg Cl/Hg 2 2 2 2 2 2 − − = − = + + + E E a a a a E E 1.参比电极 标准氢电极: 基准,电位 值为零(任何温度)
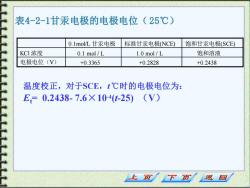
表4-2-1甘汞电极的电极电位(25℃) 0.1mol/L甘汞电极 标准甘汞电极(NCE) 饱和甘汞电极(SCE) KCI浓度 0.1 mol/L 1.0 mol/L 饱和溶液 电极电位(V) +0.3365 +0.2828 +0.2438 温度校正,对于SCE,t℃时的电极电位为: E=0.2438-7.6×104t-25)(V) 上页 下页小 返回
表4-2-1甘汞电极的电极电位( 25℃) 0.1mol/L 甘汞电极 标准甘汞电极(NCE) 饱和甘汞电极(SCE) KCl 浓度 0.1 mol / L 1.0 mol / L 饱和溶液 电极电位(V) +0.3365 +0.2828 +0.2438 温度校正,对于SCE,t℃时的电极电位为: Et= 0.2438- 7.6×10-4 (t-25) (V)

银-氯化银电极: 银丝镀上一层AgCI沉淀,浸在一定浓度的KCI溶液中即构 成了银-氯化银电极。 电极反应:AgCI+e-==Ag+Cl 半电池符号:Ag,AgCI(固)KCI 电极电位(25℃):EARCVAE=EAECVA-0.059lgaC 导线 KC1溶液 Hg 镀AgCI的Ag丝 多孔物质 上页 下页返回
银丝镀上一层AgCl沉淀,浸在一定浓度的KCl溶液中即构 成了银-氯化银电极。 电极反应:AgCl + e- == Ag + Cl- 半电池符号:Ag,AgCl(固)KCl 电极电位(25℃):EAgCl/Ag = E AgCl/Ag - 0.059lgaCl- 银-氯化银电极:
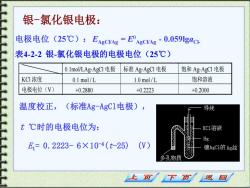
银-氯化银电极: 电极电位(25℃):EARCVAE=EARCVA-0.059ga@ 表4-2-2银-氯化银电极的电极电位(25℃) 0.1 mol/LAg-AgC1电极 标准Ag-AgCI电极 饱和Ag-AgCI电极 KCI浓度 0.1 mol/L 1.0 mol/L 饱和溶液 电极电位(V) +0.2880 +0.2223 +0.2000 温度校正, (标准Ag-AgC1电极), 导线 t℃时的电极电位为: KC1溶液 Hg E,=0.2223-6×10-4(t-25) (W) 镀AgCI的Ag丝 多孔物质 上页 下页 返回
温度校正,(标准Ag-AgCl电极), t ℃时的电极电位为: Et= 0.2223- 6×10-4(t-25) (V) 电极电位(25℃):EAgCl/Ag = E AgCl/Ag - 0.059lgaCl- 表4-2-2 银-氯化银电极的电极电位(25℃) 0.1mol/LAg-AgCl 电 极 标准 Ag-AgCl 电极 饱和 Ag-AgCl 电极 KCl 浓度 0.1 mol / L 1.0 mol / L 饱和溶液 电极电位(V) +0.2880 +0.2223 +0.2000 银-氯化银电极:

2.指示电极 第一类电极一金属-金属离子电极 例如:Ag-AgNO3电极(银电极), Zn-ZnS04电极(锌电极)等。 电极电位为:E+M=EMn+M-0.059lg4Mn+ 第一类电极的电位仅与金属离子的活度有关。 第二类电极—金属-金属难溶盐电极 二个相界面,常用作参比电极 下页 返回
2.指示电极 第一类电极──金属-金属离子电极 例如:Ag-AgNO3电极(银电极), Zn-ZnSO4电极(锌电极)等。 电极电位为: EM n+ /M = E M n+ /M - 0.059lgaM n+ 第一类电极的电位仅与金属离子的活度有关。 第二类电极──金属-金属难溶盐电极 二个相界面,常用作参比电极

第三类电极—汞电极 金属汞(或汞齐丝)浸入含有少量Hg2+EDTA配合物及 被测金属离子的溶液中所组成。 根据溶液中同时存在的Hg+和M+与EDTA间的两个配位 平衡,可以导出以下关系式: EHg22+/Hg)=E(Hg22+Hg)-0.0591g4+ 惰性金属电极 电极不参与反应,但其晶格间的自由电子可与溶液进行交 换。故惰性金属电极可作为溶液中氧化态和还原态获得电子 或释放电子的场所。 下页 返回
第三类电极──汞电极 金属汞(或汞齐丝)浸入含有少量Hg2+ -EDTA配合物及 被测金属离子的溶液中所组成。 根据溶液中同时存在的Hg2+和Mn+与EDTA间的两个配位 平衡,可以导出以下关系式: E(Hg2 2+ /Hg )= E (Hg2 2+ /Hg )- 0.059lgaM n+ 惰性金属电极 电极不参与反应,但其晶格间的自由电子可与溶液进行交 换。故惰性金属电极可作为溶液中氧化态和还原态获得电子 或释放电子的场所

膜电极: 特点:对特定离子有选择性响应(离子选择性电极)。 膜电极的关键:选择膜(敏感元件)。 敏感元件:单晶、混晶、液膜、高分子功能膜及生物膜。 膜内外被测离子活度的不同而产生电位差。 将膜电极和参比电极一起插到被测溶液中,则电池为: 外参比电极‖被测溶液(4未知)丨内充溶液(山一定)丨内参比电极 (敏感膜) 内外参比电极的电位值固定,且内充溶液中 Ag-AgCl 离子的活度也一定,则电池电动势为: 氣离子选择膜电极 内参比 电视 F 内参比 溶液 E=E士 RT na nF 页 下页 返回
膜电极: 特点:对特定离子有选择性响应(离子选择性电极)。 膜电极的关键:选择膜(敏感元件)。 敏感元件:单晶、混晶、液膜、高分子功能膜及生物膜。 膜内外被测离子活度的不同而产生电位差。 将膜电极和参比电极一起插到被测溶液中,则电池为: 外参比电极‖被测溶液( ai未知)∣ 内充溶液( ai一定)∣ 内参比电极 (敏感膜) 内外参比电极的电位值固定,且内充溶液中 离子的活度也一定,则电池电动势为: ai nF RT E = E ln

二、离子选择性电极的种类和结构 1.晶体膜电极 Ag-AgCI 结构:(氟电极) 内参比 电极 敏感膜:(氟化镧单晶): 氣离子选择膜电极 F、C 内参比 掺有EuF2的LaF3单晶切片; 溶液 氟化钢 内参比电极:Ag一AgC1电极(管内) 单晶膜 内参比溶液:0.1 mol/L NaCI+0.1mol/LNaF混合溶液 F用来控制膜内表面的电位,C用以固定内参比电极的 电位 下页 返回
二、离子选择性电极的种类和结构 1.晶体膜电极 结构:(氟电极) 敏感膜:(氟化镧单晶): 掺有EuF2 的LaF3单晶切片; 内参比电极:Ag-AgCl电极(管内) 内参比溶液:0.1 mol/L NaCl + 0.1 mol/L NaF 混合溶液 F -用来控制膜内表面的电位,Cl-用以固定内参比电极的 电位

原理: LaF3的晶格中有空穴,在晶格上的F可 氟 以移入晶格邻近的空穴而导电。对于一定的 离 Ag-AgC】 内参比 电极 晶体膜,离子的大小、形状和电荷决定其是 选 F、CI 否能够进入晶体膜内,故膜电极一般都具有 膜 内参比 溶液 较高的离子选择性。 极 氟化钢 单晶膜 当氟电极插入到F溶液中时,F在晶体 膜表面进行交换。25℃时: E膜=K-0.059gr=K+0.059pF 高选择性,需要在pH5~7之间使用, pH高时:溶液中的OⅢ与氟化镧晶体膜中的F交换; pH较低时:溶液中的F生成HF或HF,。 下页 返回
原理: LaF3的晶格中有空穴,在晶格上的F -可 以移入晶格邻近的空穴而导电。对于一定的 晶体膜,离子的大小、形状和电荷决定其是 否能够进入晶体膜内,故膜电极一般都具有 较高的离子选择性。 当氟电极插入到F -溶液中时,F -在晶体 膜表面进行交换。25℃时: E膜 = K - 0.059 lgaF -= K + 0.059 pF 高选择性,需要在pH5~7之间使用, pH高时:溶液中的OH-与氟化镧晶体膜中的F -交换; pH较低时:溶液中的F -生成HF或HF2 -
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第一节 电化学分析法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第四节 滴定分析法应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第三节 滴定分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第二节 化学平衡.ppt
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第四章 酸碱滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十章 红外分光光度法简介.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十二章 气相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十一章 色谱法基本概念及经典液相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第六章 配位滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第八章 电化学分析法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第五章 沉淀滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第九章 紫外-可见分光光度法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第二章 误差和分析数据处理.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第三章 滴定分析法概论.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第七章 氧化还原滴定法.pptx
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第1章 绪论 Instrumental analysis(主讲:杨红兵).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(2/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(1/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第5章 分子发光光谱法 Molecular luminescence spectrometry,MLS.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第3章 原子吸收 Atomic absorption spectrometry, AAS.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第三节 电位分析法及应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第四节 电解与库仑分析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第五节 极谱与伏安分析法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第六节 电导分析法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第一节 光度法基本原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 分析化学的作用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第三节 显色与测量条件的选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第四节 分光光度测量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第五节 有机物紫外光谱解析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第一节 原子吸收分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第二节 原子吸收分光光度仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第三节 干扰及其消除.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第四节 条件选择与定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第一节 色谱法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第二节 气相色谱仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分析化学的分类与进展.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第三节 色谱理论基础.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第六节 毛细管色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第七节 液相色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第八节 离子色谱法.ppt
