内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第六节 电导分析法

第四章 电解质溶液的基本 电化学分析法 性质 二、电导测量 三、电导分析法的应用 第六节 电导分析法 下页 螺助 热回
第六节 电导分析法 第四章 电化学分析法 一、 电解质溶液的基本 性质 二、 电导测量 三、 电导分析法的应用

电解质溶液的基本性质 1. 电解质溶液的基本性质 导电性质:离子导电; 1)1 电导(G、电导率(、摩尔电导率(Am) 电导:衡量电解质溶液导电能力的物理量,电阻的倒数。 G=1/R=K·A/I=K·KWA 单位:西门子S,1S=121 电导率:K=1/p=KWA·G 电阻率的倒数单位:S.ml 两电极板为单位面积,距离为单位长度时溶液的电导。 电导池常数:KwA=IA (A电极面积;1电极间距) 由标准KC1溶液的电导率(查表)确定电导率和电导池常数。 下页 返回
一、电解质溶液的基本性质 1. 电解质溶液的基本性质 导电性质:离子导电; (1) 电导(G) 、电导率() 、摩尔电导率(m) 电导:衡量电解质溶液导电能力的物理量,电阻的倒数。 G=1/R= A / l = K(l/A) 单位:西门子S,1S=1-1 电导率: =1 / =K(l/A) G 电阻率的倒数 单位:S m-1 两电极板为单位面积,距离为单位长度时溶液的电导。 电导池常数:K(l/A) =l / A (A电极面积; l 电极间距) 由标准KCl溶液的电导率(查表)确定电导率和电导池常数
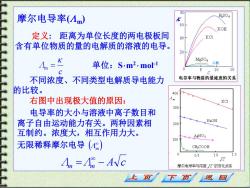
80 摩尔电导率(Am) H2S04 % KOH 定义:距离为单位长度的两电极板间 40 KCl 含有单位物质的量的电解质的溶液的电导。 MgSO 单位:Sm2.mo1 乙酸 10 15 不同浓度、不同类型电解质导电能力 电导率与物质的量浓度的关系 的比较。 400 右图中出现极大值的原因: 1m KCI 300 电导率的大小与溶液中离子数日和 离子自由运动能力有关。两种因素相 NaOH 200 互制约。浓度大,相互作用力大。 100 AgNO3 无限稀释摩尔电导() CHCOOH 05 1.0 An =A -Avc c 摩尔电导率与浓度c的变化关系 页 返 回
摩尔电导率( m) 定义: 距离为单位长度的两电极板间 含有单位物质的量的电解质的溶液的电导。 c Λ m = 单位:S m2 mol-1 不同浓度、不同类型电解质导电能力 的比较。 Λ Λ A c m = m − ( ) m 右图中出现极大值的原因: 电导率的大小与溶液中离子数目和 离子自由运动能力有关。两种因素相 互制约。浓度大,相互作用力大。 无限稀释摩尔电导

2.离子的电导与漂移速率 (1)离子的电迁移率 电解质 00 离子在外加电场中受溶 剂阻力和电场力,平衡时, KCI 0.014986 34.8×104 以恒定的速率运动。离子 LiCl 0.011503 的漂移速率U。 单位电场强度下离子的漂 KNO3 0.01450 34.9×104 移速率:离子的电迁移率uB LiNO: 0.01101 UB=UB/E KCI 0.014986 4.90×104 (2)离子独立运动定律 KNO3 0.01450 由右表数据可以得出 离子独立运动定律: LiCl 0.011503 4.90×104 4m=4,++△4m, LiNO; 0.01101 下页 返回
2.离子的电导与漂移速率 电解质 Λm KCl 0.014986 LiCl 0.011503 KNO3 0.01450 LiNO3 0.01101 KCl 0.014986 KNO3 0.01450 LiCl 0.011503 LiNO3 0.01101 Λm 34.810-4 34.9 10-4 4.90 10-4 4.90 10-4 (1) 离子的电迁移率 离子在外加电场中受溶 剂阻力和电场力,平衡时, 以恒定的速率运动。离子 的漂移速率B。 单位电场强度下离子的漂 移速率:离子的电迁移率uB uB= B /E (2) 离子独立运动定律 由右表数据可以得出 离子独立运动定律:
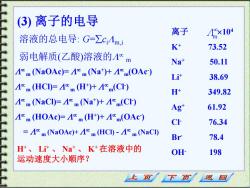
3)离子的电导 离子 溶液的总电导:G=∑cAm 4x104 K 73.52 弱电解质(乙酸)溶液的m Na+ 50.11 Am NaOAc)=A Na)+1(OAc-) L计 38.69 4m (HCI)=4%m(H+)+1%m(CI) H 349.82 Am (NaCl)=A%m (Na)+Am(CI) Ag" 61.92 m(H0Ac)片m(Ht)+m(0A) C 76.34 =A%m (NaOAc)+m(HCI)-A%m (NaCI) Br 78.4 H、L计、Na、K+在溶液中的 OH 198 运动速度大小顺序? 返 回
(3) 离子的电导 溶液的总电导: G=cim,i 弱电解质(乙酸)溶液的 m 离子 Λm 104 K+ 73.52 Na+ 50.11 Li+ 38.69 H+ 349.82 Ag+ 61.92 Cl- 76.34 Br- 78.4 OH- 198 H+ 、 Li+ 、 Na+ 、 K+ 在溶液中的 运动速度大小顺序? m (NaOAc)= m (Na+ )+ m(OAc- ) m (HCl)= m (H+ )+ m(Cl- ) m (NaCl)= m (Na+ )+ m(Cl- ) m (HOAc)= m (H+ )+ m(OAc- ) = m (NaOAc)+ m (HCl) - m (NaCl)

3.电解质溶液的电导与浓度的关系 Am =Am-A.c +o5, 8.20×105 =1 82.5 =15-(A1+B)vc D:介电常数 7:介质的黏度 T:绝对温度 上页下页返回
3. 电解质溶液的电导与浓度的关系 Λ AΛ B c c D T Λ D T Λ Λ Λ A c m m m m m m ( ) ( ) 82.5 ( ) 8.20 10 3/ 2 1/ 2 5 = − + + = − = − D:介电常数 :介质的黏度 T:绝对温度

松弛效应与Wien效应 (1)离子在溶液中以的形式存在和在电场中的运动过程 离子氛:中心离子被相反电荷的离子和溶剂化分子包围形 成球状。 运动过程:是离子氛不断生成和破坏的过程。 离子氛生成和消失的时间:离子氛松弛时间。 (2)不对称的离子氛对中心离子的运动起阻碍作用 松弛效应不对称效应),系数A (3)溶剂化分子与离子一起运动造成的阻碍作用:电泳效应, (4)高强度电场中电导增大的现象,Wien效应。为什么? (5) 高频交流电场,电导随频率变化的现象: 迪拜夫肯汉根效应 下页 返回
松弛效应与Wien效应 (1)离子在溶液中以的形式存在和在电场中的运动过程 离子氛:中心离子被相反电荷的离子和溶剂化分子包围形 成球状。 运动过程:是离子氛不断生成和破坏的过程。 离子氛生成和消失的时间:离子氛松弛时间。 (2)不对称的离子氛对中心离子的运动起阻碍作用 松弛效应(不对称效应),系数A (3)溶剂化分子与离子一起运动造成的阻碍作用:电泳效应, (4)高强度电场中电导增大的现象,Wien效应。为什么? (5)高频交流电场,电导随频率变化的现象: 迪拜-夫肯汉根效应

4.影响电导测量的因素 (1)温度的影响 温度升高,粘度降低,电导增大.每升高1度,约增加2% 4=4m25.(0.5+0.020) (2)溶剂的影响 25oC蒸馏水电导率:0.8~1.0μS·cm 进一步纯化后电导率:0.030.06uS·cm 采用石英容器, 方法:亚沸蒸馏,电渗析 下页返回
4.影响电导测量的因素 (1) 温度的影响 温度升高, 粘度降低,电导增大.每升高1度,约增加2% (0.5 0.02 ) ,2 5 c , Λ Λ o t m t m = + (2) 溶剂的影响 25 C 蒸馏水电导率:0.8~1.0 S·cm-1 进一步纯化后电导率: 0.03~0.06 S·cm-1 采用石英容器, 方法:亚沸蒸馏,电渗析
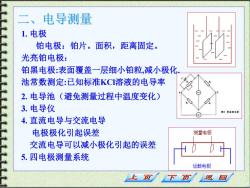
电导测量 1.电极 铂电极:铂片。面积,距离固定。 光亮铂电极: 铂黑电极:表面覆盖一层细小铂粒,减小极化 池常数测定:已知标准KCI溶液的电导率 2.电导池(避免测量过程中温度变化) 3.电导仪 图8塞粉通电然 4.直流电导与交流电导 电极极化引起误差 测量电极 交流电导可以减小极化引起的误差 5.四电极测量系统 运载电极 页 下页 返回
二、电导测量 1. 电极 铂电极:铂片。面积,距离固定。 光亮铂电极: 铂黑电极:表面覆盖一层细小铂粒,减小极化. 池常数测定:已知标准KCl溶液的电导率 2. 电导池(避免测量过程中温度变化) 3. 电导仪 4. 直流电导与交流电导 电极极化引起误差 交流电导可以减小极化引起的误差 5. 四电极测量系统
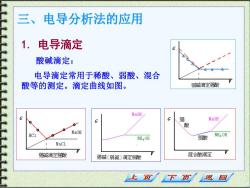
三、电导分析法的应用 1. 电导滴定 酸碱滴定: 电导滴定常用于稀酸、弱酸、混合 酸等的测定。滴定曲线如图。 弱减滴定酸 NaOH G G G 强 NaOH 酸 NaOH HC1 NH4OH NH4OH 弱酸 NaCl 鍼滴定蛮酸 强碱(弱碱)滴定弱酸 混合酸滴定 上页 下页 返回
三、电导分析法的应用 1. 电导滴定 酸碱滴定: 电导滴定常用于稀酸、弱酸、混合 酸等的测定。滴定曲线如图
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第五节 极谱与伏安分析法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第四节 电解与库仑分析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第三节 电位分析法及应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第二节 电极的构造和原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第一节 电化学分析法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第四节 滴定分析法应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第三节 滴定分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第二节 化学平衡.ppt
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第四章 酸碱滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十章 红外分光光度法简介.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十二章 气相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十一章 色谱法基本概念及经典液相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第六章 配位滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第八章 电化学分析法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第五章 沉淀滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第九章 紫外-可见分光光度法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第二章 误差和分析数据处理.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第三章 滴定分析法概论.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第七章 氧化还原滴定法.pptx
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第1章 绪论 Instrumental analysis(主讲:杨红兵).ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第一节 光度法基本原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 分析化学的作用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第三节 显色与测量条件的选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第四节 分光光度测量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第五节 有机物紫外光谱解析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第一节 原子吸收分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第二节 原子吸收分光光度仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第三节 干扰及其消除.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第四节 条件选择与定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第一节 色谱法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第二节 气相色谱仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分析化学的分类与进展.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第三节 色谱理论基础.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第六节 毛细管色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第七节 液相色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第八节 离子色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第九节 高效毛细管电泳.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第一节 概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第二节 沉淀分离法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第三节 其他.ppt
