厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验九、等电聚焦电泳

实验九 聚丙烯酰胺凝胶等电聚焦 电泳测定蛋白质的等电点
实验九 聚丙烯酰胺凝胶等电聚焦 电泳测定蛋白质的等电点

一、目的要求 1.学习和掌握圆盘电泳技术 2.学习和掌握等电聚焦电泳测定蛋白质的等 电点方法
一、目的要求 1.学习和掌握圆盘电泳技术 2.学习和掌握等电聚焦电泳测定蛋白质的等 电点方法

二、原理 聚丙烯酰胺等电聚焦电泳(Isoelectric Focusing-PAGE,简称IEF-PAGE):利用各种蛋白质 pI不同,以聚丙烯酰胺凝胶为电泳支持物,并在其 中加入两性电解质载体(carrier ampholytes),两 性电解质载体在电场作用下,按各自pI形成从阳极 到阴极逐渐增加的平滑和连续的pH梯度。在电场作 用下,蛋白质在此pH梯度凝胶中泳动,当迁移至pH 值等于pI处时,就不再泳动,而被浓缩成狭窄的区 带
二、原理 聚丙烯酰胺等电聚焦电泳(Isoelectric Focusing-PAGE,简称IEF-PAGE):利用各种蛋白质 pI不同,以聚丙烯酰胺凝胶为电泳支持物,并在其 中加入两性电解质载体(carrier ampholytes),两 性电解质载体在电场作用下,按各自pI形成从阳极 到阴极逐渐增加的平滑和连续的pH梯度。在电场作 用下,蛋白质在此pH梯度凝胶中泳动,当迁移至pH 值等于pI处时,就不再泳动,而被浓缩成狭窄的区 带

两性电解质载体(carrier ampholytes) (1)易溶于水,在pI处应有足够的缓冲能力,形成稳 定的pH梯度,不致被蛋白质或其它两性电解质改变 pH梯度。 (2)在pI处应有良好的电导及相同的电导系数,以保 持均匀的电场。 (3)分子量小,可通过透析或分子筛法除去,便于与 生物大分子分开。 (4)化学性能稳定,与被分离物不起化学反应,也无 变性作用,其化学组成不同于蛋白质
两性电解质载体(carrier ampholytes) (1)易溶于水,在pI处应有足够的缓冲能力,形成稳 定的pH梯度,不致被蛋白质或其它两性电解质改变 pH梯度。 (2)在pI处应有良好的电导及相同的电导系数,以保 持均匀的电场。 (3)分子量小,可通过透析或分子筛法除去,便于与 生物大分子分开。 (4)化学性能稳定,与被分离物不起化学反应,也无 变性作用,其化学组成不同于蛋白质
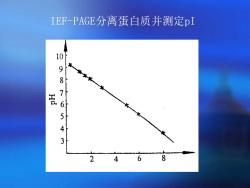
IEF-PAGE分离蛋白质并测定pI
IEF-PAGE分离蛋白质并测定pI

图3.6聚丙烯酰胺凝胶圆盘电泳示意图 (A为正面,B为剖面) (1)样品胶pH6.7 (2)浓缩胶pH6.7 (3)分离胶pH8.9 (4)电极缓冲液pH8.3
图3.6聚丙烯酰胺凝胶圆盘电泳示意图 (A为正面,B为剖面) (1)样品胶pH6.7 (2)浓缩胶pH6.7 (3)分离胶pH8.9 (4)电极缓冲液pH8.3

三、试剂与器材 试剂:两性电解质载体pH 3-10 、10%四甲基乙二胺 、 10%过硫酸铵 、5%H3PO4 、2%NaOH 、40%蔗糖 、 0.04%考马斯亮兰R250 、7%醋酸 器材:圆盘电泳槽 、稳压稳流电泳仪 、脱色摇床
三、试剂与器材 试剂:两性电解质载体pH 3-10 、10%四甲基乙二胺 、 10%过硫酸铵 、5%H3PO4 、2%NaOH 、40%蔗糖 、 0.04%考马斯亮兰R250 、7%醋酸 器材:圆盘电泳槽 、稳压稳流电泳仪 、脱色摇床

四、操作方法 1. 凝胶柱的制备 (1)玻璃管的一端插在橡皮帽中(与橡皮接触的部分凝胶不易 聚合,可在橡皮帽中先加一滴40%的蔗糖) (2)配胶 表 10mL 7.5%凝胶的配制 试 剂 名 称 体积(mL) 凝胶贮液 2.5 两性电解质载体 0.5 10%TEMED 0.1 蛋白质混合样品 0.1 蒸馏水 6.75 混匀后置真空干燥器中抽气10 min 10%过硫酸铵 0.05
四、操作方法 1. 凝胶柱的制备 (1)玻璃管的一端插在橡皮帽中(与橡皮接触的部分凝胶不易 聚合,可在橡皮帽中先加一滴40%的蔗糖) (2)配胶 表 10mL 7.5%凝胶的配制 试 剂 名 称 体积(mL) 凝胶贮液 2.5 两性电解质载体 0.5 10%TEMED 0.1 蛋白质混合样品 0.1 蒸馏水 6.75 混匀后置真空干燥器中抽气10 min 10%过硫酸铵 0.05

(3)将配好的凝胶溶液用细长头滴管加到预先准备好的玻管 中,至离上端1 cm处,再用注射器缓缓加水3-5 mm高。 (4)待凝胶聚合 2. 电泳 小心地拔出玻管,并用蒸馏水洗去蔗糖溶液,把管固定 到电泳槽上槽的洞中(安装时要保证凝胶管垂直且橡胶塞孔 密封不漏)在上槽中加入5%磷酸缓冲液,在下槽中装入2%氢 氧化钠溶液。避免管下有气泡。上槽接电泳仪的正极,下槽 接负极,打开电源,先调电压至100 V,待电压稳定后再升 到300 V,电泳2 h以上至电流降为0,将电压调至0,关闭电 源
(3)将配好的凝胶溶液用细长头滴管加到预先准备好的玻管 中,至离上端1 cm处,再用注射器缓缓加水3-5 mm高。 (4)待凝胶聚合 2. 电泳 小心地拔出玻管,并用蒸馏水洗去蔗糖溶液,把管固定 到电泳槽上槽的洞中(安装时要保证凝胶管垂直且橡胶塞孔 密封不漏)在上槽中加入5%磷酸缓冲液,在下槽中装入2%氢 氧化钠溶液。避免管下有气泡。上槽接电泳仪的正极,下槽 接负极,打开电源,先调电压至100 V,待电压稳定后再升 到300 V,电泳2 h以上至电流降为0,将电压调至0,关闭电 源

3.剥胶 电泳结束后,取下凝胶管,用蒸馏水充分洗净两端电极 液,在凝胶条的正极端插一铜丝为标记。用灌满水的注射器 长针头插入凝胶与玻管管壁之间,边压水边慢慢转动玻管, 推针前进,同时注入水,靠水流压力和润滑力将玻璃管内壁 与凝胶分开,凝胶条即可流出。 4 .固定染色 取其中一条凝胶条放在一块洁净的玻板上,用尺量出固 定前的凝胶条长度。放入染色液中同时进行固定染色1-2 h, 用蒸馏水漂洗数次后用脱色液脱色,直至蛋白质区带清晰, 量出蛋白带距正极端的距离
3.剥胶 电泳结束后,取下凝胶管,用蒸馏水充分洗净两端电极 液,在凝胶条的正极端插一铜丝为标记。用灌满水的注射器 长针头插入凝胶与玻管管壁之间,边压水边慢慢转动玻管, 推针前进,同时注入水,靠水流压力和润滑力将玻璃管内壁 与凝胶分开,凝胶条即可流出。 4 .固定染色 取其中一条凝胶条放在一块洁净的玻板上,用尺量出固 定前的凝胶条长度。放入染色液中同时进行固定染色1-2 h, 用蒸馏水漂洗数次后用脱色液脱色,直至蛋白质区带清晰, 量出蛋白带距正极端的距离
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验八、聚丙烯酰胺凝胶垂直板电泳.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验七、凝胶过滤层析.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验六、细胞色素C制备.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)酶模块总结.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验五、碱性磷酸酶米氏常数的测定.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)模块一 动物解剖及动物的形态结构观察技术.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十七、胶片的冲洗.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十六、显微摄影技术.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十二 DNA连接与转化.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十一 DNA酶切.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十 DNA 片段从凝胶中回收.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验九 质粒DNA的制备.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验四-4、pH对淀粉酶活性的影响.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)模块三、原核生物分子生物学实验.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)开放实验:植物RAPD分析.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验八 多聚酶链式反应(PCR).ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验七 DNA的纯化与鉴定.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验六 真核细胞基因组提取.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)模块二、真核生物分子生物学实验.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验五 转座子引起的插入突变.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十、酪蛋白的制备.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)实验十一、蛋白质含量的测定.ppt
- 厦门大学:《现代生物实验学》课程教学课件(PPT讲稿)动物学实验模块教案.ppt
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)糖实验技术模块教案.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.10_糖类的显示方法-PAS反应.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.11_免疫细胞化学染色观察肿瘤细胞蛋白的表达与分布.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.12_石蜡切片法(一)-取材、固定、洗涤、脱水.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.13_石蜡切片法(二)-透明、透蜡、包埋.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.14_石蜡切片法(三)—切片、贴片(附:冰冻切片法).doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.15_石蜡切片法(四)—染色、封藏.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.16_显微摄影技术.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.17_印相和扩大.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.1_细胞形态结构观察与普通光学显微镜的使用.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.2_叶绿素的分离与观察和细胞大小的测量.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.3_细胞的形态多样性及细胞计数.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.4_动物细胞线粒体的超活染色与油镜观察.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.5_植物细胞液泡系观察与生物显微绘图.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.6_活细胞观察与相差显微镜的使用.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.7_细胞荧光染色观察与荧光显微镜的使用.doc
- 厦门大学:《现代生物实验学》课程教学资源(教案讲义)2.8_细胞形态观察与暗视野显微镜的使用.doc
