《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-1 热力学第零定律和第一定律

§6-1热力学第零定律和第一定律 一、热力学第零定律 如果物体A和处于确定状态的物体B热接触而 处于热平衡,另有物体C和此物体B也热接触而处于 热平衡,那么,物体A和物体C热接触就必定也处于 热平衡。这个结论称为热力学第零定律。 二、热力学过程 热力学系统从一个平衡态过渡到另一个平衡 态所经过的变化历程就称为热力学过程。 准静态过程:在过程中每一时刻,系统都处于平 衡态,这是一种理想过程。 上美不家返可退此
上页 下页 返回 退出 一、热力学第零定律 如果物体A和处于确定状态的物体B 热接触而 处于热平衡,另有物体C和此物体B也热接触而处于 热平衡,那么,物体A和物体C热接触就必定也处于 热平衡。这个结论称为热力学第零定律。 二、 热力学过程 热力学系统从一个平衡态过渡到另一个平衡 态所经过的变化历程就称为热力学过程。 准静态过程:在过程中每一时刻,系统都处于平 衡态,这是一种理想过程。 §6-1 热力学第零定律和第一定律
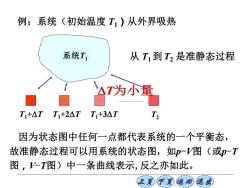
例:系统(初始温度T1)从外界吸热 系统T1 从T到T,是准静态过程 △T内小量 T+△T T1+2△TT1+3△T T 因为状态图中任何一点都代表系统的一个平衡态, 故准静态过程可以用系统的状态图,如p一V图(或p-T 图,-T图)中一条曲线表示,反之亦如此。 让美觉返司退
上页 下页 返回 退出 例:系统(初始温度 T1)从外界吸热 从 T1 到 T2 是准静态过程 因为状态图中任何一点都代表系统的一个平衡态, 故准静态过程可以用系统的状态图,如p-V图(或p-T 图,V-T图)中一条曲线表示,反之亦如此。 系统T1 T1+T T1+2T T1+3T T2 T为小量
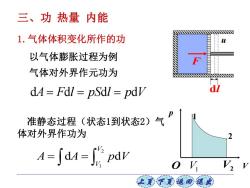
三、功热量内能 1.气体体积变化所作的功 以气体膨胀过程为例 气体对外界作元功为 dA=Fdl pSdl pdv 准静态过程(状态1到状态2)气 体对外界作功为 2 A=∫dM=6pdw o V 上美子意蕴可退
上页 下页 返回 退出 准静态过程(状态1到状态2)气 体对外界作功为 d d d d A F l pS l p V = = = 1.气体体积变化所作的功 2 1 d d V V A A p V = = u F dl 气体对外界作元功为 以气体膨胀过程为例 三、功 热量 内能 V p 1 2 O V1 V2

A=∫dA=JGpw dV>0,dA>0,系统对外作正功; dV<0,dA<0,系统对外作负功; dV=0,d4=0,系统不作功。 1-f"par 由积分意义可知,功的大小等于V图上过程曲 线()下的面积。功的数值不仅与初态和末态有关, 而且还依赖于所经历的中间状态,功与过程的路 径有关。 让美下觉返同速
上页 下页 返回 退出 d 0, d 0, V A 系统对外作正功; d 0, d 0, V A 系统对外作负功; d 0, d 0, V A = = 系统不作功。 2 1 d d V V A A p V = = 由积分意义可知,功的大小等于p-V 图上过程曲 线p(V)下的面积。功的数值不仅与初态和末态有关, 而且还依赖于所经历的中间状态,功与过程的路 径有关。 2 1 d V V A p V =

2.气体的内能 理想气体内能: E- LRT 内能是状态量,是状态参量T的单值函数。 实际气体内能: 所有分子热运动的动能和分子间势能的总和。 内能是状态参量T、的单值函数。 让意了京适可:退此
上页 下页 返回 退出 2.气体的内能 实际气体内能: 所有分子热运动的动能和分子间势能的总和。 理想气体内能: mol 2 m i E RT M = 内能是状态量,是状态参量T的单值函数。 内能是状态参量T、V的单值函数

系统内能改变的两种方式 a.作功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量 b.热量传递可以改变系统的内能 热量是过程量 使系统的状态改变,传热和作功是等效的。 作功是系统热能与外界其他形式能量转换的量度。 热量是系统与外界热能转换的量度。 让美觉返司退
上页 下页 返回 退出 系统内能改变的两种方式 作功是系统热能与外界其他形式能量转换的量度。 a. 作功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量 b. 热量传递可以改变系统的内能 热量是过程量 热量是系统与外界热能转换的量度。 使系统的状态改变,传热和作功是等效的

四、热力学第一定律 Q=(E2-E)+A=△E+A 上式就是热力学第一定律,是包含热量在内的能量 守恒定律。 2>0 系统从外界吸热; Q0 系统对外界作功; A≤0 外界对系统作功; ΛE>0 系统内能增加; △E<0 系统内能减少。 让意不意适回退收
上页 下页 返回 退出 Q = (E2 − E1 )+ A= E + A Q 0 系统从外界吸热; Q 0 系统向外界放热; A 0 系统对外界作功; A 0 外界对系统作功; E 0 系统内能增加; E 0 系统内能减少。 上式就是热力学第一定律,是包含热量在内的能量 守恒定律。 四、热力学第一定律

对无限小过程 do=dE+dA 对于准静态过程,如果系统对外作功是通过体 积的变化来实现的,则 Q=AE+ do dE+pdy 热力学第一定律另一表述: 制造第一类永动机(能对外不断自动作功而不需 要消耗任何燃料、也不需要提供其他能量的机器)是 不可能的。 让美下觉返司速此
上页 下页 返回 退出 d d d Q E A = + 对无限小过程 对于准静态过程,如果系统对外作功是通过体 积的变化来实现的,则 2 1 d V V Q E p V = + d d d Q E p V = + 热力学第一定律另一表述: 制造第一类永动机(能对外不断自动作功而不需 要消耗任何燃料、也不需要提供其他能量的机器)是 不可能的

选择进入下一节 §6-0教学基本要求 §6-1热力学第零定律和第一定律 §6-2热力学第一定律对于理想气体准静态过程的应用 §63循环过程卡诺循环 §6-4热力学第二定律 §6-5可逆过程与不可逆过程 卡诺定理 §6-6熵玻耳兹曼关系 §67熵增加原理热力学第二定律的统计意义 *§6-8耗散结构信息熵
上页 下页 返回 退出 选择进入下一节 §6-0 教学基本要求 §6-1 热力学第零定律和第一定律 §6-2 热力学第一定律对于理想气体准静态过程的应用 §6-3 循环过程 卡诺循环 §6-4 热力学第二定律 §6-5 可逆过程与不可逆过程 卡诺定理 §6-6 熵 玻耳兹曼关系 §6-7 熵增加原理 热力学第二定律的统计意义 *§6-8 耗散结构 信息熵
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-0 教学基本要求.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-9 真实气体、范德瓦尔斯方程.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-8 气体的输运现象.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-7 分子碰撞和平均自由程.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-6 麦克斯韦-玻耳兹曼能量分布律、重力场中粒子按高度的分布.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-5 麦克斯韦速率分布律.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-4 能量均分定理、理想气体的内能.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-3 理想气体的压强和温度公式.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-2 分子热运动和统计规律.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-1 热运动的描述、理想气体模型和物态方程.ppt
- 《普通物理学》课程教学资源(PPT课件)第五章 气体动理论 5-0 教学基本要求.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-5 广义相对论简介.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-4 狭义相对论动力学基础.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-3 狭义相对论的时空观.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-2 相对论速度变换.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-1 狭义相对论基本原理、洛伦兹变换.ppt
- 《普通物理学》课程教学资源(PPT课件)第四章 相对论基础 4-0 教学基本要求.ppt
- 《普通物理学》课程教学资源(PPT课件)第三章 刚体和流体的运动 3-7 牛顿力学的内在随机性、混沌.ppt
- 《普通物理学》课程教学资源(PPT课件)第三章 刚体和流体的运动 3-6 理想流体模型、定常流动、伯努利方程.ppt
- 《普通物理学》课程教学资源(PPT课件)第三章 刚体和流体的运动 3-5 进动.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-2 热力学第一定律对于理想气体准静态过程的应用.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-3 循环过程、卡诺循环.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-4 热力学第二定律.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-5 可逆过程与不可逆过程、卡诺定理.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-6 熵、玻耳兹曼关系.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-7 熵增加原理、热力学第二定律的统计意义.ppt
- 《普通物理学》课程教学资源(PPT课件)第六章 热力学基础 6-8 耗散结构、信息熵.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-0 教学基本要求.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-1 物质的电结构、库仑定律.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-10 静电场的能量.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-2 静电场、电场强度.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-3 静电场的高斯定理.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-4 静电场的环路定律、电势.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-5 电场强度与电势梯度的关系.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-6 静电场中的导体.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-7 电容器的电容.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-8 静电场中的电介质.ppt
- 《普通物理学》课程教学资源(PPT课件)第七章 静止电荷的电场 7-9 有电介质时的高斯定理、电位移.ppt
- 《普通物理学》课程教学资源(PPT课件)第八章 恒定电流的磁场 8-0 教学基本要求.ppt
- 《普通物理学》课程教学资源(PPT课件)第八章 恒定电流的磁场 8-1 恒定电流.ppt
