《植物营养学》课程教学资源(实验指导)实验五 根系活力的测定

实验五根系活力的测定一、意义根系具有吸收养分、水分、支持植株和合成有机物的能力。它是作物赖以生存的基础。根系的生长和地上部的生长是密切相关的和互为依存的,根系生长好,就能保证地上部各器官也相应地繁茂苗壮。因此,研究根系的活力对于搞清作物的根部营养,提高作物根系吸收养分、水分能力等具有重要的实际意义。在科学研究中常把根系的呼吸强度,阳离子代换量(CEC),对有色物质的吸附量和酶的活性等,作为作物根系活力的指标。二、测定原理及方法(一)根系表面积的测定I.甲烯兰吸附法(1)原理:根据植物根系吸收矿质养分的理论,根系对溶质的最初吸收具有吸附的特性。假定吸收时在根系表面均匀地覆盖了一层被吸附物质的单分子层,因此能根据根系对某物质的吸附量来测定根的吸收面积。常用甲烯兰(C16H1sHsSCI)作为被吸附物质,已知1mg甲烯兰胶单分子层时占用1。1平方米的面积。故可由它被吸附前后溶液的浓度变化用比色法准确地测定根系总吸收面积。当根系在甲烯兰溶液中已达饱合并仍留在溶液中时,根系的活跃部分能把已吸附在根表的甲烯兰吸收到细胞中去,并继续吸附甲烯兰。因此:又可以从后一吸附量中求出根系的活跃吸收面积。(2)方法:①取出完整根系《注意保留根尖和细根),小心抛清洗掉根表吸持的砂粒和土粒,洗净后用吸水纸除去根表水分。②将根放入有刻度的容器中《试管或置筒),缓缓加水至某一刻度,取出根系待水从根上流入容器中,准确用滴定管加水至刻度处,加入水量即为根系的总体积,并记载。③根据根系的总体积,吸取0。0002N的甲烯兰溶液(每升溶液中含甲烯兰84mg),吸取量约为根系总体积的十倍,分别放入三个有1、2、3编号的小烧杯中,淮确记下每杯所取溶液的毫升数。取量好体积的根系,用吸水纸小心吸去根表水分,切忌损伤根系,依次浸入盛有甲烯兰溶液的小烧杯中,在每杯中浸泡的时间为1。5分钟。注意每次取出时都要使甲烯兰溶液从根表流回到原烧杯中从三个烧杯中各取1mL溶液放入刻度试管中,再稀释至10倍,用光电比色计在660nm波长处测定其光密度,并根据标准曲线,求出每杯浸过根系后溶液中剩下的甲烯兰毫克数。(3)结果计算:①总吸收面积(m2)=[(C-C1)×V1+(C2-C2")×V2]×1.②活跃吸收面积(m2)=[(C3-C3")×V3X1.1③活跃吸收面积(%)一活跃吸收面积(crn3)/根的体积(cm3)(注):Cl、C2、C3一1、2、3号烧杯中加入甲烯兰溶液的浓度《mg/ml)CI、C21、C31一1、2、3号烧杯中浸根后甲烯兰溶液的浓度《mg/ml)Vl、V2、V3-1、2、3号烧杯中加入甲烯兰溶液的量(mL)。《4)仪器试剂及标准溶液的配制:①刻度试管或量筒。②50mL小烧杯:3个光电比色计:一台④0。0002N甲烯兰溶液:精确称取0。0640g甲烯兰,放入烧杯中加水溶解,并转入1000ml容量瓶中,加水定容。③甲烯兰标准溶液:吸取0。0002N的甲烯兰溶液15。6ml,放入I00ml容量瓶中,加水至刻度摇匀。此液每毫升含甲烯兰0。010mg,取刻度试管7支,编号,依次吸取该溶液。1。0,2。0,4。0,6。0,8。0,10。ml,分别加水至10ml,依次相当于每毫升含甲烯兰0,0.000l,0.002,0.004,0.006,0.0008
实验五 根系活力的测定 一、意义 根系具有吸收养分、水分、支持植株和合成有机物的能力。它是作物赖以生存的基础。根系的生长 和地上部的生长是密切相关的和互为依存的,根系生长好,就能保证地上部各器官也相应地繁茂茁壮。 因此,砑究根系的活力对于搞清作物的根部营养,提高作物根系吸收养分、水分能力等具有重要的实际 意义。在科学研究中常把根系的呼吸强度,阳离子代换量(CEC),对有色物质的吸附量和酶的活性等, 作为作物根系活力的指标。 二、测定原理及方法 (一)根系表面积的测定 I.甲烯兰吸附法 (1)原理:根据植物根系吸收矿质养分的理论,根系对溶质的最初吸收具有吸附的特性。假定吸收时 在根系表面均匀地覆盖了一层被吸附物质的单分子层,因此能根据根系对某物质的吸附量来测定根的吸 收面积。常用甲烯兰(C16H18H3SCI)作为被吸附物质,已知 1mg 甲烯兰胶单分子层时占用 l。1 平方米的 面积。故可由它被吸附前后溶液的浓度变化用比色法准确地测定根系总吸收面积。 当根系在甲烯兰溶液中已达饱合并仍留在溶液中时,根系的活跃部分能把已吸附在根表的甲烯兰吸 收到细胞中去,并继续吸附甲烯兰。因此;又可以从后一吸附量中求出根系的活跃吸收面积。 〈2〉方法: ①取出完整根系〈注意保留根尖和细根〉,小心抛清洗掉根表吸持的砂粒和土粒,洗诤后用吸水纸 除去根表水分。 ②将根放入有刻度的容器中〈试管或置筒〉,缓缓加水至某一刻度,取出根系待水从根上流入容器 中,准确用滴定管加水至刻度处,加入水量即为根系的总体积,并记载。 ③根据根系的总体积,吸取 0。0002 N 的甲烯兰溶液(每升溶液中含甲烯兰 84 mg),吸取量约为根 系总体积的十倍,分别放入三个有 1、2、3 编号的小烧杯中,淮确记下每杯所取溶液的毫升数。 ④取量好体积的根系,用吸水纸小心吸去根表水分,切忌损伤根系,依次浸入盛有甲烯兰溶液的小 烧杯中,在每杯中浸泡的时间为 l。5 分钟。注意每次取出时都要使甲烯兰溶液从根表流回到原烧杯中。 ⑤从三个烧杯中各取 1mL 溶液放入刻度试管中,再稀释至 l0 倍,用光电比色计在 660nm 波长处测 定其光密度,并根据标准曲线,求出每杯浸过根系后溶液中剩下的甲烯兰毫克数。 (3)结果计算: ①总吸收面积(m2)= [(Cl-C11 )×V1+(C2-C2l)×Ⅴ2] ×1.1 ②活跃吸收面积(m2)=[(C3- C31)× V3 ×1.1 ③活跃吸收面积 (%)=活跃吸收面积(crn3)/根的体积{cm3} (注): Cl、C2、C3 一 1、2、3 号烧杯中加入甲烯兰溶液的浓度〈mg/ml〉. Cl1、C21、C31 一 1、2、3 号烧杯中浸根后甲烯兰溶液的浓度〈mg/ml〉 Vl、V2、V3-1、2、3 号烧杯中加入甲烯兰溶液的量{mL)。 〈4〉仪器试剂及标准溶液的配制: ①刻度试管或量筒。 ②5 0 mL 小烧杯:3 个 ③光电比色计:一台 ④0。0002N 甲烯兰溶液:精确称取 0。0640g 甲烯兰,放入烧杯中加水溶解,并转入 1000ml 容量瓶中, 加水定容。 ⑤甲烯兰标准溶液:吸取 0。0002 N 的甲烯兰溶液 15。6mI,放入 I00ml 容量瓶中,加水至刻度摇匀。 此液每毫升含甲烯兰 0。010mg,取刻度试管 7 支,编号,依次吸取该溶液。1。0,2。0 , 4。0,6。0, 8。θ,10。ml,分别加水至 l0mI,依次相当于每毫升含甲烯兰 0,0.000l,0.002,0.004,0.006, 0.0008

0.010mg,依同法比色2。硝酸钙重量法:《1)原理:当干燥的植物根系浸入一种溶液中,然后捞出淋干表面的溶液,那么就会有一部分溶液被吸附在根系表面,溶液的重量就会减少。硝酸钙是经过研究后筛选出的最为理想的物质,因为它是中等分子(分子量64。1)且极易溶解于水,当硝酸钙和水以6:1的比例配制成溶液时,很易吸附,在根系表面,这样可以通过重量差减法求出被根系吸附的量,以此表示根系的表面积《2)方法步骤:①将植物根系冲洗干净,然后风干备用。②将6份的Ca(NO3)2加入1份R的水中,轻微的加热使其溶解,配制成Ca(NO3)2:H2O为6:I的溶液备用。③根据根系的大小在烧杯中取一定量的上述溶液,要充分保证根系全部浸入,放在天平或台秤上,记录其重量《Go)。将风干的根系伸入溶液10秒钟,然后取出根系在烧杯上方停留80秒钟,使表面的多余溶液淋进烧杯,记录其重量(G1),两次重量差△G=GO-GI就表示被根系吸附的量,即根系表面积的大小。(3)仪器和试剂①天平或台秤:一架。②镊子:一把③烧杯①玻棒Ca(NO3)溶液。《二)根系活力的测定l。-莽胺法(1)原理:根对α-奈胺的氧化力与其呼吸强度有着密切关系,根据研究认为根表对α-萘胺的氧化作用是在过氧化物酶的催化下进行的,使部分根表染成红色,其反应如下:NH2NH2FOH73(α一萘胺)(2一羟基一1一萘胺)故可根据α一茶胺溶液与根系接触一定时间后,测定溶液中未被氧化的α·萘胺含量,确定根的活力。溶液中未被氧化的α-萘胺在酸性环境中与对氨基苯磺酸和亚硝酸盐作用生成了红色的偶氮染料,可用比色法测定α-萘胺含量。反应如下:
0.010 mg,依同法比色. 2。硝酸钙重量法: 〈1〉原理:当干燥的植物根系浸入一种溶液中,然后捞出淋干表面的溶液,那么就会有一部分溶液被 吸附在根系表面,溶液的重量就会减少。硝酸钙是经过研究后筛选出的最为理想的物质,因为它是中等 分子〈分子量 64。1〉且极易溶解于水,当硝酸钙和水以 6:1 的比例配制成溶液时,很易吸附,在根系 表面,这样可以通过重量差减法求出被根系吸附的量,以此表示根系的表面积 o 〈2〉方法步骤: ①将植物根系冲洗干净,然后风干备用。 ②将 6 份的 Ca〈NO3〉2 加入 1 份 R 的水中,轻微的加热使其溶解,配制成 Ca(NO3)2:H2O 为 6: Ⅰ的溶液备用。 ③根据根系的大小在烧杯中取一定量的上述溶液,要充分保证根系全部浸入,放在天平或台秤上,记 录其重量〈G0〉。 ④将风干的根系伸入溶液 l0 秒钟,然后取出根系在烧杯上方停留 80 秒钟,使表面的多余溶液淋进烧 杯,记录其重量(G1),两次重量差ΔG=G0- Gl 就表示被根系吸附的量,即根系表面积的大小。 〈3〉仪器和试剂 ①天平或台秤:一架。 ②镊子:一把 ⑧烧杯 ①玻棒 ⑤Ca(NO3)溶液。 〈二〉根系活力的测定 l。α- 莽胺法 (1)原理:根对α- 萘胺的氧化力与其呼吸强度有着密切关系,根据研究认为根表对α- 萘胺的氧 化作用是在过氧化物酶的催化下进行的,使部分根表染成红色,其反应如下: 故可根据α一荼胺溶液与根系接触一定时间后,测定溶液中未被氧化的α- 萘胺含量,确定根的活力。 溶液中未被氧化的α- 萘胺在酸性环境中与对氨基苯磺酸和亚硝酸盐作用生成了红色的偶氮染料,可 用比色法测定α- 萘胺含量。反应如下:
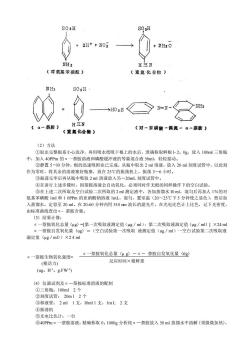
SO3HSOsH2H++NO2+2Hz0NH2H三N(对氨基苯磺酸)(重氮化合物)NH2SOsHNH2>HO3H三N(α一萘胺)(对一苯磺酸一偶氮一α一胺)(重氨化合物)(2)方法①取出完整根系小心洗净,再用吸水纸吸干根上的水后,准确称取鲜根1-2。0g,放入100ml三角瓶中,加入40PPm的α一萘胺溶液和磷酸缓冲液的等量混合液50ml,轻轻摇动。②静置5一10分钟,根的迅速吸附业已完成,从瓶中取出2ml溶液,放入20ml刻度试管中,以此刻作为零时,将其余的溶液塞好瓶塞,放在25℃的振荡机上,振荡3一6小时。③振荡完毕后再从瓶中吸取2ml溶液放入另一20mL刻度试管中。④在讲行上述步骤时,因萘胺溶液会自动氧化,必须同时作无根的同样操作下的空白试验。③在上述二次所取及空白试验二次所取的2ml测定液中,各加蒸馏水10ml,混匀后再加人1%的对氨基苯磺酸1ml和10PPm的亚硝酸钠溶液1mL,混匀,置室温(20~25℃下5分钟使之显色),然后加入蒸馏水,定容至20ml。在20-60分钟内用510nm波长的滤光片,在光电比色计上比色,记下光密度,由标准曲线查出α萘胺含量。《3)结果计算:a一胺氧化总量《ug)=[第一次吸取液测定值(ug/ml)-第二次吸取液烟定值《ug/ml1X24mlα一萘胺自发氧化量《ug)=(空白试验第一次吸取液测定值(ug/ml)一空白试验第二次吸取液溺定值《μg/ml))×24mlα一萘胺氧化总量ug)一α一胺自发氧化量《tlg)a一萘胺生物氧化强度=反应时间×根鲜重(根活力)(ug。 Hl。 g.Fw-l)《4)仪器试剂及α一萘胺标准溶液的配制①三角瓶:100ml2个②刻度试管:20ml2个③移液管:2ml1支,I0ml1支,1rnL2支①振荡机③光电比色计:一台③40PPmα一萘胺溶液:精确称取0。1000g分析纯a一萘胺放入50ml蒸馏水中溶解《须微微加热)
(2)方法 ①取出完整根系小心洗净,再用吸水纸吸干根上的水后,淮确称取鲜根 l- 2。0g,放入 100ml 三角瓶 中,加入 40PPm 的α一萘胺溶液和磷酸缓冲液的等量混合液 50ml,轻轻摇动。 ②静置 5-l0 分钟,根的迅速吸附业已完成,从瓶中取出 2 ml 溶液,放入 20 ml 刻度试管中,以此刻 作为零时,将其余的溶液塞好瓶塞,放在 25℃的振荡机上,振荡 3-6 小时。 ③振荡完毕后再从瓶中吸取 2 ml 溶液放入另-20mL 刻度试管中。 ④在讲行上述步骤时,因萘胺溶液会自动氧化,必须同时作无根的同样操作下的空白试验。 ⑤在上述二次所取及空白试验二次所取的 2 ml 测定液中,各加蒸馏水 I0 ml,混匀后再加人 1%的对 氨基苯磺酸 1ml 和 1 0PPm 的亚硝酸钠溶液 1mL,混匀,置室温(20~25℃下 5 分钟使之显色),然后加 入蒸馏水,定容至 20 ml。在 20-60 分钟内用 510 nm 波长的滤光片,在光电比色计上比色,记下光密度, 由标准曲线查出α- 萘胺含量。 〈3〉结果计算: α一萘胺氧化总量〈µg〉=[第一次吸取液测定值(µg/ml)- 第二次吸取液洇定值〈µg/ml〉] ×24 ml α一萘胺自发氧化量〈ug〉=(空白试验第一次吸取 液测定值(ug/ml)一空白试验第二次吸取液 溺定值〈µg/ml〉)×2 4 ml α一萘胺生物氧化强度= 〈4〉仪器试剂及α—萘胺标准溶液的配制 ①三角瓶:100ml 2 个 ②刻度试管: 20m l 2 个 ③移液管: 2 ml 1 支,I0ml 1 支,1rn L 2 支 ④振荡机 ⑤光电比色计:一台 ⑥40PPmα一萘胺溶液:精确称取 0。1000g 分析纯α—萘胺放入 50 ml 蒸馏水中溶解〈须微微加热〉, α一萘胺氧化总量〈µg〉-α- 蒡胺自发氧化量〈tlg〉 反应时间×根鲜重 (根活力) (ug。H-1。g.FW-1 )

冷却后定容至100ml即为1000PPm,保存于棕色瓶中,置低温黑暗处保存,用前稀释25倍,即为40PPm溶液。1%对氨基苯磺酸溶液:称取1g对氨基苯磺酸溶于100mL3o%的乙酸中。③100PPm亚硝蔽钠溶液:称0。1g亚硝酸钠溶于1000mL蒸馏水中。磷酸缓冲液《PH=7),A液称取纯Na2HPO4·2H2O11·876g,溶于1000mL蒸馏水中,B液称取纯KH2PO49·078g溶于1000ml蒸馏水中,A。B两种溶液以6:4的比例混合。α一萘胺标准溶液的配制:用40PPm的α一萘胺溶液,配制好40,30,20,15,5PPm的标淮溶液。另取20ml刻度试管6支,编号,I一5管各加入不同浓度的a萘胺标准溶液lmL,磷酸缓冲液lml,在第6支试管中,加蒸馏水ml,磷酸缓冲液1ml,作为参比管。然后于每支试管中加入I0ml蒸馏水,1%对氨基苯磺酸Iml和平共处00PPm的亚硝酸钠溶液1mL,混匀.置室温下5分钟使之显色,然后加蒜馏水定容至20ml,摇匀,在20一60分钟内用510nm波长的滤光片,在光电比色计土比色,以参比管光密度为零,读取各管的光密度9将结果绘制标准曲线。2。氯化三苯基四氮唑《TTC)法《I)原理:氯化萘基唑《TTC)是标准氧化还原电位为80毫伏的氧化还原物质,溶于水中为无色溶液,但还原后生成不溶于水的三苯基甲。后应如下:HN--2H+2e0+.HC1N-N-27NN三苯基甲腊(红色)TTC(无色)生成的甲呈稳定的红色,不会被空气中的氧自动氧化。所以被广泛用作酶试验的受氢体。植物根引起的TTC还原,可因加入琥珀酸、延胡索酸、苹果酸得到加强,而被内二酸、碘乙酸所严重抑制,所以,它能够测定琥珀酸脱氢酶的活性。由该酶活性表示根系活力。《2)方法步骤:①TTC标准曲线的制作:吸取0。2ml0。5%的TTC标准液放入10ml量瓶,加少许Na2S2O4粉末,摇匀后即产生红色甲,再加乙酸乙酯10ml,摇匀。然后分别取此液0。25,0。50,1。00,1。50,2。00ml,置10nl量瓶中,以乙酸乙酯定容至刻度,即得到TTC0。025,0。05;0。10,0。15,0。20mg的标准比色系列,以空白作参比,在485nm,光径1cm下测定光密度,绘制标准曲线。②称取样品0。5g,放入称量瓶,加入0。4%TTC溶液和0。1IM磷酸缓冲液的等量混合液10ml,把根充分浸在溶液中,在37℃下保温1小时,然后加入1M硫酸2ml终止反应。③把根取出,用想滤纸吸干水分,投入研钵,加少量石英砂和乙酸乙酯研碎,以提取甲,,将红色乙酸乙酯提取液移入10ml量瓶中,并用少jg乙酸乙酯洗残渣至白色,最后用乙酸乙酯定容至10ml,以空白试验(先加入硫酸再加入根样品,其它手续同上)作对照,在72一1型分光光度计上测定光密度(波长485nm,光径1cm),查标准曲线,求出TTC还原量结果计算:TTC还原量(克)TTC严强度=根量(g)×时间(小时)
冷却后定容至 100 ml 即为 l000PPm,保存于棕色瓶中,置低温黑暗处保存,用前稀释 25 倍,即为 40PPm 溶液。 ⑦ l%对氨基苯磺酸溶液:称取 lg 对氨基苯磺酸溶于 10 0mL3 o%的乙酸中。 ⑧10 0 PPm 亚硝蔽钠溶液:称 0。1g 亚硝酸钠溶于 l000mL 蒸馏水中 。 ⑨磷酸缓冲液〈PH=7〉,A 液称取纯 Na2 HPO4·2H2O 11·876g,溶于 l000mL 蒸馏水中,B 液称取 纯 KH2PO49·078g 溶于 l00 0 ml 蒸馏水中,A。B 两种溶液以 6:4 的比例混合。 ⑩α一萘胺标准溶液的配制: 用 40PPm 的α一萘胺溶液,配制好 40,30,20,15,5 PPm 的标淮溶液。另取 20ml 刻度试管 6 支, 编号,I-5 管各加入不同浓度的α萘胺标准溶液 lmL,磷酸缓冲液 lml,在第 6 支试管中,加蒸馏水 lml, 磷酸缓冲液 1ml,作为参比管。然后于每支试管中加入 I0 ml 蒸馏水,1%对氨基苯磺酸 Iml 和平共处 00PPm 的亚硝酸钠溶液 1mL ,混匀.置室温下 5 分钟使之显色,然后加蒜馏水定容至 20ml,摇匀,在 20-60 分钟内 用 510 nm 波长的滤光片,在光电比色计土比色,以参比管光密度为零,读取各管的光密度 9 将结果绘制 标准曲线。 2。氯化三苯基四氮唑〈TTC〉法 〈I〉原理:氯化萘基唑〈TTC〉是标准氧化还原电位为 80 毫伏的氧化还原物质,溶于水中为无色溶 液,但还原后生成不溶于水的三苯基甲。后应如下: 生成的甲 呈稳定的红色,不会被空气中的氧自动氧化。所以被广泛用作酶试验的受氢体。植物根引起的 TTC 还原,可因加入琥珀酸、延胡索酸、苹果酸得到加强,而被丙二酸、碘乙酸所严重抑制,所以,它 能够测定琥珀酸脱氢酶的活性。由该酶活性表示根系活力。 〈2〉方法步骤: ①TTC 标淮曲线的制作: 吸取 0。2ml 0。5%的 TTC 标淮液放入 10ml 量瓶,加少许 Na2S2O4 粉末,摇匀后即产生红色甲,再 加乙酸乙酯 10ml,摇匀。然后分别取此液 0。25,0。50,l。00,1。50,2。00ml,置 I0nl 量瓶中,以 乙酸乙酯定容至刻度,即得到 TTC 0。025,0。05;0。10,0。15,0。20m g 的标准比色系列,以空白 作参比,在 485nm,光径 I cm 下测定光密度,绘制标准曲线 。 ②称取样品 0。5g,放入称量瓶,加入 0。4%TTC 溶液和 0。1IM 磷酸缓冲液的等量混合液 l0ml, 把根充分浸在溶液中,在 37℃下保温 1 小时,然后加入 1M 硫酸 2ml 终止反应。 ③把根取出,用想滤纸吸干水分,投入研钵,加少量石英砂和乙酸乙酯研碎,以提取甲,将红色乙 酸乙酯提取液移入 l0ml 量瓶中, 并用少 jg 乙酸乙酯洗残渣至白色,最后用乙酸乙酯定容至 10ml,以空白 试验(先加入硫酸再加入根样品,其它手续同上)作对照,在 72-1 型分光光度计上测定光密度(波长 485nm, 光径 l cm),查标准曲线,求出 TTC 还原量. ④结果计算: TTC 严强度= TTC 还原量(克) 根量(g)×时间(小时)

(3)仪器及试剂:①72-1型分光光度计。②分析天平(托盘天平】③4cm漏斗:1个④研钵:一套③量筒:10ml1个③刻度移液管:0。5mll支,5mL2支,2ml3支。容差瓶:10ml高型称量瓶(30×80mm):2个。乙酸乙酯(分析纯)连二亚硫酸钠(Na2S204)(保控粉)分析纯。(11)1%TTC溶液:准确称取TTC1。000克,溶于99ml水中,用时稀释至需要刻度。(12)0.IM,H7。5磷酸缓冲液。(13)IM硫酸:用置筒取比重为l。84的浓硫酸55。6mL,边搅拌边加入到盛有500ml蒸馏水的烧杯中,冷却后稀释至1000ml(4)注意事项:①每次测定的保温时间和温度要一致,否则各样品结果无可比性。②乙酸乙酯要分析纯,否则影响显色
(3)仪器及试剂: ①72-I 型分光光度计。 ②分析天平{托盘天平} ③4cm 漏斗:l 个 ④研钵:一套 ⑤量筒: 10ml 1 个 ⑥刻度移液管:0。5ml l 支,5mL 2 支,2ml 3 支。 ⑦容羞瓶:l0ml ⑧高型称量瓶(30×8 0 mm):2 个。 ⑨乙酸乙酯(分析纯) ⑩连二亚硫酸钠(Na2S2O4)(保控粉)分析纯。 (11)l%TTC 溶液:准确称取 T TC1。000 克,溶于 99ml 水中,用时稀释至需要刻度。 (12)0.I M,H7。5 磷酸缓冲液。 (13)lM 硫酸:用置筒取比重为 l。84 的浓硫酸 55。6 mL,边搅拌边加入到盛有 500ml 蒸馏水的烧 杯中,冷却后稀释至 I000ml. (4)注意事项: ①每次测定的保温时间和温度要一致,否则各样品结果无可比性。 ②乙酸乙酯要分析纯,否则影响显色
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《植物营养学》课程教学资源(PPT课件)第二章 大量元素营养功能 第一节 植物的营养成分 第二节 碳、氢、氧.ppt
- 《植物营养学》课程教学大纲 Plant Nutrition.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第十一章 花卉田间识别与观察.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第九章 蔬菜作物田间识别.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第八章 大田作物田间识别.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第十二章 作物实验.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第十章 果树种类与枝芽特性观察.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第七章 作物器官分化发育与形态特征观察.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第六章 作物植株性状和经济性状考察.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第三章 播种、育苗移栽和嫁接技术.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第二章 田间播前准备技术.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第四章 作物各生育阶段的田间管理技术.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第五章 作物田间测产技术.pdf
- 《植物田间技术实验》课程教学课件(讲稿)第一章 课程简介(中国农业大学:郭玉海).pdf
- 《植物田间技术实验》课程教学指导书.pdf
- 《植物田间技术实验》课程教案(作物田间技术试验).pdf
- 《机械制图与计算机绘图》课程教学资源(实验指导)实验三 绘制组合体三视图.pdf
- 《机械制图与计算机绘图》课程教学资源(实验指导)实验二 AutoCAD绘制平面图形.pdf
- 《机械制图与计算机绘图》课程教学资源(实验指导)实验一 初始AutoCAD.pdf
- 《土壤学》课程教学课件(PPT讲稿)第十四章 土壤退化与土壤质量.ppt
- 《植物营养学》课程教学资源(实验指导)实验六 植物根际化学过程.doc
- 《植物营养学》课程教学资源(实验指导)实验七 常用氮、磷、钾肥料主要性质的检定.doc
- 《植物营养学》课程教学资源(实验指导)实验八 主要化肥的定性鉴定.doc
- 《植物营养学》课程教学资源(实验指导)实验九 土壤中的养分的淋洗及其环境效应检测.doc
- 《植物营养学》课程教学资源(实验指导)实验十 植物-微生物相互作用原理及其生态学和农学意义.doc
- 《植物营养学》课程教学资源(实验指导)实验一 作物营养失调症状幻灯片观察.doc
- 《植物营养学》课程教学资源(实验指导)试验二 氮磷钾肥料对同作物生长的效应.doc
- 《植物营养学》课程教学资源(实验指导)实验三 植物营养液培养技术与植物缺素观察.doc
- 《植物营养学》课程教学资源(实验指导)实验四 作物根的阳离子交换量的测定.doc
- 《植物营养学》课程教学资源(PPT课件)第二章 营养元素的生理功能 2.3 钾 K.ppt
- 《植物营养学》课程教学资源(PPT课件)第二章 营养元素的生理功能 2.2 磷 P.ppt
- 《植物营养学》课程教学资源(PPT课件)第三章 中量营养元素 3.1 钙 Ca.ppt
- 《植物营养学》课程教学资源(PPT课件)第三章 中量营养元素 3.2 镁 Mg.ppt
- 《植物营养学》课程教学资源(PPT课件)第三章 中量营养元素 3.3 硫 S.ppt
- 《植物营养学》课程教学资源(PPT课件)第一章 绪论.ppt
- 《植物营养学》课程教学资源(PPT课件)第四章 微量营养元素 4.1 铁 Fe.ppt
- 《植物营养学》课程教学资源(PPT课件)第二章 营养元素的生理功能 2.1 氮 N.ppt
- 《植物营养学》课程教学资源(PPT课件)第四章 微量营养元素 4.3 锰 Mn.ppt
- 《植物营养学》课程教学资源(PPT课件)第四章 微量营养元素 4.5 锌 Zn.ppt
- 《植物营养学》课程教学资源(PPT课件)第四章 微量营养元素 4.7 氯 Cl.ppt
