石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第2章 原子发射光谱法 Atomic Emission Spectrometry , AES

第2章 原子发射光谱法 Atomic Emission Spectrometry,AES
第2章 原子发射光谱法 Atomic Emission Spectrometry , AES

原子光谱和分子光谱 学光谱可分为原子光谱、分子光谱。 原子光谱产生于原子外层电子能级的跃迁。它包 括原子核外电子吸收光子能量形成的光谱称原子 吸收光谱(AAS)。原子核外电子发射光子形成 的光谱称原子发射光谱(AES)、以及原子荧光 光谱(AFS)、X射线荧光光谱法(XFS)
原子光谱和分子光谱 光学光谱可分为原子光谱、分子光谱。 原子光谱产生于原子外层电子能级的跃迁。它包 括原子核外电子吸收光子能量形成的光谱称原子 吸收光谱(AAS)。原子核外电子发射光子形成 的光谱称原子发射光谱(AES)、以及原子荧光 光谱(AFS)、 X射线荧光光谱法(XFS)

原子光谱和分子光谱 原子光谱反映原子或离子的性质而与原 子或离子来源的分子状态无关。确定试 样物质的元素组成和含量。不能给出物 质分子结构的信息。 ■原子光谱为线状光谱
◼ 原子光谱反映原子或离子的性质而与原 子或离子来源的分子状态无关。确定试 样物质的元素组成和含量。不能给出物 质分子结构的信息。 ◼ 原子光谱为线状光谱 原子光谱和分子光谱

原子光谱和分子光谱 原子光谱 核外电子运动状态 原子核外电子的运动状态可以用主量子数、角量子数、磁量 子数、自旋量子数来描述。 1、n决定电子的能量和电子离核的远近。 取值:K、L、M、N。 2、L决定角动量的大小及电子轨道的形状。 符号:S,p,d,f L=0,1,2,3.,(n-1) 3、磁量子数决定磁场中电子轨道在空间的伸展的方向。 4、自旋量子数s决定电子自旋的方向,顺磁场和逆磁场 ms=1/2,-1/2
原子光谱和分子光谱 一、原子光谱 (一)核外电子运动状态 原子核外电子的运动状态可以用主量子数、角量子数、磁量 子数、自旋量子数来描述。 1、n决定电子的能量和电子离核的远近。 取值:K、L、M、N。 2、L决定角动量的大小及电子轨道的形状。 符号: s, p, d, f L=0,1,2,3.,(n-1) 3、磁量子数m决定磁场中电子轨道在空间的伸展的方向。 4、自旋量子数ms决定电子自旋的方向,顺磁场和逆磁场 ms=1/2,-1/2

原子光谱和分子光谱 核外电子的运动状态依据泡利不相容原理、能量 最低原理和洪德规则,对核外电子进行排布。 例如:钠原子核外电子构型: 1s22s22p63s1 价电子构型:3s1 (n=3,=0,m=0,ms=1/20r-1/2) 若有多个价电子的原子,每个价电子都可能跃迁而产生光谱, 同时各个价电子之间还存在相互作用,原子的能级常用光谱项 来描述
例如:钠原子核外电子构型: 1s22s22p63s1 价电子构型:3s1 (n=3, l=0,m=0,ms=1/2 or –1/2) 若有多个价电子的原子,每个价电子都可能跃迁而产生光谱, 同时各个价电子之间还存在相互作用,原子的能级常用光谱项 来描述。 原子光谱和分子光谱 核外电子的运动状态依据泡利不相容原理、能量 最低原理和洪德规则,对核外电子进行排布

原子光谱和分子光谱 光谱项 原子的能量状态需要用光谱项来表征。 N2s+iLj 其中n为主量子数,L为总角量子数 L=∑L; S为总自旋量子数,S=2m,1 J内量子数,是由于轨道运动和自旋运动的相互作 用,即轨道磁距与自旋磁距的相互影响而得出的
原子光谱和分子光谱 (二)光谱项 原子的能量状态需要用光谱项来表征。 N2s+1LJ 其中n为主量子数,L为总角量子数 L=∑Li S为总自旋量子数,S=Σms , I J内量子数,是由于轨道运动和自旋运动的相互作 用,即轨道磁距与自旋磁距的相互影响而得出的

第二节原子光谱和分子光谱 光谱项n2+lL 符号2s+1称为光谱项的多重性,表 示内量子数J可取值的数目,表示同一光谱项中包含J 不同,能量相近的能量状态数。 光谱支项:n2S+L,J值不同的光谱项 J=L+S 例如:L=2,S=1则J=3,2,1 由于L>S,2s+1=3,则有3个J值可取。 若L=0,S=1/2,由于L<S,J可取2L+1个值即1个值,J=1/2
第二节 原子光谱和分子光谱 光谱项 符号2s+1称为光谱项的多重性,表 示内量子数J可取值的数目,表示同一光谱项中包含J 不同,能量相近的能量状态数。 光谱支项: J值不同的光谱项 J=L+S 例如:L=2,S=1则J=3,2,1 由于L>S,2s+1=3,则有3个J值可取。 若L=0,S=1/2,由于L<S,J可取2L+1个值即1个值,J=1/2。 n L 2S +1 J S n L 2 +1

原子光谱和分子光谱 例如:Zn原子价电子为4s2,即 (n=4,L=0,S=0,J=0) 光谱项为:4S0 在外磁场作用下,光谱支项会进一步分裂,每个光谱 支项包括2J+1个能量状态,在没有外磁场的作用时, 它们的能级是相同的;有外磁场时,由于原子磁距与 外加磁场的作用,简并的能级分裂为2J+1个能级,用 g=2J+1表示简并度,原子在这些状态上具有相同的概 率分布,由于这些简并引起概率称统计权重
原子光谱和分子光谱 例如:Zn 原子价电子为4s2 ,即 (n=4,L=0,S=0,J=0) 光谱项为:4 1S0 在外磁场作用下,光谱支项会进一步分裂,每个光谱 支项包括2J+1个能量状态,在没有外磁场的作用时, 它们的能级是相同的;有外磁场时,由于原子磁距与 外加磁场的作用,简并的能级分裂为2J+1个能级,用 g=2J+1表示简并度,原子在这些状态上具有相同的概 率分布,由于这些简并引起概率称统计权重
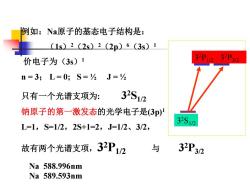
例如:Na原子的基态电子结构是: (1s)2(2s)2(2p)6(3s)1 价电子为(3s)1 32P12 32P32 n=3;L=0;S=J=% 只有一个光谱支项为: 32S12 钠原子的第一激发态的光学电子是(3p) L=1,S=1/2,2S+1=2,J=1/2、3/2, 32S12 故有两个光谱支项,32P1/2 与 32P32 Na588.996nm Na589.593nm
例如:Na原子的基态电子结构是: (1s)2(2s)2(2p)6(3s)1 价电子为(3s)1 n = 3; L = 0; S = ½ J = ½ 只有一个光谱支项为: 3 2S1/2 钠原子的第一激发态的光学电子是(3p)1 L=1,S=1/2,2S+1=2,J=1/2、3/2, 故有两个光谱支项,3 2P1/2 与 3 2P3/2 3 2S1/2 3 2P1/2 3 2P3/2 Na 588.996nm Na 589.593nm

例2 镁原子 基态的电子组态是3s2,L=0,S=0,2S+1=1,J=031S0 镁原子第一激发态的电子组态是3s3p 由于L=1,S=0、1,2S+1=1或3,有两个光谱项: 3P,当S-0,J=1,只有光谱支项3P1 33P,当S=1,J=2,1,0,故有三个光谱支项
例2 镁原子 基态的电子组态是3s2 , L=0,S=0, 2S+1=1, J=0 3 1 s0 镁原子第一激发态的电子组态是3s13p1 由于L=1,S=0、1,2S+1=1或3,有两个光谱项: 3 1PJ 当S=0 ,J=1,只有光谱支项 3 1P1 3 3PJ 当S=1 ,J=2,1,0,故有三个光谱支项
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第11章 高效液相色谱法 High Performance Liquid Chromatography, HPLC.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第10章 气相色谱分析法 Gas Chromatography, GC.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)高效液相色谱 High Performance Liquid Chromatography, HPLC.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)荧光分析法 Fluorescence.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)色谱分析法概论.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)红外分光光度法(2/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)紫外-可见分光光度法(2/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)紫外-可见分光光度法(1/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)红外分光光度法(1/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)气相色谱法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学专业)仪器分析概述(主讲:赵芳).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)色谱法原理 Principles of Chromatography.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)红外光谱分析.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)原子吸收光谱法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)光学分析法导论.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)紫外可见分光光度法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)电化学分析法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)气相色谱法(Gas Chromatography).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)原子发射光谱法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(食品专业)分子发光分析.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第3章 原子吸收 Atomic absorption spectrometry, AAS.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第5章 分子发光光谱法 Molecular luminescence spectrometry,MLS.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(1/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第6章 红外分光光度法(2/2).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(化工仪器分析及实验)第1章 绪论 Instrumental analysis(主讲:杨红兵).ppt
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第七章 氧化还原滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第三章 滴定分析法概论.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第二章 误差和分析数据处理.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第九章 紫外-可见分光光度法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第五章 沉淀滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第八章 电化学分析法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第六章 配位滴定法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十一章 色谱法基本概念及经典液相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十二章 气相色谱法.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第十章 红外分光光度法简介.pptx
- 高职高专:《分析化学》课程教材PPT课件(药品类专业)第四章 酸碱滴定法.pptx
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第二节 化学平衡.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第三节 滴定分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第四节 滴定分析法应用.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第四章 电化学分析法 第一节 电化学分析法概述.ppt
