《结晶学》课程教学资源(教案讲义)第十章 晶体结构

第十章旨晶体结构晶体结构的分类方法有很多种,常用的分类方法有:(1)按照化学组成中原子的种类及数目分类。如单质晶体、二元化合物晶体、多元化合物晶体等。这种分类方法的缺点是:①一些形式上相同,但对称性和其它性质都截然不同的化合物常被归为一类。例如NaCI、NiAs的晶体结构是不同的。②一些同型结构的晶体又会被归为不同的类型,如LiFeO2和NaCI(晶体结构基元排列方式相同,且具有相同的空间群,为同型结构)。(2)根据晶体结构中化学键的类型分类,如离子键型、共价键型、金属键型等。这种分类的不足在于:①许多晶体是多键型的,归类存在困难。如石墨层内为共价键,层间为分子键。②不同化学键的晶体可以是同一结构型,NaCI、TaC均为AX型晶体,但是前者为离子键,后者为金属键。(3)根据晶胞的形状、大小和晶体生长习性间的相互关系,将晶体结构分为等向型、层型和链型三种主要类型,而这三种类型又以等大球的六方和立方最紧密堆积为基础。下面的介绍将以上三种方法结合使用。第一节元素单质的晶体结构单质的晶体结构可以分为金属单质、惰性气体和非金属单质三类。一、金属单质的晶体结构元素周期表中,共有70多种金属元素。典型的金属单质晶体,其原子与原子之间的结合力为金属键,由于金属键没有方向性和饱和性,其配位数高,密度也大,故可把典型的金属单质晶体结构看成是由等大球紧密堆积而成。按堆积方式可分为三种类型:A,型:为立方最紧密堆积;A型:为立方体心紧密堆积;A,型:为六方最紧密堆积。它们的典型实例如下:1.铜的晶体结构属A,型,铜原子成立方最紧密堆积,格子类型为立方面心格子。空间群为Fm3m,晶胞参数a。=0.3608nm,原子配位数CN=12,单位晶胞中原子的数目Z=4,163
163 第十章 晶体结构 晶体结构的分类方法有很多种,常用的分类方法有: (1)按照化学组成中原子的种类及数目分类。如单质晶体、二元化合物晶 体、多元化合物晶体等。这种分类方法的缺点是:①一些形式上相同,但对称性和 其它性质都截然不同的化合物常被归为一类。例如 NaCl、NiAs 的晶体结构是不同 的。②一些同型结构的晶体又会被归为不同的类型,如 LiFeO2 和 NaCl(晶体结构 基元排列方式相同,且具有相同的空间群,为同型结构)。 (2)根据晶体结构中化学键的类型分类,如离子键型、共价键型、金属键型 等。这种分类的不足在于:①许多晶体是多键型的,归类存在困难。如石墨层内为 共价键,层间为分子键。②不同化学键的晶体可以是同一结构型,NaCl、TaC 均为 AX 型晶体,但是前者为离子键,后者为金属键。 (3)根据晶胞的形状、大小和晶体生长习性间的相互关系,将晶体结构分为 等向型、层型和链型三种主要类型,而这三种类型又以等大球的六方和立方最紧密 堆积为基础。 下面的介绍将以上三种方法结合使用。 第一节 元素单质的晶体结构 单质的晶体结构可以分为金属单质、惰性气体和非金属单质三类。 一、金属单质的晶体结构 元素周期表中,共有 70 多种金属元素。典型的金属单质晶体,其原子与原子 之间的结合力为金属键,由于金属键没有方向性和饱和性,其配位数高,密度也 大,故可把典型的金属单质晶体结构看成是由等大球紧密堆积而成。按堆积方式可 分为三种类型: A1 型:为立方最紧密堆积; A2 型:为立方体心紧密堆积; A3 型:为六方最紧密堆积。它们的典型实例如下: ⒈铜的晶体结构 属 A1 型, 铜原子成立方最紧密堆积,格子类型为立方面心格子。空间群为 Fm3m, 晶胞参数 ao=0.3608nm,原子配位数 CN=12,单位晶胞中原子的数目 Z=4
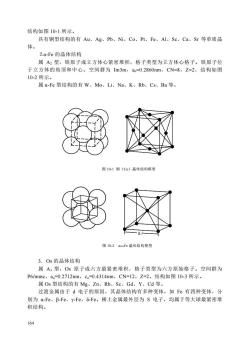
结构如图10-1所示。具有铜型结构的有Au、Ag、Pb、Ni、Co、Pt、Fe、Al、Sc、Ca、Sr等单质晶体。2.α-Fe的晶体结构属A2型,铁原子成立方体心紧密堆积,格子类型为立方体心格子。铁原子位于立方体的角顶和中心。空间群为Im3m,a。=0.2860nm,CN=8,Z=2,结构如图10-2所示。属α-Fe型结构的有W、Mo、Li、Na、K、Rb、Cs、Ba等。图10-1铜(Cu)晶体结构模型图10-2a—Fe晶体结构模型3.Os的晶体结构属A3型,Os原子成六方最紧密堆积,格子类型为六方原始格子。空间群为P6/mmc,a。=0.2712nm,c=0.4314nm,CN=12,Z=2。结构如图10-3所示。属Os型结构的有Mg、Zn、Rh、Sc、Gd、Y、Cd等。过渡金属由于d电子的原因,其晶体结构有多种变体,如Fe有四种变体,分别为α-Fe、β-Fe、-Fe、-Fe。稀土金属最外层为S电子,均属于等大球最紧密堆积结构。164
164 结构如图 10-1 所示。 具有铜型结构的有 Au、Ag、Pb、Ni、Co、Pt、Fe、Al、Sc、Ca、Sr 等单质晶 体。 ⒉α-Fe 的晶体结构 属 A2 型,铁原子成立方体心紧密堆积,格子类型为立方体心格子。铁原子位 于立方体的角顶和中心。空间群为 Im3m,ao=0.2860nm,CN=8,Z=2,结构如图 10-2 所示。 属 α-Fe 型结构的有 W、Mo、Li、Na、K、Rb、Cs、Ba 等。 图 10-1 铜(Cu)晶体结构模型 图 10-2 a—Fe 晶体结构模型 3.Os 的晶体结构 属 A3 型,Os 原子成六方最紧密堆积,格子类型为六方原始格子。空间群为 P6/mmc,ao=0.2712nm,co=0.4314nm,CN=12,Z=2。结构如图 10-3 所示。 属 Os 型结构的有 Mg、Zn、Rh、Sc、Gd、Y、Cd 等。 过渡金属由于 d 电子的原因,其晶体结构有多种变体,如 Fe 有四种变体,分 别为 α-Fe、β-Fe、γ-Fe、δ-Fe。稀土金属最外层为 S 电子,均属于等大球最紧密堆 积结构
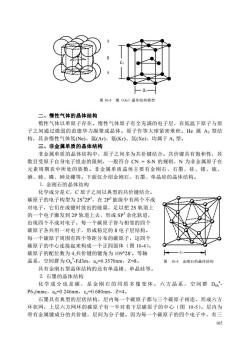
a图10-3钱(Os)品体结构模型二、情性气体的晶体结构惰性气体以单原子存在。性气体原子有全充满的电子层,在低温下原子与原子之间通过微弱的范德华力凝聚成晶体。原子作等大球紧密堆积。He属A3型结构,其余情性气体氛(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、均属于A,型。三、非金属单质的晶体结构非金属单质的晶体结构中,原子之间多为共价键结合。共价键具有饱和性,其数目受原子自身电子组态的限制,一般符合CN=8-N的规则,N为非金属原子在元素周期表中所处的族数。非金属单质晶体主要有金刚石、石墨、硅、锗、硫、硒、碲、磷、砷及硼等。下面仅介绍金刚石、石墨、单晶硅的晶体结构。1.金刚石的晶体结构化学成分是C,C原子之间以典型的共价键结合。碳原子的电子构型为2s?2P2,在2P?能级中有两个不成对电子,它们在成键时放出的能量,足以把2S轨道上的一个电子激发到2P轨道上去,形成SP杂化轨道,出现四个不成对电子。每一个碳原子皆与相邻的四个碳原子各共用一对电子,形成稳定的8电子层结构。每一个碳原子周围有四个等距分布的碳原子,这四个碳原子的中心连接起来构成一个正四面体(图10-4)。碳原子的配位数为4.共价键的键角为109°28。等轴晶系,空间群为Oh-Fd3m,a。=0.3570nm,Z=8。图10-4金刚石的晶体结构具有金刚石型晶体结构的还有单晶锗、单晶硅等。2.石墨的晶体结构化学成分也是碳,是金刚石的同质多像变体。六方晶系,空间群D6hP6g/mmc,a。=0.246nm,c。=0.680nm,Z=4。石墨具有典型的层状结构,层内每一个碳原子都与三个碳原子相连,形成六方环状网,上层六方网环的碳原子有一半对着下层碳原子的中心(图10-5)。层内为带有金属键成分的共价键,层间为分子键。因为每一个碳原子的四个电子中,有三165
165 图 10-3 锇(Os)晶体结构模型 二、惰性气体的晶体结构 惰性气体以单原子存在。惰性气体原子有全充满的电子层,在低温下原子与原 子之间通过微弱的范德华力凝聚成晶体。原子作等大球紧密堆积。He 属 A3 型结 构,其余惰性气体氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、均属于 A1 型。 三、非金属单质的晶体结构 非金属单质的晶体结构中,原子之间多为共价键结合。共价键具有饱和性,其 数目受原子自身电子组态的限制,一般符合 CN = 8-N 的规则,N 为非金属原子在 元素周期表中所处的族数。非金属单质晶体主要有金刚石、石墨、硅、锗、硫、 硒、碲、磷、砷及硼等。下面仅介绍金刚石、石墨、单晶硅的晶体结构。 ⒈ 金刚石的晶体结构 化学成分是 C,C 原子之间以典型的共价键结合。 碳原子的电子构型为 2S2 2P2,在 2P2 能级中有两个不成 对电子,它们在成键时放出的能量,足以把 2S 轨道上 的一个电子激发到 2P 轨道上去,形成 SP3 杂化轨道, 出现四个不成对电子。每一个碳原子皆与相邻的四个 碳原子各共用一对电子,形成稳定的 8 电子层结构。 每一个碳原子周围有四个等距分布的碳原子,这四个 碳原子的中心连接起来构成一个正四面体(图 10-4)。 碳原子的配位数为 4,共价键的键角为 109°28′。等轴 晶系,空间群为 Oh 7 -Fd3m,ao=0.3570nm,Z=8。 图 10-4 金刚石的晶体结构 具有金刚石型晶体结构的还有单晶锗、单晶硅等。 ⒉ 石墨的晶体结构 化 学 成 分 也 是 碳 , 是 金 刚 石 的 同 质 多 像 变 体 。 六 方 晶 系 , 空 间 群 D6h 4 - P63/mmc,ao=0.246nm,co=0.680nm,Z=4。 石墨具有典型的层状结构,层内每一个碳原子都与三个碳原子相连,形成六方 环状网,上层六方网环的碳原子有一半对着下层碳原子的中心(图 10-5)。层内为 带有金属键成分的共价键,层间为分子键。因为每一个碳原子的四个电子中,有三
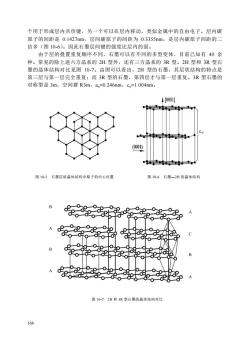
个用于形成层内共价键,另一个可以在层内移动,类似金属中的自由电子。层内碳原子的间距是0.1427nm,层间碳原子的间距为0.3355nm,是层内碳原子间距的二倍多(图10-6)。因此石墨层间键的强度比层内的弱。由于层的叠置重复顺序不同,石墨可以有不同的多型变体,目前已知有40余种。常见的除上述六方晶系的2H型外,还有三方晶系的3R型。2H型和3R型石墨的晶体结构对比见图10-7。由图可以看出,2H型的石墨,其层状结构的特点是第三层与第一层完全重复:而3R型的石墨,第四层才与第一层重复。3R型石墨的对称型是3m,空间群R3m,a。=0.246nm,c=1.004nm。↑[0001]C.(0001)图10-5石墨层状晶体结构中原子的中心位置图10-6石墨一2H的晶体结构BAOB9819B-CAofol图10-72H和3R型石墨的晶体结构对比166
166 个用于形成层内共价键,另一个可以在层内移动,类似金属中的自由电子。层内碳 原子的间距是 0.1427nm,层间碳原子的间距为 0.3355nm,是层内碳原子间距的二 倍多(图 10-6)。因此石墨层间键的强度比层内的弱。 由于层的叠置重复顺序不同,石墨可以有不同的多型变体,目前已知有 40 余 种。常见的除上述六方晶系的 2H 型外,还有三方晶系的 3R 型。2H 型和 3R 型石 墨的晶体结构对比见图 10-7。由图可以看出,2H 型的石墨,其层状结构的特点是 第三层与第一层完全重复;而 3R 型的石墨,第四层才与第一层重复。3R 型石墨的 对称型是 3m,空间群 R3m,ao=0.246nm,co=1.004nm。 co 图 10-5 石墨层状晶体结构中原子的中心位置 图 10-6 石墨—2H 的晶体结构 图 10-7 2H 和 3R 型石墨的晶体结构对比 A C B A B A B A

第二节无机化合物的晶体结构以下将无机化合物晶体中具有代表性的结构类型按所含原子种类的多少,分为两大类介绍,一类为二元化合物(AX、AX2、:AnX),另一类为多元化合物(如ABX、ABX4..等)。因硅酸盐较为特殊复杂,专门作为一类介绍。一、二元无机化合物晶体1.AX型晶体结构是由等价的两种阴阳离子按、1:1的比例构成。主要有氯化钠型、氯化艳型、闪锌矿型和纤锌矿型等四种。(1)氯化钠(NaCI)型等轴晶系,空间群Oh-Fm3m,a。=0.5628nm。结构可以看成是CI作立方最紧密堆积,Na充填在全部的八面体空隙中,CI和Na的配位数CN均为6,空间格子类型为立方面心格子。等效点的坐标为:4CI是0,0,0;1/2,1/2,0:1/2,0,1/2:0,1/2,1/2:4Na为0,0,1/2:1/2,0,0:0,1/2,0:1/2,1/2,1/2。图10-8所示为一个晶胞,单位晶胞中有4个CI和4个Na,Z=4。NaCI型结构稳定于r/r=0.414一0.732范围,r>r时,阳离子作立方最紧密堆积,阴离子充填在其中的八面体空隙。NaOCIba图10-8NaC1结构(a)及其在阴阳离子相互接触的八面体空障中阳离子的填充情况(b)属于NaCI型晶体结构的二元化合物有:卤化物(AX),A=Lit、Nat、Kt、Rut、Agt...X=F、CI、Br167
167 第二节 无机化合物的晶体结构 以下将无机化合物晶体中具有代表性的结构类型按所含原子种类的多少,分为 两大类介绍,一类为二元化合物(AX、AX2、. AnXm),另一类为多元化合物(如 ABX3、ABX4.等)。因硅酸盐较为特殊复杂,专门作为一类介绍。 一、二元无机化合物晶体 ⒈AX 型晶体结构 是由等价的两种阴阳离子按 1:1 的比例构成。主要有氯化钠型、氯化铯型、 闪锌矿型和纤锌矿型等四种。 ⑴ 氯化钠(NaCl)型 等轴晶系,空间群 Oh 5 -Fm3m,ao=0.5628nm。结构可以看成是 Cl-作立方最紧 密堆积,Na+充填在全部的八面体空隙中,Cl-和 Na+的配位数 CN 均为 6,空间格子 类型为立方面心格子。等效点的坐标为:4Cl-是 0,0,0;1/2,1/2,0;1/2,0, 1/2;0,1/2,1/2;4Na+为 0,0,1/2;1/2,0,0;0,1/2,0;1/2,1/2,1/2。图 10-8 所示为一个晶胞,单位晶胞中有 4 个 Cl-和 4 个 Na+,Z=4。NaCl 型结构稳定 于 r + /r- =0.414-0.732 范围,r + >r-时,阳离子作立方最紧密堆积,阴离子充填在其中 的八面体空隙。 a b 图 10-8 NaC1 结构(a)及其在阴阳离子相互接触的八面体空隙中阳离子的填充情况(b) 属于 NaCl 型晶体结构的二元化合物有: 卤化物(AX),A=Li+、Na+、K +、Ru+、Ag+. X=F-、Cl-、Br-

氢化物(AH),A=Lit、Nat、Kt、Rut、Cst...;氧化物(AO),A=Sr2+、Ba2+、Ca2+、Ti2+、Sn2+、Pb2+..硫化物(AS),A=Pb2t、Ca2+、Mn2+、Ba2+、Mg2+..;硒化物(ASe),A=Pb2+、Ca2+、Mn2、Ba2+、Mg2+;碲化物(ATe),A=Ca2+、Sr2+、Ba2+、Ti.碳化物(AC),A=Ti、Zr、Hf、V、Nb、Ta、Th...;氮化物(AN),A=Sc、Y、Ti、Zr、V、Nb、Cr、Np、Pu、Th、U...;过渡金属元素的氧化物。(2)氯化(CsCI)型结构等轴晶系,空间群Oh-Pm3m,a=0.4110nm,Z=1。结构如图10-9所示。CsCI结构可以看成是由CI的立方原始点阵和Cs的立方原始点阵套叠而成,一套点阵位于另一套点阵的立方晶胞的中心,两种离子的配位数CN均为8。即如果原始点选在CI的中心,相当点位于立方晶胞的8个角顶,Cs位于晶胞体心:如果原?Cl-Os●Zn图10-9CsC1晶体结构图10-10闪锌矿(立方硫化锌)晶体结构始点选在Cs的中心,则相当点也位于立方晶胞的8个角顶,CI位于晶胞体心。等效点的坐标为CI:0,0,0:Cs:1/2,1/2,1/2。当AX型化合物中r/r>0.732时多为CsCI型结构。属于这种结构型的有CsBr、Csl、RbCl、ThCI、ThTe、TICl、TIBr、NH,CI、NH,Br、NHI等。在后三种晶体中,NH可看作是一个简单的阳离子。(3)闪锌矿(α-ZnS)型结构等轴晶系,空间群为T-F43m,a。=0.540nm,Z=4。图10-10所示为它的一个晶胞,S位于立方晶胞的8个角顶和每一个面的面心,若把单位晶胞分成8个小立方体,Zn2+占据其中相间四个的中心位置;闪锌矿结构也可以看成是s2-作立方最紧密堆积,Zn充填1/2的四面体空隙。结构与金刚石非常相似,将Zn、S换成C即为金刚石结构。2-和Zn2+各占据一组特殊等效位置,等效点的坐标为4s2:0,0,0;1/2,1/2,0;1/2,0,1/2:0,1/2,1/2;4Zn2+:1/4,1/4,1/43/4,3/4,168
168 氢化物 (AH ), A=Li+、Na+、K +、Ru+、Cs+.; 氧化物(AO),A=Sr2+、Ba2+、Ca2+、Ti2+、Sn2+、Pb2+.; 硫化物(AS),A=Pb2+、Ca2+、Mn2+、Ba2+、Mg2+ .; 硒化物(ASe),A=Pb2+、Ca2+、Mn2+、Ba2+、Mg2+ .; 碲化物 (ATe ), A= Ca2+、Sr2+、Ba2+、Ti2 .; 碳化物(AC), A=Ti、Zr、Hf、V、Nb、Ta、Th.; 氮化物(AN), A=Sc、Y、Ti、Zr、V、Nb、Cr、Np、Pu、Th、U.; 过渡金属元素的氧化物。 ⑵氯化铯(CsCl)型结构 等轴晶系,空间群 Oh 1 -Pm3m,ao=0.4110nm ,Z=1。结构如图 10-9 所示。 CsCl 结构可以看成是由 Cl-的立方原始点阵和 Cs+的立方原始点阵套叠而成,一套 点阵位于另一套点阵的立方晶胞的中心,两种离子的配位数 CN 均为 8。即如果原 始点选在 Cl-的中心,相当点位于立方晶胞的 8 个角顶,Cs+位于晶胞体心;如果原 图 10-9 CsC1 晶体结构 图 10-10 闪锌矿(立方硫化锌)晶体结构 始点选在 Cs+的中心,则相当点也位于立方晶胞的 8 个角顶,Cl-位于晶胞体心。等 效点的坐标为 Cl-:0,0,0;Cs+:1/2,1/2,1/2。当 AX 型化合物中 r + /r- >0.732 时 多为 CsCl 型结构。 属于这种结构型的有 CsBr、CsI、RbCl、ThCl、ThTe、TlCl、TlBr、NH4Cl、 NH4Br、NH4I 等。在后三种晶体中,NH4 +可看作是一个简单的阳离子。 ⑶ 闪锌矿(α-ZnS)型结构 等轴晶系,空间群为 Td 2 -F43m,ao=0.540nm,Z=4。图 10-10 所示为它的一个 晶胞,S 2-位于立方晶胞的 8 个角顶和每一个面的面心,若把单位晶胞分成 8 个小立 方体,Zn2+占据其中相间四个的中心位置;闪锌矿结构也可以看成是 S 2-作立方最紧 密堆积,Zn+充填 1/2 的四面体空隙。结构与金刚石非常相似,将 Zn、S 换成 C 即 为金刚石结构。S 2-和 Zn2+各占据一组特殊等效位置,等效点的坐标为 4S2-:0,0, 0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2;4Zn2+:1/4,1/4,1/4;3/4,3/4

1/4;3/4,1/4,3/4;1/4,3/4,3/4。具有闪锌矿型结构的有CaF、CuCl、CuBr、Cul、BeV、BeS、CdS、HgS、BeSe、BeTe、ZnSe、ZnTe、CdTe、MgTe、AIP、GaP、AlAs、GaAs、AlSb、InSb、BaS、BN、SiC、BeB等。(4)纤锌矿(β-ZnS)型结构纤锌矿是闪锌矿的同质多像变体。六方晶系,空间群是C6v-P63mc,a=0.384nm;c=0.518nm,Z=6。如图10-11所示,结构中s2-成六方紧密堆积,Zn充填半数的四面体空隙。四面体共顶相连,阴阳离子的配位数均为4。若将单位晶胞分成六个相等的三方柱,硫离子位于三方柱的每一个角顶和相间的三方柱的中心,锌离子位于中心有硫离子的三方柱的三条棱的5/8处及中心线的1/8处。等效点的坐标:s2-为0,0,0:2/3,1/3,1/2;Zn2+为0,0,5/8:2/3,1/3,1/8。eZnO图10-11纤锌矿(六方ZnS)的品体结构2.AX,型化合物的晶体结构主要包括氧化物和氟化物等,典型的结构有两种:萤石(CaF2)型和金红石型。(1)萤石(CaF,)型结构萤石(又称氟石),等轴晶系,空间群O,-Fm3m,a。=0.545nm,Z=4。F为四面体配位,CN=4:Ca2为立方体配位,CN=8。或可以看成Ca2成立方紧密堆积,氟离子充填所有四面体空隙。图10-12所示为一个晶胞,Ca2离子位于立方面心格子的八个角顶和每一个面的中心,F位于单位晶胞所等分的八个小立方体的中心。等效点的坐标4Ca2+是0,0,0:1/2,1/2,0:1/2,0,1/2;0,1/2,1/2;8F为1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4;3/4,3/4,3/4;1/4,1/4,3/4;1/4,3/4,1/4;3/4,1/4,1/4。董石型结构的稳定范围为r/r>0.732。具有萤石型结构的晶体见表10-1。在萤石的晶体结构中,111!面网的面网间距虽非最大,但是在这个方向上存在着互相毗邻的同号负离子层,相互之间存在着静电斥力,致使晶体具有平行(111)的八面体的完全解理。天然萤石用作为生产玻璃的助熔剂、制取氢氟酸和提取氟的原料:人造萤石单晶体可作为红外和激光仪器的光学元件。169
169 1/4;3/4,1/4,3/4;1/4,3/4,3/4。 具有闪锌矿型结构的有 CaF、CuCl、CuBr、CuI、BeV、BeS、CdS、HgS、 BeSe、 BeTe 、 ZnSe 、 ZnTe、 CdTe、 MgTe、 AlP 、 GaP 、 AlAs、 GaAs、 AlSb 、 InSb、BaS、BN、SiC、BeB 等。 ⑷ 纤锌矿(β-ZnS)型结构 纤锌矿是闪锌矿的同质多像变体。六方晶系,空间群是 C6v 4 -P63mc , ao=0.384nm;co=0.518nm,Z=6。如图 10-11 所示,结构中 S 2-成六方紧密堆积, Zn2+充填半数的四面体空隙。四面体共顶相连,阴阳离子的配位数均为 4。若将单 位晶胞分成六个相等的三方柱,硫离子位于三方柱的每一个角顶和相间的三方柱的 中心,锌离子位于中心有硫离子的三方柱的三条棱的 5/8 处及中心线的 1/8 处。等 效点的坐标:S 2-为 0,0,0;2/3,1/3,1/2;Zn2+为 0,0,5/8;2/3,1/3,1/8。 图 10-11 纤锌矿(六方 ZnS)的晶体结构 ⒉ AX2 型化合物的晶体结构 主要包括氧化物和氟化物等,典型的结构有两种:萤石(CaF2)型和金红石 型。 ⑴ 萤石(CaF2)型结构 萤石(又称氟石),等轴晶系,空间群 Oh 5 -Fm3m,ao=0.545nm,Z=4。F -为四 面体配位,CN=4;Ca2+为立方体配位,CN=8。或可以看成 Ca2+成立方紧密堆积, 氟离子充填所有四面体空隙。图 10-12 所示为一个晶胞,Ca2+离子位于立方面心格 子的八个角顶和每一个面的中心,F -位于单位晶胞所等分的八个小立方体的中心。 等效点的坐标 4Ca2+是 0,0,0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2;8F-为 1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4;3/4,3/4,3/4; 1/4,1/4,3/4;1/4,3/4,1/4;3/4,1/4,1/4。 萤石型结构的稳定范围为 r + /r- >0.732。具有萤石型结构的晶体见表 10-1。 在萤石的晶体结构中,{111}面网的面网间距虽非最大,但是在这个方向上存 在着互相毗邻的同号负离子层,相互之间存在着静电斥力,致使晶体具有平行{111} 的八面体的完全解理。天然萤石用作为生产玻璃的助熔剂、制取氢氟酸和提取氟的 原料;人造萤石单晶体可作为红外和激光仪器的光学元件
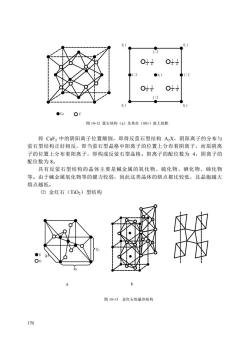
0.1L2011O1411200,1$1/2O4O111/20.0, 1CaOF图10-12萤石结构(a)及其在(001)面上投影将CaF,中的阴阳离子位置颠倒,即得反董石型结构AX,阴阳离子的分布与萤石型结构正好相反,即当萤石型晶格中阳离子的位置上分布着阴离子,而原阴离子的位置上分布着阳离子,即构成反董石型晶格。阳离子的配位数为4,阴离子的配位数为8。具有反董石型结构的晶体主要是碱金属的氧化物、硫化物、硒化物、碲化物等。由于碱金属氧化物等的键力较弱,因此这类晶体的熔点都比较低,且晶胞越大熔点越低。(2)金红石(TiO2)型结构00b图10-13金红石的晶体结构170
170 图 10-12 萤石结构(a)及其在(001)面上投影 将 CaF2 中的阴阳离子位置颠倒,即得反萤石型结构 A2X,阴阳离子的分布与 萤石型结构正好相反,即当萤石型晶格中阳离子的位置上分布着阴离子,而原阴离 子的位置上分布着阳离子,即构成反萤石型晶格。阳离子的配位数为 4,阴离子的 配位数为 8。 具有反萤石型结构的晶体主要是碱金属的氧化物、硫化物、硒化物、碲化物 等。由于碱金属氧化物等的键力较弱,因此这类晶体的熔点都比较低,且晶胞越大 熔点越低。 ⑵ 金红石(TiO2)型结构 a b 图 10-13 金红石的晶体结构

四方晶系,空间群D4hl4-P42/mnm,a。=0.4594nm,c。=0.2959nm,Z=2。结构中氧离子成扭曲的六方紧密堆积,平面三角形配位,CN=3:钛离子位于半数的八面体空隙中,构成[TiO6]八面体配位,CN=6。图10-13a所示为一个晶胞,钛离子位于单位晶胞的角顶和体心,六个氧离子中有四个位于单位晶胞的上、下底面上,另外两个位于单位晶胞内。结构中[TiOl八面体共棱连接成平行c轴的链,链间通过共用[TiO6]八面体的角顶连接,其晶胞参数c。值恰好为[TiO6]八面体的棱长(图10-13b)。等效点的坐标为2Ti4是0,0,0;1/2,1/2,1/2;40是u,u,0;1-u,1-u,01/2+u,1/2+u,1/2:1/2-u,1/2+u,1/2。在金红石的晶格中u=0.31。金红石形结构的稳定范围是r/=0.732一0.380。金红石晶体具有很高的折射率和介电常数,常被用来作为陶瓷铀原料,也是无线电陶瓷的主要晶相之一。金红石型钛白粉和云母钛珠光颜料具有良好的耐侯性、化学稳定性及光学性能。属于金红石形结构的晶体见表10-1。表10-1具有CaFz型与TiO,型结构的AX,型化合物CaF2型TiO2型r*/r>0.732r*/r=0.732~0.380.990.720.590.60BaF2CeO2MnF2PbO2PbF20.88ThO20.68FeF20.59SnO20.51SrF20.660.590.490.83PrO2PdF2TiO20.65(BaCl2)(0.75)PbO2(CaCl2)(0.55)WO20.470.640.54CaF2ZnF20.46(0.73)UO2Os020.63(SrCl2)0.71NpO2CoF20.53Ir020.46PuO20.62NiF20.51RuO20.45(0.63)0.61VO20.43AmO2(CaBr2)(0.51)ZrO20.570.48CrO20.40MgF2HrO20.56MnO20.39GeO20.38(3)SiO2型结构SiO,中Si的4个sp3杂化轨道分别与4个O的p轨道形成4个键,构成[SiO4]四面体,四面体之间共角顶连接,Si的配位数CN=4,O的配位数CN=2。[SiO4]四面体的具体连接方式不同,会使晶体结构的对称性发生变化,形成不同的变体。SiO,有一系列同质多像变体,这些变体的形态和物理性质也有差异。α-石英为唯一使用的压电晶体,熔点为1750℃C,莫氏硬度为7。空间群D3P3,2(左形)或D,4-P322(右形),a。=0.4904nm,c。=0.5397nm。晶体在(0001)面上的投影如图10-14所示。171
171 四方晶系,空间群 D4h 14 -P42/mnm,ao=0.4594nm,co=0.2959nm ,Z=2。结构中 氧离子成扭曲的六方紧密堆积,平面三角形配位,CN=3;钛离子位于半数的八面 体空隙中,构成[TiO6]八面体配位,CN=6。图 10-13a 所示为一个晶胞,钛离子位于 单位晶胞的角顶和体心,六个氧离子中有四个位于单位晶胞的上、下底面上,另外 两个位于单位晶胞内。结构中[TiO6]八面体共棱连接成平行 c 轴的链,链间通过共 用[TiO6]八面体的角顶连接,其晶胞参数 co 值恰好为[TiO6]八面体的棱长(图 10- 13b)。等效点的坐标为 2Ti4+是 0,0,0;1/2,1/2,1/2;4O2-是 u,u,0;1-u,1- u,0;1/2+u,1/2+u,1/2;1/2-u,1/2+u,1/2。在金红石的晶格中 u=0.31。 金红石形结构的稳定范围是 r + /r- =0.732-0.380。 金红石晶体具有很高的折射率和介电常数,常被用来作为陶瓷铀原料,也是无 线电陶瓷的主要晶相之一。金红石型钛白粉和云母钛珠光颜料具有良好的耐侯性、 化学稳定性及光学性能。 属于金红石形结构的晶体见表 10-1。 表 10-1 具有 CaF2 型与 TiO2 型结构的 AX2 型化合物 CaF2 型 r + /r- >0.732 TiO2 型 r + /r- =0.732~0.38 BaF2 PbF2 SrF2 (BaCl2 ) CaF2 (SrCl2 ) 0.99 0.88 0.83 (0.75) (0.73) 0.71 (0.63) CeO2 ThO2 PrO2 PbO2 UO2 NpO2 PuO2 AmO2 ZrO2 HrO2 0.72 0.68 0.66 0.65 0.64 0.63 0.62 0.61 0.57 0.56 MnF2 FeF2 PdF2 (CaCl2 ) ZnF2 CoF2 NiF2 (CaBr2 ) MgF2 0.59 0.59 0.59 (0.55) 0.54 0.53 0.51 (0.51) 0.48 PbO2 SnO2 TiO2 WO2 OsO2 IrO2 RuO2 VO2 CrO2 MnO2 GeO2 0.60 0.51 0.49 0.47 0.46 0.46 0.45 0.43 0.40 0.39 0.38 ⑶ SiO2 型结构 SiO2 中 Si 的 4 个 sp 3 杂化轨道分别与 4 个 O 的 p 轨道形成 4 个 σ 键,构成 [SiO4]四面体,四面体之间共角顶连接,Si 的配位数 CN=4,O 的配位数 CN=2。 [SiO4]四面体的具体连接方式不同,会使晶体结构的对称性发生变化,形成不同的 变体。SiO2 有一系列同质多像变体,这些变体的形态和物理性质也有差异。 α-石英为唯一使用的压电晶体,熔点为 1750°C,莫氏硬度为 7。空间群 D3 4 - P312(左形)或 D3 4 -P322(右形),ao=0.4904nm,co=0.5397nm。晶体在(0001)面 上的投影如图 10-14 所示
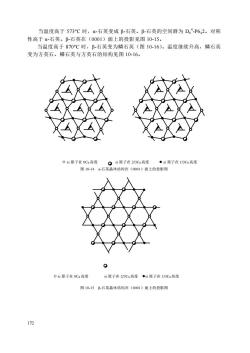
当温度高于573°C时,α-石英变成β-石英。β-石英的空间群为D。-P642。对称性高于α-石英。β-石英在(0001)面上的投影见图10-15。当温度高于870C时,β-石英变为鳞石英(图10-16)。温度继续升高,鳞石英变为方英石。鳞石英与方英石的结构见图10-16。Osi原子在OCo高度si原子在2/3Ce高度●si原子在1/3Co高度图10-14a-石英晶体结构在(0001)面上的投影图0Osi原子在OCo高度si原子在2/3Co高度si原子在1/3Co高度图10-15β-石英晶体结构在(0001)面上的投影图172
172 当温度高于 573°C 时,α-石英变成 β-石英。β-石英的空间群为 D6 4 -P642。对称 性高于 α-石英。β-石英在(0001)面上的投影见图 10-15。 当温度高于 870°C 时,β-石英变为鳞石英(图 10-16)。温度继续升高,鳞石英 变为方英石。鳞石英与方英石的结构见图 10-16。 ○ si 原子在 0C0 高度 si 原子在 2/3C0 高度 ● si 原子在 1/3C0 高度 图 10-14 a-石英晶体结构在(0001)面上的投影图 ○ si 原子在 0C0 高度 si 原子在 2/3C0 高度 ●si 原子在 1/3C0 高度 图 10-15 β-石英晶体结构在(0001)面上的投影图
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《材料显微结构分析》课程教学课件(PPT讲稿)第一章 绪论 Microstructure of Materials.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第二章 偏光显微镜研究法 2.1 晶体光学基础.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)显微镜基础知识.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)光的偏振.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第二章 偏光显微镜研究法 2.2 偏光(透射)显微分析.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第二章 偏光显微镜研究法 2.3 正交偏光镜下的物相分析.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第二章 偏光显微镜研究法 2.4 锥光镜下的物相分析.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第三章 反光显微镜光片研究法.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第四章 显微镜材料分析与研究.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第六章 功能陶瓷的显微结构.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第七章 耐火材料显微结构分析.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第八章 玻璃材料显微分析.ppt
- 《材料显微结构分析》课程教学课件(PPT讲稿)第九章 水泥材料显微结构分析.ppt
- 《纳米材料基础与应用》课程教学课件(PPT讲稿)第八章 纳米固体材料.ppt
- 《纳米材料》课程教学课件(PPT讲稿)基本理论和性质——量子尺寸效应.ppt
- 《材料物理性能》课程教学课件(PPT讲稿)绪论、第一章 无机材料的受力形变 1.1 应力与应变 1.2 无机材料的弹性形变.ppt
- 《材料物理性能》课程教学课件(PPT讲稿)第一章 无机材料的受力形变 1.2 无机材料的弹性形变 1.3 无机材料中晶相的塑性形变.ppt
- 《材料物理性能》课程教学课件(PPT讲稿)第一章 无机材料的受力形变 1.4 高温下玻璃相的黏性流动 1.5 无机材料的高温蠕变 1.6 无机材料的超塑性.ppt
- 《材料物理性能》课程教学课件(PPT讲稿)第二章 无机材料的断裂强度 2.1 固体材料的微裂纹理论 2.2 无机材料中微裂纹的起源 2.3 无机材料断裂强度的测试方法 2.4 显微结构对强度的影响.ppt
- 《材料物理性能》课程教学课件(PPT讲稿)第二章 无机材料的断裂强度 2.5 显微结构对强度的影响、第三章 无机材料的断裂及裂纹扩展 3.1 断裂力学基本概念 3.2 无机材料断裂韧性测试方法.ppt
- 《结晶学》课程教学资源(教案讲义)第九章 晶体化学基础.pdf
- 《结晶学》课程教学资源(教案讲义)第八章 晶体结构的几何理论.pdf
- 《结晶学》课程教学资源(教案讲义)第七章 实际晶体的形态.pdf
- 《结晶学》课程教学资源(教案讲义)第六章 单形和聚形.pdf
- 《结晶学》课程教学资源(教案讲义)第五章 晶体定向与结晶符号.pdf
- 《结晶学》课程教学资源(教案讲义)第四章 晶体的宏观对称.pdf
- 《结晶学》课程教学资源(教案讲义)第三章 晶体的面角恒等和投影.pdf
- 《结晶学》课程教学资源(教案讲义)第二章 晶体生长的基本规律.pdf
- 《结晶学》课程教学资源(教案讲义)第一章 晶体与非晶体的概念.pdf
- 《结晶学与矿物学》课程教学资源(重点难点)根据晶体化学知识判断正反尖晶石结构.ppt
- 《结晶学与矿物学》课程教学资源(重点难点)结晶学重点知识.ppt
- 《结晶学与矿物学》课程教学资源(前沿进展)晶体生长先进工艺 Addendum - Plasmonic nanosensors with inverse sensitivity by means of enzyme-guided crystal growth.pdf
- 《结晶学与矿物学》课程教学资源(实验指导)实验十 晶体内部结构的对称要素及空间群.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验九 低级晶族的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验八 三方、六方晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验七 四方晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验六 等轴晶系的晶体定向.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验五 聚形分析.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验四 单形.ppt
- 《结晶学与矿物学》课程教学资源(实验指导)实验三 对称.ppt
