《物理化学》课程教学资源:物理化学 Physical Chemistry(简明版)各章习题与答案(第二版,共十章,天津大学物理化学教研室编)

第一章 气体的pVT性质 1.1 物质的体膨胀系数,与等温压缩率r的定义如下 1av 留。 试推出理想气体的,,xr与压力、温度的关系。 解:根据理想气体方程P广=RT 1.20℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。 解:将甲烷0M=16.042g/mol)看成理想气体:PV=RT,PV=mRT/M 甲烷在标准状况下的密度为=m/N=PM/RT =101.32516.042/8.3145273.15(kg/m) =0.716kg/m3 1.3一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。若改充以25℃, 13.33kPa的某碳氢化合物气体,则总质量为25.0163g。试估算该气体的摩尔质量。水的密度1g·cm 计算。 解:球形容器的体积为V=(125-25)g/1g.cm=100cm3 将某碳氢化合物看成理想气体:PV=nRT,PV=mRT/M, L=mRT/PV=(25.0163-25.0000)×8.314×298.15/(13330×100×10) Mw =30.31(g/mol) 1.4两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球 加热到100℃,另一个球则维持0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定:(2)两球中压力维持相同。 标准状态:p=101.325kPa,T=273.15K P101325kPa T273.15乐 15R 7315R
第一章 气体的 pVT 性质 1.1 物质的体膨胀系数 与等温压缩率 的定义如下 试推出理想气体的 , 与压力、温度的关系。 解:根据理想气体方程 1.2 0℃,101.325kPa 的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。 解:将甲烷(Mw=16.042g/mol)看成理想气体: PV=nRT , PV =mRT/ Mw 甲烷在标准状况下的密度为=m/V= PMw/RT =101 16.042/8.3145 15(kg/m3 ) =0.716 kg/m3 1.3 一抽成真空的球形容器,质量为 25.0000g 充以 4℃水之后,总质量为 125.0000g。若改充以 25℃, 13.33 kPa 的某碳氢化合物气体,则总质量为 25.0163g。试估算该气体的摩尔质量。水的密度 1g·cm 3 计算。 解:球形容器的体积为 V=(125-25)g/1 g.cm -3 =100 cm3 将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ Mw Mw= mRT/ PV=(25.0163-25.0000)×8.314×298.15/(13330×100×10 -6 ) Mw =30.31(g/mol) 1.4 两个容积均为 V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球 加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态:
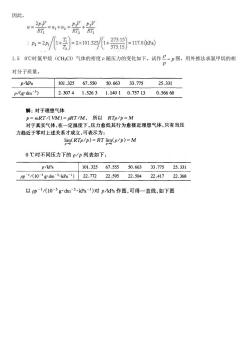
因此, "=2 RT 所%器 RT,RT =2+2×1012+7}7007 373.15 L.50℃时氯甲烷(CH,C)气体的密度p随压力的变化如下。试作P-p图,用外推法求氯甲烷的相 对分子质量。 p/kPa 101.32567.55050.66333.775 25.331 p/八gdm3) 2.30741.52631.14010.757130.56660 解:对于理想气体 p=mRT/(IM)=RT/M,所以RTp/p=M 对于真实气体,在一定温度下,压力愈低其行为愈接近理想气体,只有当压 力趋近于零时上述关系才成立,可表示为: lim(RTp/p)=RT lim(p/p)=M 0℃时不同压力下的p/p列表如下: p/kPa 101.32567.55550.66333.77525.331 p1《103gd3kPa)2.7222.5952.5042.4172.368 以pl/(10-3gdm3.kPa1)对pkPa作图,可得一直线,如下图
因此, 1.5 0℃时氯甲烷(CH3Cl)气体的密度ρ随压力的变化如下。试作 p p 图,用外推法求氯甲烷的相 对分子质量
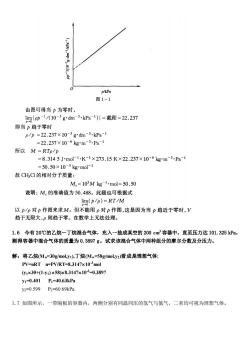
p/kPa 图1-1 由图可得当力为零时, limip-1/10-3gdm3.kPal)1=截距=22.237 即当力趋于零时 p/p=22.237×10-3gdm3.kPa-l =22.237×106kg*m3.Pa1 所以M=RTp/p =8.3145J小mol1.K-1×273.15K×22.237×10-6kgm3.Pa-1 =50.50×10-3 kg'mol-11 故CHC的相对分子质量: M,=103Mkg1mol=50.50 说明:M,的准确值为50.488。此题也可根据式 lim(p/p)=RT/M 以p/P对p作图来求M。但不能用p对p作图,这是因为当p趋近于零时,V 趋于无限大,则趋于零。在数学上无法处理。 1.6今有20℃的乙烷-丁烷混合气体,充入一抽成真空的200cm容器中,直至压力达101.325kPa, 测得容器中混合气体的质量为0.3897g。试求该混合气体中两种组分的摩尔分数及分压力。 解:将乙烷Mw=30 g/moL.y1).丁烷(Mw=58 z/moL.y2)看成是理想气体: PV=nRT n=PV/RT=8.3147x103mol y1×30+1-y1)×58)x8.3147×103=0.3897 y1=0.401 P1=40.63kPa y2=0.599P2=60.69kPa 1.7如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体
1.6 今有 20℃的乙烷-丁烷混合气体,充入一抽成真空的 200 cm3 容器中,直至压力达 101.325 kPa, 测得容器中混合气体的质量为 0.3897 g。试求该混合气体中两种组分的摩尔分数及分压力。 解:将乙烷(Mw=30g/mol,y1),丁烷(Mw=58g/mol,y2)看成是理想气体: PV=nRT n=PV/RT=8.314710 -3mol (y130+(1-y1) 58)8.314710 -3 =0.3897 y1=0.401 P1=40.63kPa y2=0.599 P2=60.69kPa 1.7 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体

3 dm 1 dm (1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试 求两种气体混合后的压力。 (2) 隔板抽取前后,H及N的摩尔体积是否相同? (3) 隔板抽取后,混合气体中H及的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 之g+TP+D】R2 a,+丁 +)P 即在上述条件下混合,系统的压力认为P。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 r但2)=3dm3,r0N2)=1dm3 对于分压 名月 p但2pN2)=3:1 1.8 氯乙烯、氯化氢及乙烯构成的混合气体,各组分的摩尔分数分别为 0.89,0.09及0.02。在恒定压力101.325kPa下,用水吸收掉其中的氯化氢气
(1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试 求两种气体混合后的压力。 (2) 隔板抽取前后,H2及 N2的摩尔体积是否相同? (3) 隔板抽取后,混合气体中 H2及 N2的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 即在上述条件下混合,系统的压力认为 。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 对于分压 1.8

体,所得的混合气体中增加了压力为2.670kPa的水蒸气。试求洗涤后混合气 体中氯乙烯和乙烯的分压力。 解:以A,B和D分别代表氯乙烯、乙烯和水蒸气。洗涤后总压力p= 101.325kPa,水蒸气的分压pD=2.670kPa。 nA/nB=0.89/0.02 na/八nA+nB)=0.89/(0.89+0.02)=0.890.91 pA+pB=p-pD=(101.325-2.670)kPa=98.655kPa 对于混合气体压力之比等于物质的量之比,故 pA=(p-D)nA/八nA+nB) =98.655kPa×0.89/0.91 =96.487kPa PB=p-(PA+PD) =101.325kPa-(96.487+2.670)kPa =2.168kPa 1.9室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如 下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内 最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压,混合气体的摩尔分数不变。 设第一次充氮气前,系统中氧的摩尔分数为0,),充氨气后,系统中氧的摩尔分数为4O,), 则,片(O,)x4p=0)×p→h(O,)=O,4。重复上面的过程,第n次充氮气后,系统的摩尔分数 为 y(O2)=y1O2)/4=02)/4 因此 3(02)=y02)/43=0.313% 1.1025℃时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压) 总压力为138.7kP,于恒定总压下冷却到10℃,使部分水蒸气凝结为水。试求每摩尔干乙炔气在该冷 却过程中凝结出水的物质的量。已知25℃及10℃时水的饱和蒸气压分别为3.17kPa及1.23kPa。 解:该过程图示如下
1.9 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如 下:向釜内通氮气直到 4 倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内 最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压 p,混合气体的摩尔分数不变。 设第一次充氮气前,系统中氧的摩尔分数为 ,充氮气后,系统中氧的摩尔分数为 , 则, 。重复上面的过程,第 n 次充氮气后,系统的摩尔分数 为 , 因此 。 1.10 25℃时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压) 总压力为 138.7 kPa,于恒定总压下冷却到 10℃,使部分水蒸气凝结为水。试求每摩尔干乙炔气在该冷 却过程中凝结出水的物质的量。已知 25℃及 10℃时水的饱和蒸气压分别为 3.17 kPa 及 1.23 kPa。 解:该过程图示如下

acety lene I mol acetylene I mol 1=29w.15k T=28815K p=138.7 kPa D=1387P1 风02)=3.17 0)=123kn 设系统为理想气体混合物, 0)=20) O2) pn(C,H)+n(,) n0,))=p04C,耳2) p-p(O2) 4o,)=C,H,pO)-P@)] p-pI(O2)p-p2(02) CH2)=1mol,p=138.8kPap1(O)=3.17a,p2(0,)=1.23kPa 3.17 1.23 0,)=11388-3171388-120.0144mol 1.11有某温度下的2d血湿空气,其压力为101.325kPa,相对湿度为60%。设空气中02与N的体积分数 分别为0.21与0.79,求水蒸气、0,与N:的分体积。已知该温度下水的饱和蒸汽压为20.55kPa(相对湿 度即该温度下水蒸气的分压与水的饱和蒸汽压之比)。 1.12一密闭刚性容器中充满了空气,并有少量的水。但容器于300K条件下大平衡时,容器内压力为 101.325kPa。若把该容器移至373.15K的沸水中,试求容器中到达新的平衡时应有的压力。设容器中 始终有水存在,且可忽略水的任何体积变化。300K时水的饱和蒸气压为3.567kPa 解:将气相看作理想气体,在300K时空气的分压为 p1(ar)=p1-p但20,300K) 由于体积不变(忽略水的任何体积变化),373.15K时空气的分压为 nm)-2A6m)-7501325-3567=12155a 300 由于容器中始终有水存在,在373.15K时,水的饱和蒸气压为101.325kP,系统中水 蒸气的分压为101.325kPa,所以系统的总压 P2=P2(m)+p但20,373.15K)=121.595+101.325=222.92kPa
设系统为理想气体混合物, 则 1.11 有某温度下的 2dm3湿空气,其压力为 101.325kPa,相对湿度为 60%。设空气中 O2与 N2的体积分数 分别为 0.21 与 0.79,求水蒸气、O2与 N2的分体积。已知该温度下水的饱和蒸汽压为 20.55kPa(相对湿 度即该温度下水蒸气的分压与水的饱和蒸汽压之比)。 1.12 一密闭刚性容器中充满了空气,并有少量的水。但容器于 300 K 条件下大平衡时,容器内压力为 101.325 kPa。若把该容器移至 373.15 K 的沸水中,试求容器中到达新的平衡时应有的压力。设容器中 始终有水存在,且可忽略水的任何体积变化。300 K 时水的饱和蒸气压为 3.567 kPa。 解:将气相看作理想气体,在 300 K 时空气的分压为 由于体积不变(忽略水的任何体积变化),373.15 K 时空气的分压为 由于容器中始终有水存在,在 373.15 K 时,水的饱和蒸气压为 101.325 kPa,系统中水 蒸气的分压为 101.325 kPa,所以系统的总压

1.13C0,气体在40℃时的摩尔体积为0.381dm·mol1。设C0,为范德华气体,试求其压力,并比较 与实验值5066.3kPa的相对误差。 解:C02(g)的范德华常数a=0.3640Pa·m5·mol-2, b=0.4267×10-4m3·mol-1 (p+a/Pm2)(Vm-b)=RT P =RT/(Vm-b)-a/V ={8.314×313.15/(0.381×10-3-0.4267×10-) -0.3640/(0.381×10-3)2Pa=5187.7kPa 相对误差:E=D(计算) 一p(实测2×100% P(实测) -5187.7506.3×100%=2.40% 5066.3 B>0,说明在题给条件下的C0z(g)比范德华气体更易于被 压缩。 1.14今有0℃,40.530kPa的N气体,分别用理想气体状态方程及van der Waals方程计算其摩尔体 积。实验值为70.2cm3.mol-1 解:用理想气体状态方程计算 么-T_83Ax27315=560x10n2ll=560em2al D 40530×103 用van der Waals计算,查表得知,对于N气(附录七) a=140.8×103Pam6.mol2,b=39.13x106m3.mo1-1 〔+员收- ,用MatLab fzero函数求得该方程的解为 7。=73.08cm3,mol4 也可以用直接迭代法, 么b+e+员取初雅 7=39.13×10m2,ml-,迭代十次结果%=73.08cm3.mol 1.5试由波义尔温度TB的定义式,证明范德华气体的TB可表示为Tp-a/bR)
1.13 CO2 气体在 40℃时的摩尔体积为 0.381 dm3·mol-1。设 CO2为范德华气体,试求其压力,并比较 与实验值 5066.3 kPa 的相对误差。 1.14 今有 0℃,40.530 kPa 的 N2气体,分别用理想气体状态方程及 van der Waals 方程计算其摩尔体 积。实验值为 。 解:用理想气体状态方程计算 用 van der Waals 计算,查表得知,对于 N2气(附录七) ,用 MatLab fzero 函数求得该方程的解为 也可以用直接迭代法, ,取初值 ,迭代十次结果 1.15 试由波义尔温度 TB的定义式,证明范德华气体的 TB可表示为 TB=a/(bR)

式中a,b为范德华常数。 证:当T=TB时任一真实气体有 limla(pvm)/aplT=0 范德华方程可表示为 pVm=RTVm/(Vm-b)-a/Vm 上式在T=TB下对p微分可得 JT +喷%。 = 在T=Ts下,当压力趋于零时,上式中的(3VmBp)r,≠0,故必然存在 RTB八Vm-b)-RTB Vm八Vm-b)2+a/Va=0 由上式可得 a/Vi =RTB Vm/(Vm-b)2-RTB/(Vm-b) =bRTB/(Vm-b)2 TB =(a/bR)(Vm-b)2/V 当p+0时,Vm→∞,(Vm-b)2=V2,故 TB=a/bR 1.16把25℃的氧气充入40dm的氧气钢瓶中,压力达202.7×10kPa。试用普遍化压缩因子图求钢瓶中 氧气的质量。 解:氧气的T=-118.57℃,P=5.043MPa 氧气的T=298.15/(273.15-118.57)=1.93,P,=20.27/5.043=4.02 ≥0.95 PV=ZnRT n=PV/ZRT=202.7×103×40×10/(8.314×298.15)/0.95=344.3(mo1) 氧气的质量m=344.3×32/1000=11(kg) 第二章热力学第一定律 2.1 1mo1水蒸气(:0,g)在100℃,101.325kPa下全部凝结成液态水。求过程的功。假设:相对于水蒸 气的体积,液态水的体积可以忽略不计。 解:n=1mol H2O(g 10c10132gH00 恒温恒压相变过程,水蒸气可看作理想气体, W=-p△V=-p(W-V.)≈pVg=nRT=3.102kJ
式中 a,b 为范德华常数。 1.16 把 25℃的氧气充入 40dm3的氧气钢瓶中,压力达 202.7×10 2 kPa。试用普遍化压缩因子图求钢瓶中 氧气的质量。 解:氧气的 TC=-118.57℃,PC=5.043MPa 氧气的 Tr=298.15/(273.15-118.57)=1.93, Pr=20.27/5.043=4.02 Z=0.95 PV=ZnRT n=PV/ZRT=202.7×10 5×40×10 -3 /(8.314×298.15)/0.95=344.3(mol) 氧气的质量 m=344.3×32/1000=11(kg) 第二章 热力学第一定律 2.1 1mol 水蒸气(H2O,g)在 100℃,101.325kPa 下全部凝结成液态水。求过程的功。假设:相对于水蒸 气的体积,液态水的体积可以忽略不计。 解: n = 1mol 恒温恒压相变过程,水蒸气可看作理想气体, W =-pambΔV =-p(Vl-Vg ) ≈ pVg = nRT = 3.102kJ

2.2始态为25℃,200kPa的5mol某理想气体,经途径a,b两不同途径到达相同的末态。途经a先 经绝热膨胀到-28.47℃,10kPa,步骤的功网=-557女:再恒容加热到压力200kPa的末态,步 骤的热Q=2542d。途径b为恒压加热过程。求途径b的网及8。 解:先确定系统的始、末态 5 mol n=5 mol =5 mol 1h=244.58 B=200a p2=100 kPa 对于途径b,其功为 R=-P1AV=-P1× -网)-至-) P2 P1 p2 p) R=-5×8.314×200×103× 244.5829825 =7.940k灯 100×103200×10 根据热力学第一定律 网+Q=R+Q Q=m+Q-m=-5.57+25.42-(-7.940)=27.79k灯 2.3某理想气体C=1.5R。今有该气体5mol在恒容下温度升高50℃。求过程的W,Q,△H和△U。 解:理想气体恒容升温过程n=5mol C.=3/2R Q=AU=nC.△T=5×1.5R×50=3.118kJ W=0 △H=△U+nR△T=nCn.△T =n(C+R)△T=5X2.5RX50=5.196kJ 2.42mol某理想气体,C=7/2R。由始态100kPa,50dm,先恒容加热使压力升高至200kPa,再恒压冷 却使体积缩小至25恤。求整个过程的W,Q,△H和△U. 解:过程图示如下 n=2 mol 容 恒压 p:-100 kPa =200kPa =50 dm3 =50dm
2.2 始态为 25℃,200 kPa 的 5 mol 某理想气体,经途径 a,b 两不同途径到达相同的末态。途经 a 先 经绝热膨胀到 -28.47℃,100 kPa,步骤的功 ;再恒容加热到压力 200 kPa 的末态,步 骤的热 。途径 b 为恒压加热过程。求途径 b 的 及 。 解:先确定系统的始、末态 对于途径 b,其功为 根据热力学第一定律 2.3 某理想气体 Cv,m=1.5R。今有该气体 5mol 在恒容下温度升高 50℃。求过程的 W,Q,ΔH 和 ΔU。 解: 理想气体恒容升温过程 n = 5mol CV,m = 3/2R QV =ΔU = n CV,mΔT = 5×1.5R×50 = 3.118kJ W = 0 ΔH = ΔU + nRΔT = n Cp,mΔT = n (CV,m+ R)ΔT = 5×2.5R×50 = 5.196kJ 2.4 2mol 某理想气体,Cp,m=7/2R。由始态 100kPa,50dm3,先恒容加热使压力升高至 200kPa,再恒压冷 却使体积缩小至 25dm3。求整个过程的 W,Q,ΔH 和 ΔU。 解:过程图示如下

由于P=P,则3=T,对有理想气体△H和△U只是温度的函数 △H=AU=0 该途径只涉及恒容和恒压过程,因此计算功是方便的 W=-pm△V=-P34V=-200×103×25×103-50×103) =5.00kJ 根据热力学第一定律 =△-W=0-5.00=-5.00k 2.51mol某理想气体于27℃、101.325kPa的始态下,现受某恒定外压恒温压缩至平衡态,再恒容升温 至97.0℃、250.00kPa。求过程的W、Q、△U、△H。已知气体的C.=20.92JKmo1. 解:n=lmol理想气体 =27c 座片罗尚品 (1) =V, W=-P4△P=-P化-)=(P,3-P,) f会别 县别 W2=0 W=W+W2=17740U △U=mC,(2-1)=1x20.92(97-27)J=1464J △=mC(6-41)=nC,+R4-4)=1x(8.314+20.92)x(97-27)=2046J Q=△U-W=1464-17740J=-16276J 2.6已知C0(g)的Cp.m=126.75+42.258×10-3(TK)-14.25× 10-6(TK)2Jmol1.K-1 (1)求300K至800K间C02(g)的平均摩尔定压热容C,m: (2)求1kg常压下CO2(g)从300K恒压加热到800K时所需的热Q
由于 ,则 ,对有理想气体 和 只是温度的函数 该途径只涉及恒容和恒压过程,因此计算功是方便的 根据热力学第一定律 2.5 1mol 某理想气体于 27℃、101.325kPa 的始态下,现受某恒定外压恒温压缩至平衡态,再恒容升温 至 97.0℃、250.00 kPa。求过程的 W、Q、△U、△H。已知气体的 CV,m=20.92 J·K·mol-1。 2.6
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学资源:物理化学 Physical Chemistry(简明版)教材PDF电子版(第二版,共十章,天津大学物理化学教研室编).pdf
- 清华大学出版社:《物理化学》课程书籍教材(上下册)PDF电子版(上下册共十二章,编著:朱文涛).pdf
- 广东工业大学:《物理化学》课程教学资源(练习题解)第十章 胶体化学.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第十章 胶体化学(PPT).ppt
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第九章 化学动力学(PPT).ppt
- 广东工业大学:《物理化学》课程教学资源(文献资料)外压法推导开尔文公式的探究.pdf
- 广东工业大学:《物理化学》课程教学资源(文献资料)表面过剩及吉布斯吸附等温式的探讨.pdf
- 广东工业大学:《物理化学》课程教学资源(练习题解)第八章 表面现象.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第八章 界面现象.pdf
- 广东工业大学:《物理化学》课程教学资源(文献资料)液体接界电势公式分析.pdf
- 广东工业大学:《物理化学》课程教学资源(练习题解)第七章 电化学.doc
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第七章 电化学(PPT).ppt
- 广东工业大学:《物理化学》课程教学资源(练习题解)第六章 相平衡.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第六章 相平衡.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第五章 化学平衡.pdf
- 广东工业大学:《物理化学》课程教学资源(文献资料)偏摩尔性质的图示分析.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第四章 多组分系统热力学.pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第三章 热力学第二定律.pdf
- 广东工业大学:《物理化学》课程教学资源(文献资料)化学反应焓的图解分析(胡光辉).pdf
- 广东工业大学:《物理化学》课程教学资源(课件讲稿)第二章 热力学第一定律.pdf
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 1 Introduction Medicinal Chemistry(授课教师:阮科).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 2a Drug screening & discovery(design).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 2b 先导化合物优化 Lead Optimization.ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 3a 药代动力学PKPD(DMPK).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 3b 前体药物 Prodrug.ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 4 药物的构效关系(SAR).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 6 心血管药物 Cardiovascular Drugs.ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 5 癌症 Cancer(1/2).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 7 作用神经系统的药物(中枢神经系统 CNS).ppt
- 中国科学技术大学:《药物化学》课程教学资源(PPT课件讲稿)Chapter 5 癌症 Cancer(2/2).ppt
- 《药物化学》课程文献资料(Medicinal Chemistry)Name of common cyclic compounds.docx
- 《药物化学》课程文献资料(Medicinal Chemistry)Clinical efficacy of a RAF inhibitor needs broad target blockade in BRAF-mutant melanoma.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Discovery of a selective inhibitor of oncogenic B-Raf kinase with potent antimelanoma activity.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Prioritization of cancer therapeutic targets using CRISPR–Cas9 screens.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Structural basis for inhibition of a voltage-gated Ca2+ channel by Ca2+ antagonist drugs.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Structural Mechanism for Statin Inhibition of HMG-CoA Reductase.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Application of the Three-Dimensional Structures of Protein Target Molecules in Structure-Based Drug Design.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Epigenetic protein families - a new frontier for drug discovery.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)GLIVEC(STI571, IMATINIB),A RATIONALLY DEVELOPED,TARGETED ANTICANCER DRUG,Nat Rev Drug Disc 2002.pdf
- 《药物化学》课程文献资料(Medicinal Chemistry)Personalized medicine in oncology - the future is now.pdf
