华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(3/4)

8.4 滴定曲线(1) 氧化还原滴定反应的滴定曲线一般通过 实验方法测得,也可根据能斯特方程进行理 论计算。 氧化还原滴定曲线以电对的电极电位为 纵坐标,横坐标为标准溶液体积(或相对于 终点体积滴定的百分数)。值得注意的是, 滴定曲线起始点并不在纵坐标上,这与其他 几类滴定曲线有所不同
8.4 滴定曲线(1) 氧化还原滴定反应的滴定曲线一般通过 实验方法测得,也可根据能斯特方程进行理 论计算。 氧化还原滴定曲线以电对的电极电位为 纵坐标,横坐标为标准溶液体积(或相对于 终点体积滴定的百分数)。值得注意的是, 滴定曲线起始点并不在纵坐标上,这与其他 几类滴定曲线有所不同
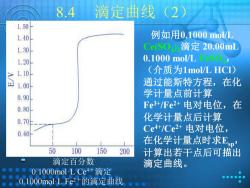
8.4 滴定曲线(2) 1.50 1.40 例如用0.1000mol/L 1.30 CeS0)2滴定20.00mL 1.20 0.1000 mol/L, 31.10 (介质为1 mol/L HCI) 合1.00 通过能斯特方程,在化 0.90 学计量点前计算 0.80 Fe3+Fe2+电对电位,在 0.70日 化学计量点后计算 0.60 Ce4+/Ce2+电对电位, 在化学计量点时求卫p' 50 100 150 200 计算出若干点后可描出 滴定百分数 滴定曲线。 01000 mol-L Ce4+滴定 0.1000 mol L Fe2+的滴定曲线
8.4 滴定曲线(2) 例如用0.1000 mol/L Ce(SO4 ) 2滴定 20.00mL 0.1000 mol/L FeSO4, (介质为1mol/L HCl) 通过能斯特方程,在化 学计量点前计算 Fe3+/Fe2+ 电对电位,在 化学计量点后计算 Ce4+/Ce2+ 电对电位, 在化学计量点时求Esp, 计算出若干点后可描出 滴定百分数 滴定曲线。 0.1000mol·L Ce 4+滴定 0.1000mol·L Fe2+的滴定曲线

1、滴定曲线的绘制 下面就以0.1000 mol/L Ce(SO4)2滴定 20.00mL0.1000mol/LFeS04,(介质为 1mol/LHC1)为例说明可逆的、对称的氧 化还原电对的滴定曲线。 滴定反应为: 滴定开始后,溶液中存在两个电对,根据 能斯特方程式,两个电对的电极电位分别 为:
1、滴定曲线的绘制 • 下 面 就 以 0 . 1000 mol/L Ce(SO4 ) 2 滴 定 20.00mL 0.1000 mol/L FeSO4,(介质为 1mol/L HCl)为例说明可逆的、对称的氧 化还原电对的滴定曲线。 • 滴定反应为: • 滴定开始后,溶液中存在两个电对,根据 能斯特方程式,两个电对的电极电位分别 为:

1、滴定曲线的绘制(2) Pre+1Fe=p*2+0.0591g Fe3 Fe3+/Fe2+ 0.68 C Pco/co=c+0.0591g Ce4+ Ce3+ =1.44/
1、滴定曲线的绘制(2)

1、滴定曲线的绘制(3) 在滴定过程中,每加入一定量滴定剂, 反应达到一个新的平衡,此时两个电对 的电极电位相等,即 因此,溶液中各平衡点的电位可选用便 于计算的任何一个电对来计算
1、滴定曲线的绘制(3) • 在滴定过程中,每加入一定量滴定剂, 反应达到一个新的平衡,此时两个电对 的电极电位相等,即 • 因此,溶液中各平衡点的电位可选用便 于计算的任何一个电对来计算。 3+ 2+ = 4+ 3+ Fe / Fe Ce /Ce

1、滴定曲线的绘制(4) 化学计量点前,溶液中存在未被氧化的F©+,滴定 过程中电极电位的变化可根据Fe3Fe2+电对计算: PreIre=+0.0591g CFe 如反应率为99%时,即剩余[Fe2+]=1%,[Fe3+]=99% 99% 9re*1Fe+=0.68+0.059lg =0.80V 1% 此时,9reB+yre2+,值随溶液中的[Fe3+]IFe2]的改变 而变化。 0000000
• 化学计量点前,溶液中存在未被氧化的Fe 2+ ,滴定 过程中电极电位的变化可根据 Fe3+/Fe2+电对计算: • 此时,φFe(3+)/Fe(2+)值随溶液中的[Fe 3+]/[Fe2+]的改变 而变化。 V Fe Fe c c F e F e F e F e F e F e F e F e 0.80 1% 99% 0.68 0.059 lg 99% , [ ] 1%,[ ] 99% 0.059 lg 3 2 2 3 2 / 3 2 3 / 2 3 ' / = + = = = = + + + + + + + + + + + 如反应率为 时 即剩余 1、滴定曲线的绘制(4)

1、滴定曲线的绘制(5) 化学计量点后,加入了 过量Ce4+的,因此可利 用Ce4+/Ce3+电对来计算: 此时, Ce4+/C+ 9oc+0059leC2 液中的[Ce4+]/ICe3]的 改变而变化
1、滴定曲线的绘制(5) • 化学计量点后,加入了 过量Ce 4+的,因此可利 • 用Ce4+ /Ce3+电对来计算: • 此时,φCe(4+)/Ce(3+)值随溶 液中的[Ce 4+]/[Ce3+]的 改变而变化。 + + + + + + = + 3 4 4 3 3 / 4 ' 0.059lg / Ce Ce Ce Ce C C C e C e

1、滴定曲线的绘制(6) 化学计量点时,[Ce4]=[Fe2],[Ce3]=Fe3] 且由于反应达到平衡时两电对的电位相等,故 可以联系起来计算。 0g=0rFe=p”+0.059g 0g=0ce*1ce=0cc+0.0591g C ce C e3+ 对一般的可逆对称氧化还原反应,其化学计量 点可用相似上式来计算。 00000
• 化学计量点时,[Ce 4+ ]=[Fe2+ ],[Ce3+ ]=[Fe3+ ]。 且由于反应达到平衡时两电对的电位相等,故 可以联系起来计算。 • 对一般的可逆对称氧化还原反应,其化学计量 点可用相似上式来计算。 + + + + + + + + + + + + = = + = = + 3 4 3 / 4 3 4 2 3 2 / 3 2 3 0.059lg 0.059lg ' / ' / Ce Ce Ce Ce eq F e F e F e F e eq c c c c C e C e Fe Fe 1、滴定曲线的绘制(6)

1、滴定曲线的绘制 (7) 两式相加得: 20g=p1+0c*e+0.059lg Ce3+ 由于Cce=Cre+,Ccw=Cne, petiF2 =0.68,0e=1.447 故 20g=0.68+1.44+0.0591g1 0g=1.06y 0000000
• 两式相加得: V V V c c c c c c c c eq eq Ce F e Ce F e F e Ce F e Ce eq Fe Fe C e C e Fe Fe C e C e 1.06 2 0.68 1.44 0.059lg1 0.68 , 1.44 , , 2 0.059lg 3 / 2 4 / 3 4 2 3 3 2 3 3 4 3 / 2 4 / 3 ' ' ' ' = = + + = = = = = + + + + + + + + + + + + + + + + + + 故 由于 1、滴定曲线的绘制(7)

1、滴定曲线的绘制(8) 化学计量点前后电位突跃的位置由Fε2+剩 余0.1%和Ce4+过量0.1%时两点的电极电 位所决定。即电位突跃 99.9% 由 0r*1rm=0.68+0.0591g = 0.86/ 0.1% 到 0.1% Pces/ce=p cc+0.0591g =1.26V 100%
• 化学计量点前后电位突跃的位置由Fe2+剩 余0.1%和Ce4+过量0.1%时两点的电极电 位所决定。即电位突跃 V V Ce Ce C e C e F e F e 1.26 100% 0.1% 0.059lg 0.86 0.1% 99.9% 0.68 0.059lg 3 / $ 3 $ 3 2 ' / / = + = = + = + + + + + + 到 由 1、滴定曲线的绘制(8)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(2/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(1/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(7/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(6/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(5/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(4/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(3/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(2/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(1/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(3/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(2/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(1/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.5 滴定误差 5.6 酸碱滴定法的应用.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.3 强酸滴定弱碱 5.4.4 强碱滴定多元酸 5.4.5 强碱滴定混合酸 5.4.6 强酸滴定多元碱.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.2 强碱滴定弱酸.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.1 强酸强碱相互滴定.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第四章 重量分析法(2/2).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第四章 重量分析法(1/2).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(6/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(5/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(4/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(1/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(2/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(3/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(4/4).ppt
- 海南大学:《有机化学》课程授课教案(化学工程与工艺,授课教师:陈祎平).doc
- 海南大学:《有机化学》课程教学大纲(适用专业:化学工程与工艺).pdf
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)化学分析教案.doc
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)分析化学教案(药学、制药).doc
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)药学仪器分析教案.doc
- 哈尔滨商业大学:《分析化学》课程教学课件(PPT讲稿)分析化学实验(共八个).ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第一章 分析化学概论.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第二章 误差与分析数据.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第三章 滴定分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第四章 酸碱滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第五章 氧化还原滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第六章 沉淀滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第七章 重量分析法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第八章 吸光光度法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第十章 核磁共振波谱分析.ppt
