哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第七章 重量分析法

第7章重量分析法 7.1概述 7.2沉淀的溶解度及其影响因素 7.3沉淀的形成 7.4沉淀的纯度 7.5沉淀的条件和称量形的获得 7.6有机沉淀剂的应用
第7章 重量分析法 7.1 概述 7.2 沉淀的溶解度及其影响因素 7.3 沉淀的形成 7.4 沉淀的纯度 7.5 沉淀的条件和称量形的获得 7.6 有机沉淀剂的应用

7.1概述 通过称量物质的质量进行分析的方法。 测定时,通常先用适当的方法使被测组分与 其他组分分离,然后称重,由称得的质量计算 该组分的含量。 7.1.1重量分析法的分类和特点 优点:E:0.1~0.2%,准,不需标液 缺点:慢,繁琐 测P,S,Si,Ni等的仲裁分析仍用重量法
7.1 概述 ——通过称量物质的质量进行分析的方法。 测定时,通常先用适当的方法使被测组分与 其他组分分离,然后称重,由称得的质量计算 该组分的含量。 优点: Er : 0.1~0.2%,准,不需标液. 缺点:慢,繁琐. 测P,S,Si,Ni 等的仲裁分析仍用重量法. 7.1.1 重量分析法的分类和特点

重量法的分类 1.挥发法一利用物质的挥发性质,通过加热或其 他方法使待测组分从试样中挥发逸出. 2. 电解法一利用电解的方法使待测金属离子在电 极上还原析出,然后称重,电极增加的质量即为 金属质量.(例如,测Cu2+) 3.沉淀法一利用沉淀反应使待测组分以微溶化合 物的形式沉淀出来,再使之转化为称量形式称量:
重量法的分类 1. 挥发法—利用物质的挥发性质,通过加热或其 他方法使待测组分从试样中挥发逸出. 2. 电解法—利用电解的方法使待测金属离子在电 极上还原析出,然后称重,电极增加的质量即为 金属质量.(例如,测Cu2+) 3. 沉淀法—利用沉淀反应使待测组分以微溶化合 物的形式沉淀出来,再使之转化为称量形式称量
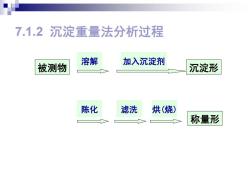
7.1.2沉淀重量法分析过程 溶解 加入沉淀剂 被测物 沉淀形 陈化 滤洗 烘(烧) 称量形
7.1.2 沉淀重量法分析过程 被测物 沉淀形 称量形 溶解 加入沉淀剂 陈化 滤洗 烘(烧)

对沉淀形的要求 沉淀的S要小,溶解损失应<0.1mg; 沉淀的纯度高; 沉淀的晶形要好,便于过滤和洗涤, 对称量形的要求 组成恒定;稳定;摩尔质量大(对少量组分)· 为便于操作,晶形沉淀<0.5g,胶状沉淀≈0.2g
对沉淀形的要求 沉淀的S 要小,溶解损失应< 0.1mg; 沉淀的纯度高; 沉淀的晶形要好,便于过滤和洗涤. 对称量形的要求 组成恒定;稳定;摩尔质量大(对少量组分). 为便于操作, 晶形沉淀< 0.5g, 胶状沉淀≈0.2g

7.2沉淀的溶解度及其影响因素 7.2.1溶解度与溶度积 MA(固)二MA(水)二M++A M+A MA水:固有溶解度(分子溶解度),用S表示 溶解度:S=S+M]=S+[A] HgCl2 0.25mol-L-1 Hg2+]=1.7×105moL K- a(M)a(A) a(MA)水 K=a(M)a(A) 0 活度积常数,只与t有关
7.2 沉淀的溶解度及其影响因素 7.2.1 溶解度与溶度积 MA(固) MA(水) M++A- [MA]水: 固有溶解度(分子溶解度),用S 0表示 溶解度: S=S 0+[M+ ]=S 0+[A- ] M (A ) + - = (MA) a a K a 水 ( ) HgCl2 0.25mol·L-1 [Hg2+]=1.7×10-5mol·L- 1 S 0 =a(M) ·a(A) 活度积常数, 只与t 有关 sp K M+A-

MA-M+A 溶度积与条件溶度积 K.p=IMIIA]-4(M)(A) yM)·y(A)y(M)·Y(A) 溶度积常数,与t、I有关 K 'Sp=IM'IIA'J=[M]OMIA]&A=Ksp M &A 条件溶度积常数,与条件有关 K”>Kp>KpMA:S=√Kp MA2:KIM'IIA'P-Ksp aMd S=Ksp/4 MAn?
溶度积与条件溶度积 M ´ A ´ MA=M . + . A K´ sp =[M´ ][A´ ]=[M]M[A] A=Ksp M A 条件溶度积常数, 与条件有关 MmAn? sp MA : S K = 溶度积常数,与t、I 有关 sp sp (M) (A) [M][A] (M) (A) (M) (A) a K K a = = = KKK sp sp sp ´ 3 sp S K = / 4 MA2 : =[M´ ][A´] 2 K sp =Ksp M A 2
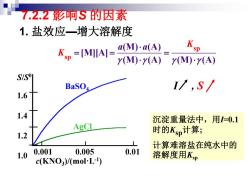
7.2.2影响S的因素 1.盐效应一增大溶解度 Ksp =[MJIA]= a(M)a(A) (M)Y(A)y(M)·y(A) S/SO BaSO I/,S/ 1.6 沉淀重量法中,用=0.1 1.2 时的Ksp计算; 计算难溶盐在纯水中的 1.0 0.001 0.005 0.01 c(KNO3)/(molL-1) 溶解度用Ksp
7.2.2 影响S 的因素 1. 盐效应—增大溶解度 S/S 0 1.6 1.4 1.2 1.0 0.001 0.005 0.01 c(KNO3 )/(mol·L-1 ) BaSO4 AgCl I , S sp sp (M) (A) [M][A] (M) (A) (M) (A) a K K a = = = 沉淀重量法中,用I=0.1 时的Ksp计算; 计算难溶盐在纯水中的 溶解度用Ksp

2.同离子效应一减小溶解度 加过量沉淀剂是降低溶解度的最方便有效 的办法. 例:测S042- 若加入n(Ba2+)=n(S042-) =300mL S=√Kp=V6x100=2.4×105m0lL m(BaS04)=2.4×10-5×300×233.4=1.7mg 若加入过量Ba2+,[Ba2+]=0.01moL1 S=[S042]=Ks/Ba2+]=6×10-10/0.01=6×10-8moL1 mBaS04)=6×10-8×300X233.4=0.004mg
2. 同离子效应—减小溶解度 加过量沉淀剂是降低溶解度的最方便有效 的办法. 例: 测SO4 2- 若加入n(Ba2+)=n(SO4 2- ) V=300 mL -10 -5 -1 sp S K = = 6 10 = 2.4 10 mol L m(BaSO4 )=2.4×10-5×300×233.4=1.7mg 若加入过量Ba2+, [Ba2+]=0.01mol·L-1 S=[SO4 2- ]=Ksp/[Ba2+]=6×10-10/0.01=6×10-8 mol·L-1 m(BaSO4 )=6×10- 8×300×233.4=0.004mg
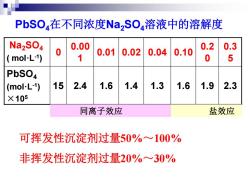
PbSO,在不同浓度NaSO,溶液中的溶解度 Na2SO4 0.00 0.2 0.3 0.01 mol-L-1) 0.02 0.04 0.10 1 0 5 PbSO4 (mol-L-1) 15 2.4 1.6 1.4 1.3 1.6 1.9 2.3 X105 同离子效应 盐效应 可挥发性沉淀剂过量50%~100% 非挥发性沉淀剂过量20%一30%
PbSO4在不同浓度Na2SO4溶液中的溶解度 Na2SO4 ( mol·L-1 ) 0 0.00 1 0.01 0.02 0.04 0.10 0.2 0 0.3 5 PbSO4 (mol·L-1 ) ×105 15 2.4 1.6 1.4 1.3 1.6 1.9 2.3 盐效应 可挥发性沉淀剂过量50%~100% 非挥发性沉淀剂过量20%~30% 同离子效应
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第六章 沉淀滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第五章 氧化还原滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第四章 酸碱滴定法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第三章 滴定分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第二章 误差与分析数据.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第一章 分析化学概论.ppt
- 哈尔滨商业大学:《分析化学》课程教学课件(PPT讲稿)分析化学实验(共八个).ppt
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)药学仪器分析教案.doc
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)分析化学教案(药学、制药).doc
- 哈尔滨商业大学:《分析化学》课程教学课件(授课教案)化学分析教案.doc
- 海南大学:《有机化学》课程教学大纲(适用专业:化学工程与工艺).pdf
- 海南大学:《有机化学》课程授课教案(化学工程与工艺,授课教师:陈祎平).doc
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(4/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(3/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(2/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第九章 定量分析中的分离及富集方法(1/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(4/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(3/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(2/4).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第八章 氧化还原滴定法(1/4).ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业)第八章 吸光光度法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第十章 核磁共振波谱分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第十一章 质谱分析(Mass Spectrometry, MS).ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第十二章 试样前处理新技术.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第一章 绪论.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第二章 电位分析法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第三章 紫外-可见吸收光谱分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第四章 原子吸收分光光度法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第五章 原子发射光谱分析法(Atomic Emission Spectrosmetry, AES).ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第六章 经典液相色谱分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第七章 气相色谱法.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第八章 高效液相色谱分析.ppt
- 哈尔滨商业大学:《分析化学》课程PPT教学课件(工科专业仪器分析)第九章 红外吸收光谱分析.ppt
- 《分析化学》课程PPT教学课件(药学专业)第一章 绪论.ppt
- 《分析化学》课程PPT教学课件(药学专业)第二章 误差与分析数据的处理.ppt
- 《分析化学》课程PPT教学课件(药学专业)第三章 滴定分析法概论.ppt
- 《分析化学》课程PPT教学课件(药学专业)第四章 酸碱滴定法.ppt
- 《分析化学》课程PPT教学课件(药学专业)第五章 非水酸碱滴定法.ppt
- 《分析化学》课程PPT教学课件(药学专业)第六章 配位滴定法.ppt
- 《分析化学》课程PPT教学课件(药学专业)第七章 氧化还原滴定法.ppt
