广东工业大学:《分析化学》课程教学课件(PPT讲稿)第十三章 分析化学中的分离富集方法

第十三章分析化学中的 分离富集方法 13.1 沉淀分离法 13.2 溶剂萃取分离法 13.3 色谱分离法 13.4离子交换法
13.1 沉淀分离法 13.2 溶剂萃取分离法 13.3 色谱分离法 13.4 离子交换法 第 十三章 分析化学中的 分离富集方法

13.1沉淀分离法 13.1.1无机沉淀剂 13.1.2有机沉淀剂 13.1.3共沉淀分离富集 13.1.4提高选择性
13.1 沉淀分离法 13.1.1 无机沉淀剂 13.1.2 有机沉淀剂 13.1.3 共沉淀分离富集 13.1.4 提高选择性

13.1.1无机沉淀分离法 1.氢氧化物沉淀:《简明分析化学手册》p74 OH:分离两性(亿n,Pb,Sn,A)与非两性物. 蛋白质的分离-调pH至等电点 NH3H2O:分离高价金属离子(Th4+,AI+,Fe3+)与易生成 氨络合物的金属(Cu,Co,Ni,Zn,Cd,Hg,Ag) 2.硫化物:H2S(控制酸度以控制S2浓度) 3.其他沉淀剂:CT,s05,Cr00,等 Ag* Ba2+,Pb2+ Mg2+Ca2+ 容易共沉淀,选择性不高;应首先沉淀微量组分
13.1.1 无机沉淀分离法 1.氢氧化物沉淀:《简明分析化学手册》p74 OH- :分离两性(Zn,Pb,Sn,Al)与非两性物. 蛋白质的分离-调pH至等电点 NH3·H2O:分离高价金属离子(Th4+,Al3+,Fe3+)与易生成 氨络合物的金属(Cu,Co,Ni,Zn,Cd,Hg,Ag) 2. 硫化物:H2S(控制酸度以控制S 2-浓度) 3. 其他沉淀剂:Cl- , SO4 2- , CrO4 2- , PO4 3- , F-等 Ag+ Ba2+,Pb2+ Mg2+ Ca2+ 容易共沉淀, 选择性不高; 应首先沉淀微量组分
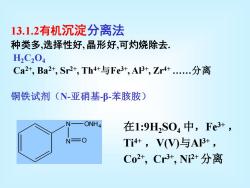
13.1.2有机沉淀分离法 种类多,选择性好,晶形好,可灼烧除去 H2C204 Ca2+,Ba2+,Sr2+,Th4+与Fe3+,A3+,Zr4+.分离 铜铁试剂(N-亚硝基B-苯胲胺) ONH4 在1:9H2S04中,Fe3+, N=O Ti4+,V(V)与AI3+, Co2+,Cr3+,Ni2+分离
13.1.2有机沉淀分离法 种类多,选择性好, 晶形好,可灼烧除去. H2C2O4 Ca2+, Ba2+, Sr2+, Th4+与Fe3+, Al3+, Zr4+ .分离 铜铁试剂(N-亚硝基-β-苯胲胺) 在1:9H2SO4 中,Fe3+ , Ti4+ ,V(V)与Al3+ , Co2+, Cr3+, Ni2+ 分离 N ONH4 N O
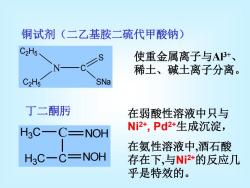
铜试剂(二乙基胺二硫代甲酸钠) C2H5 使重金属离子与AI3+、 稀土、碱土离子分离。 C2H5 SNa 丁二酮肟 在弱酸性溶液中只与 H3C-C=NOH Ni2*,Pd2+生成沉淀, 在氨性溶液中,酒石酸 H3C一C=NOH 存在下,与N2*的反应几 乎是特效的
铜试剂(二乙基胺二硫代甲酸钠) 使重金属离子与Al3+ 、 稀土、碱土离子分离。 在弱酸性溶液中只与 Ni2+, Pd2+生成沉淀, 在氨性溶液中,酒石酸 存在下,与Ni2+的反应几 乎是特效的。 N C S SNa C2 H5 C2 H5 丁二酮肟 H3 C C H3 C C NOH NOH
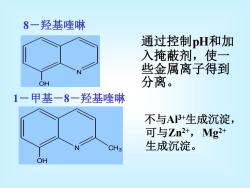
8一羟基喹啉 通过控制pH和加 入掩蔽剂,使一 些金属离子得到 ○H 分离。 1一甲基一8一羟基喹啉 不与A3+生成沉淀, 可与Zn2+,Mg2+ CH3 生成沉淀。 OH
通过控制pH和加 入掩蔽剂,使一 些金属离子得到 分离。 不与Al3+生成沉淀, 可与Zn2+ ,Mg2+ 生成沉淀。 8-羟基喹啉 N OH N OH CH3 1-甲基-8-羟基喹啉
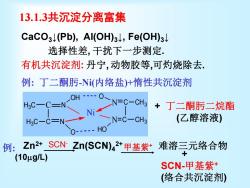
13.1.3共沉淀分离富集 CaCO3N(Pb),Al(OH)3↓,Fe(OH)3↓ 选择性差,干扰下一步测定 有机共沉淀剂:丹宁,动物胶等,可灼烧除去. 例:丁二酮肟-N(内络盐)+惰性共沉淀剂 HgC-C-N< N N=C-CH3 +丁二酮肟二烷酯 HC-C=N→ CN=C-CH3 (乙醇溶液) O- HO 例:Zn2+SCN Zn(SCN)42+甲基紫+ 难溶三元络合物 (10μg/L) 十 SCN-甲基紫+ (络合共沉淀剂)
13.1.3共沉淀分离富集 CaCO3↓(Pb), Al(OH)3↓, Fe(OH)3↓ 选择性差, 干扰下一步测定. 有机共沉淀剂: 丹宁, 动物胶等,可灼烧除去. 例: 丁二酮肟-Ni(内络盐)+惰性共沉淀剂 H3 C C H3 C C N N OH O Ni N C O N C CH3 CH3 HO + 丁二酮肟二烷酯 (乙醇溶液) + SCN-甲基紫+ (络合共沉淀剂) Zn2+ Zn(SCN)4 SCN- 2+ 甲基紫+ 难溶三元络合物 (10g/L) 例:

13.1.4提高选择性 1.控制酸度 2.利用络合掩蔽作用 Cu2+、Cd2+ 在KCN的氨性溶液中,通入HS,Cd2+被沉淀, Cu2+不沉淀 Cu2+一Cu(CN)32 Ca2+、Mg2+ NH4)2C204过量,Ca2+沉淀,Mg2+生成Mg(C204)22 Pb2+、Ca2+ 在EDTA存在下,控制pH2.8~4.9,CaC204↓,与Pb分离
1.控制酸度 2. 利用络合掩蔽作用 Cu2+ 、Cd2+ 在KCN的氨性溶液中,通入H2S, Cd2+被沉淀, Cu2+不沉淀 Cu2+ Cu(CN)3 2- Ca2+ 、Mg2+ (NH4 )2C2O4过量,Ca2+沉淀,Mg2+生成Mg(C2O4 )2 2- Pb2+ 、Ca2+ 在EDTA存在下,控制pH2.8~4.9,CaC2O4↓,与Pb分离 13.1.4 提高选择性
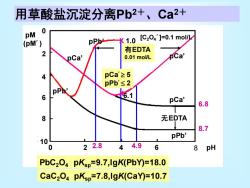
用草酸盐沉淀分离Pb2+、Ca2+ pM 0 PPb1.0 [C204']=0.1moll (pM') 2 有EDTA pCa' 0.01 mol/L Ca 4 pCa≥5 pPb'≤2 6 pCa' 6.8 8 无EDTA 8.7 pPb' 10 0 22.8 44.9 6 8 pH PbC2O4 pKsp=9.7,IgK(PbY)=18.0 CaC2O4 pKsp=7.8,IgK(CaY)=10.7
用草酸盐沉淀分离Pb2+、Ca2+ pCa’ pPb’ pPb’ X 1.0 pCa’ 无EDTA 有EDTA 0.01 mol/L X6.1 10 8 6 4 2 0 pM (pM´) 0 2 4 6 8 2.8 4.9 pH 6.8 8.7 pCa’ 5 pPb’ 2 [C2O4´]=0.1 mol/L PbC2O4 pKsp=9.7,lgK(PbY)=18.0 CaC2O4 pKsp=7.8,lgK(CaY)=10.7 pCa’ pPb’

3.利用氧化还原反应,改变离子存在状态 Fe3+ NaOH Fe(oH)3↓ Cr3+H202 Cr042 Mn2+ 02 MnO(oH)2↓ Ca2+,Mg2+ Ca2+,Mg2+
3. 利用氧化还原反应,改变离子存在状态 Fe3+ Cr3+ Mn2+ Ca2+,Mg2+ NaOH H2O2 Fe(OH)3↓ CrO4 2- MnO(OH)2↓ Ca2+,Mg2+ O2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第十二章 波谱分析简介.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第十一章 气相色谱法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第十章 原子吸收光谱法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第九章 吸光光度法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第八章 仪器分析——电位分析与离子选择性电极.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第七章 重量分析法和沉淀滴定法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第六章 氧化还原滴定法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第五章 配位滴定法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第四章 酸碱滴定法.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第三章 滴定分析.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第二章 误差与分析数据处理.ppt
- 广东工业大学:《分析化学》课程教学课件(PPT讲稿)第一章 绪论 Analytical Chemistry(授课教师:彭兰乔).ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第十三章 高效液相色谱法.ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第十二章 气相色谱分析.ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第十章 伏安分析法(voltammetry).ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第九章 电解分析和库仑分析(Electrolysis and Coulometry).ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第八章 电位分析法.ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第七章 电化学分析引言.ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第六章 质谱分析(MS).ppt
- 河北科技大学:《仪器分析》课程教学资源(PPT课件)第五章 核磁共振波谱分析(NMR).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第一章 分析化学导言(主讲:蔡明招).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(1/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(2/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(3/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(4/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(5/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差和数据处理及评价(6/6).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第四章 重量分析法(1/2).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第四章 重量分析法(2/2).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.1 强酸强碱相互滴定.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.2 强碱滴定弱酸.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.4.3 强酸滴定弱碱 5.4.4 强碱滴定多元酸 5.4.5 强碱滴定混合酸 5.4.6 强酸滴定多元碱.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第五章 酸碱滴定法 5.5 滴定误差 5.6 酸碱滴定法的应用.ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(1/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(2/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第六章 沉淀滴定法(3/3).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(1/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(2/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(3/7).ppt
- 华南理工大学:《分析化学》课程教学资源(PPT课件)第七章 络合滴定法(4/7).ppt
