合肥工业大学:《大学物理》课程教学资源(教案讲义)第二篇 热学(气体分子运动和热力学基础)2.2 热力学基础

第七章热力学基础 §7-1功热量内能 1、热力学系统和热力学过程 研究关于热现象和热运动规律的物体(组)一一热力学系统 热力学系统的状态随时间的变化一一热力学过程 2、平衡过程(准静态过程) 过程进行的时间大于各状态参量的驰豫时间 例 (1)使系统的温度由T升到2的过程 (2)气体的等温膨胀过程(缓慢提活塞) 若用活塞快速压缩气缸内的气体,则P、V、T都发生变化 3、功热量内能 功和热量是能量交换的二种不同形式(实质) 注意: (1)功和热量是过程的函数(与过程无关),不少态函数 (2)对平衡过程: 便微越)Q=之c- :M_C(T:-T)-MC(T:-T) C是该过程的摩尔热容量 C CM是该过程的比热 Mc是改过程的热容量 对等温过程,C=0,不能用上式计算 对外做功: A-∫dA=PaV 平衡过程在PV图上可以用一条曲线表示。该曲线与V轴所围的面积代表功
第七章 热力学基础 §7-1 功 热量 内能 1、热力学系统和热力学过程 研究关于热现象和热运动规律的物体(组)——热力学系统 热力学系统的状态随时间的变化——热力学过程 2、平衡过程(准静态过程) 过程进行的时间大于各状态参量的驰豫时间 例: (1)使系统的温度由 T1 升到 T2 的过程 (2)气体的等温膨胀过程(缓慢提活塞) 若用活塞快速压缩气缸内的气体,则 P、V、T 都发生变化 3、功 热量 内能 功和热量是能量交换的二种不同形式(实质) 注意: (1)功和热量是过程的函数(与过程无关),不少态函数 (2)对平衡过程: (吸热、放热) C(T T ) MC(T T ) M M CdT M M Q 2 1 2 1 mol T T mol 2 1 = − = − = C 是该过程的摩尔热容量 Mmol C c = ,是该过程的比热 Mc 是改过程的热容量 对等温过程, C = ,不能用上式计算。 对外做功: = = 2 1 v v 2 1 A dA PdV 平衡过程在 PV 图上可以用一条曲线表示。该曲线与 V 轴所围的面积代表功

功、热的单位是焦尔或卡。1卡=4.2焦尔,1焦尔=0.24卡 PA f=Ps 图7-1-1气体膨胀做功及其示意图 内能一 (1)物质系统内部状态决定得能量,是态函数: (2)一般要选择一参考态内能,实际中经常讨论得是内能差: (3)对理想气体内能E仅是T的函数。 §7-2热力学第一定律 它是能量转换和守恒定律在涉及到热现象过程中的具体形式。 Q=E2-E+A 对任意热力学过程适用(固、液、气) Q:吸热,E2-E,是内能增量,A是对外做功。 对状态的微小变化过程 dQ=d正+dA=dE+PdV 对于平衡过程 Q=E:-E+心paV 注意:功、热之间的转换不可能是直接的,必须通过物质系统来完成。 §7-3理想气体的等值平衡过程及摩尔热容量
功、热的单位是焦尔或卡。1 卡=4.2 焦尔,1 焦尔=0.24 卡 图 7-1-1 气体膨胀做功及其示意图 内能—— (1)物质系统内部状态决定得能量,是态函数; (2)一般要选择一参考态内能,实际中经常讨论得是内能差; (3)对理想气体内能 E 仅是 T 的函数。 §7-2 热力学第一定律 它是能量转换和守恒定律在涉及到热现象过程中的具体形式。 Q = E2 − E1 + A 对任意热力学过程适用(固、液、气) Q:吸热, E2 − E1 是内能增量,A 是对外做功。 对状态的微小变化过程 dQ = dE + dA = dE + PdV 对于平衡过程 = − + 2 1 V V Q E2 E1 PdV 注意:功、热之间的转换不可能是直接的,必须通过物质系统来完成。 §7-3 理想气体的等值平衡过程及摩尔热容量 f = Ps dL P O V1 V2 V Ⅰ Ⅱ dV P

一、等容过程气体定容摩尔热容量 设系统质量为M,摩尔质量为Mml,V为恒量。 dV=0,dA=0,A=0 →(dQv=dE,(Q)v=E2-E, 定义Cv, -c.t,-T) Qc-0=c-0=-E PA 图7-3-1气体等容过程及其示意图V 按定义(1no1气体)Cv=do=dE dr dT 对理想气体,E=RT,d正=号RdT(1mol) 放c,普 对刚性: 单原子分子,i=3,Cv=12.5mol-.k- 双原子分子,i=5,Cv=20.8Jmol1.k 多原子分子,i=6,Cy=24.9mol-1.k 注意:理想气体的内能只是T的单值函数,所以对于不同的状态,只需初终为
一、等容过程 气体定容摩尔热容量 设系统质量为 M,摩尔质量为 Mmol,V 为恒量。 dV = 0,dA = 0,A=0 (dQ)V = dE , V E2 E1 (Q) = − 定义 CV , C (T T ) M M Q V 2 1 mol = − V 2 1 2 1 2 1 mol C (T T ) MC(T T ) E E M M Q = − = − = − 图 7-3-1 气体等容过程及其示意图 按定义(1mol 气体) dT dE dT (dQ) C V V = = 对理想气体, RT 2 i E = , RdT 2 i dE = (1mol) 故 R 2 i dT dE CV = = 对刚性: 单原子分子, 1 1 i 3,CV 12.5J mol k − − = = 双原子分子, 1 1 i 5,CV 20.8J mol k − − = = 多原子分子, 1 1 i 6,CV 24.9J mol k − − = = 注意:理想气体的内能只是 T 的单值函数,所以对于不同的状态,只需初终为 V= 恒量 QV P2 P1 P O V V A = 0 Ⅱ Ⅰ

温度相同的平衡态,都适用。 -之c- 二、等压过程气体定压摩尔热容量 P=恒量,dP=O,dA=dP A=[PdV P(V2 -V 又w-总 A-) 国=E,@-e-E之-) 图7-3-2气体等压过程及其示意图 _C,(T:-T) 按定义Q,=M _Cv(T-T) 及E,-E=M
温度相同的平衡态,都适用。 C (T T ) M M E E V 2 1 mol 2 − 1 = − 二、等压过程 气体定压摩尔热容量 P=恒量,dP=0,dA = dP A PdV P(V V ) 2 1 V V 2 1 = = − 又 RT M M PV mol = RT M M dA PdV mol = = R(T T ) M M A 2 1 mol = − (dQ) P = dE + dA , R(T T ) M M (Q) (E E ) 2 1 mol P = 2 − 1 + − 图 7-3-2 气体等压过程及其示意图 按定义 C (T T ) M M (Q) P 2 1 mol P = − 及 C (T T ) M M E E V 2 1 mol 2 − 1 = − P= 恒量 QP P P V1 V2 V A Ⅰ Ⅱ O

代入上式 →C,=Cv+R一一迈耶公式 由CRC,片2R 定义v=C.i+2一比热容比 Cy 对刚性: 单原子分子,i=3,C。=20.81Jmol1.k,v=1.67 双原子分子,i=5,Cp=29.1olk,v=1.40 多原子分子,i=6,Cp-33.2小mol.k-,v=1.33 例:一气缸中储有氮气,质量为1.25kg。在标准大气压下缓慢地加热,使 温度升高1K。试求气体膨胀时所作地功A、气体内能的增量△E以及气体所吸 收的热量Q。(活塞的质量以及它与气缸壁的摩擦均可略去。) 解:因过程是等压的,由式 MR(T,-T)得 A=之ar=d品831xU=训 国为-6所以c,-汉-20am,自式正-之c,可后 E之c,A点uw 所以,气体在这一过程中所吸收的热量为 Qp=E2-E,+A=1300J 三、等温过程 T=恒量,dT=0 dE-0,E2-E,=0 (dQ)r=dA,(Q)=A
代入上式 CP = CV + R —— 迈耶公式 由 R 2 i 2 R C 2 i CV P + = = 定义 i i 2 C C V P + = = ——比热容比 对刚性: 单原子分子, i 3,C 20.81J mol k , 1.67 1 1 = P = = − − 双原子分子, i 5,C 29.11J mol k , 1.40 1 1 = P = = − − 多原子分子, i 6,C 33.21J mol k , 1.33 1 1 = P = = − − 例:一气缸中储有氮气,质量为 1.25kg。在标准大气压下缓慢地加热,使 温度升高 1K。试求气体膨胀时所作地功 A、气体内能的增量 E 以及气体所吸 收的热量 QP。(活塞的质量以及它与气缸壁的摩擦均可略去。) 解:因过程是等压的,由式 R(T T ) M M RdT M M A 2 1 mol T T mol 2 1 = = − 得 8.31 1J 371J 0.028 1.25 R T M M A mol = = = 因为 i=5,所以 R 20.8J/(mol K) 2 i CV = = 。由式 C dT M M dE V mol = 可得, 20.8 1J 929J 0.028 1.25 C T M M E V mol = = = 所以,气体在这一过程中所吸收的热量为 Q E E A 1300J P = 2 − 1 + = 三、等温过程 T=恒量,dT=0 dE=0,E2 − E1 = 0 (dQ)T = dA,(Q)T = A

:M_RT-k-PV PV,=PV,Ma →A=pav=ky (Q)1=A 等温过程热容量为 V 图7-3-3气体等温过程及其示意图 例:质量为2.8×103kg、压强1atm、温度27℃的氮气,先在体积不变的 情况下,使其压强增至3atm,再经等等温膨胀,使压强降至latm,然后又在等 压(1atm)下将其体积压缩一半。试求氮在全部过程中的内能变化,它所做的的 功和吸收的热量:并把氮的状态变化过程在P一V图中图示出来。 解:己知,M=2.8×10-3Kg,P1=1m=1.013×105Nm2,P2=3am,P3=1atm, 1=27℃=30K,V=2y 利用:Pv=之,求将 I:(E,V,T)~(1atm,2.46×103m3,300K) 1:(D2,V2,T2)-(3atm,2.46×10-5m3,900K) l:(P3,V3,T)~(atm,7.38×103m3,900K)
RT k PV M M P V P V mol 1 1 = 2 2 = = = = = 2 1 2 1 V V V V V dV A PdV k 2 1 1 mol 2 2 mol 1 1 1 1 2 1 1 P P RT ln M M V V RT ln M M P P P V ln V V A = P V ln = = = (Q)T = A 等温过程热容量为∞ 图 7-3-3 气体等温过程及其示意图 例:质量为 2.8×10-3kg、压强 1atm、温度 27℃的氮气,先在体积不变的 情况下,使其压强增至 3atm,再经等等温膨胀,使压强降至 1atm,然后又在等 压(1atm)下将其体积压缩一半。试求氮在全部过程中的内能变化,它所做的的 功和吸收的热量;并把氮的状态变化过程在 P-V 图中图示出来。 解:已知,M=2.8×10-3Kg,P1=1atm=1.013×105Nm-2,P2=3atm,P3=1atm, T1=27℃=300K, 4 V3 2 1 V = 利用 RT M M PV mol = ,求得, Ⅰ:(P ,V ,T ) ~ (1atm,2.46 10 m ,300K) 3 3 1 1 1 − Ⅱ:(P ,V ,T ) ~ (3atm,2.46 10 m ,900K) 3 3 2 2 2 − Ⅲ:(P ,V ,T ) ~ (1atm,7.38 10 m ,900K) 3 3 3 3 3 − 恒 温 热 源 T T= 恒量 QT 绝 热 P P1 P2 O V1 V2 V Ⅰ Ⅱ
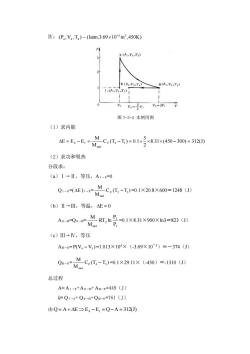
IV:(D4,V,T4)-atm,3.69×10-3m3,450K) (P.V.T) N(VTO (,V) LPLVTD 图7-3-4本例用图 (1)求内能 AE=E,-6=c-T=013x831x450-0=3120 (2)求功和吸热 分段求: (a)I→Ⅱ,等压,A1-m=0 Qa-c.c-T01X208x60=24s0 (b)Ⅱ→Ⅲ,等温,△E=0 Aa-mQ-rM P、 -0.1×8.31×900×1n3=823(J) (c)Ⅲ-→V,等压 Am-=P(V4-V3)=1.013×105×(-3.69×103)=-374(J) MC,①,-T)-0.1×29.11×(450)=1310) Q- 总过程 A=A1-An-mAm-N=449 (J) Q=Q1-n+Q1-m+Qm-w=761(J) 由Q=A+AE→E4-E,=Q-A=312)
Ⅳ:(P ,V ,T ) ~ (1atm,3.69 10 m ,450K) 3 3 4 4 4 − 图 7-3-4 本例用图 (1)求内能 8.31 (450 300) 312(J) 2 5 C (T T ) 0.1 M M E E E V 4 1 mol = 4 − 1 = − = − = (2)求功和吸热 分段求: (a)Ⅰ→Ⅱ,等压,AⅠ→Ⅱ=0 QⅠ→Ⅱ=( E )Ⅰ→Ⅱ= C (T T ) M M V 2 1 mol − =0.1×20.8×600=1248(J) (b)Ⅱ→Ⅲ,等温, E = 0 AⅡ→Ⅲ=QⅡ→Ⅲ= 3 2 2 mol P P RT ln M M =0.1×8.31×900×ln3=823(J) (c)Ⅲ→Ⅳ,等压 AⅢ→Ⅳ= P(V V ) 4 − 3 =1.013×105×(-3.69×10-3)=-374(J) QⅢ→Ⅳ= C (T T ) M M P 4 3 mol − =0.1×29.11×(-450)=-1310(J) 总过程 A= AⅠ→Ⅱ+AⅡ→Ⅲ+ AⅢ→Ⅳ=449(J) Q= QⅠ→Ⅱ+ QⅡ→Ⅲ+ QⅢ→Ⅳ=761(J) 由 Q A E E E Q A 312(J) = + 4 − 1 = − =

§7-5绝热过程多方过程 一、绝热过程 热力学系统与外界无热量交换的过程。 dQ=0,Q=0 (1)由良好的绝热材料隔绝的系统进行的过程 ,绝热 (2)由于过程进行的较快 讨论绝热平衡过程: 由第一定律 Q=△E+A,dQ=dE+dA 图7-5-1气体绝热过 程 →A=-AE或dA=dE=PdV AE=E:-E,-M MC,①,-T) C,①-T) A=-Mat Q=0,C。=0 在绝热过程中,P、V、T三个量都同时改变 二、绝热过程方程 PV-M RT Mmol (1) iA=PV-M M C.T (2) 由q)dPV-Mi M RdT PdV 由R=C,-c且v=名
§7-5 绝热过程 多方过程 一、绝热过程 热力学系统与外界无热量交换的过程。 dQ = 0, Q=0 (1)由良好的绝热材料隔绝的系统进行的过程 (2)由于过程进行的较快 讨论绝热平衡过程: 由第一定律 Q = E + A , dQ = dE + dA 图 7-5-1 气体绝热过 程 A = −E 或 dA = −dE = PdV = = = − − = − = − Q 0,C 0 C (T T ) M M A C (T T ) M M E E E Q V 2 1 mol V 2 1 mol 2 1 在绝热过程中,P、V、T 三个量都同时改变。 二、绝热过程方程 RT M M PV mol = (1) C dT M M dA PdV V mol = = − (2) 由(1) RdT M M d(PV) mol = 除以(2) CV R PdV d(PV) = − 由 R = CP − CV ,且 V P C C = 绝 热
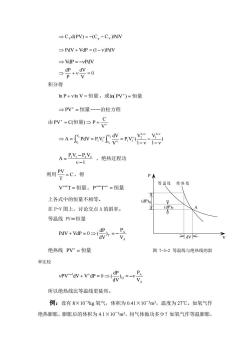
Cyd(PV)=-(C-Cy)PdV PdV+VdP=(I-v)PdV →VdP=-vPdV 积分得 hP+vhV=恒量,或nPV)=恒量 →PV"=恒量一一泊松方程 由PV=C恒到P-号 A-TV-RVCW-PV A=Y-PY,绝热过程功 v-1 利用兴=c得 P不 等湿线绝热 V-T=恒量,p-Tv=恒量 上各式中的恒量不相等。 (dP 在P-V图上,讨论交点A的斜率。 等温线PV=恒量 d图 绝热线PV"=恒量 图7-5-2等温线与绝热线的斜 率比较 vPVV+vp=0=崇。=-号 所以绝热线比等温线更陡些。 例:设有8×10kg氧气,体积为0.41×103m3,温度为27℃。如氧气作 绝热膨胀,膨胀后的体积为4.1×103m子,问气体做功多少?如氧气作等温膨胀
CVd(PV) = −(Cp − CV )PdV PdV + VdP = (1− )PdV VdP = −PdV0 V dV P dP + = 积分得 ln P + ln V = 恒量 ,或 ln( PV ) = 恒量 PV = 恒量——泊松方程 由 = = V C PV C(恒量) P ) 1 V 1 V P V ( V dV A PdV P V 1 1 1 2 1 1 V V 1 1 V V 2 1 2 1 − − − = = = − − 1 P V P V A 1 1 2 2 − − = ,绝热过程功 利用 C T PV = ,得 V −1T = 恒量,P −1T − = 恒量 上各式中的恒量不相等。 在 P-V 图上,讨论交点 A 的斜率。 等温线 PV=恒量 A A T V P ) dV dP PdV + VdP = 0 ( = − 绝热线 PV = 恒量 图 7-5-2 等温线与绝热线的斜 率比较 A A Q 1 V P ) dV dP PV dV + V dP = 0 ( = − − 所以绝热线比等温线更陡些。 例:设有 8×10-3kg 氧气,体积为 0.41×10-3m3,温度为 27℃。如氧气作 绝热膨胀,膨胀后的体积为 4.1×10-3m3,问气体做功多少?如氧气作等温膨胀, P V A (dP)Q dV (dP)T 等 温 线 绝 热 线

膨胀后的体积也是4.1×103m3,问这时气体做功又是多少?4 解:已知,M=0.008Kg,Mmo=0.032Kg,T=300K,V1=0.41×103m3,V2 =4.1×103m3 P 绝热过程:(T,V)→(T2,V2) AC.(-T) 求T2,V-T-V-T2,v=1.40 5=r位=19 双原子0,Cv=R=20,8molK 图7-5-3本例用图 等温过程,(T,V)→(T,V2) Mmh兰=1435别 Az =Mat 二、多方过程 大多数实验过程既非等温又非绝热 PV"=恒量,V-T=恒量,p-Tn=恒量,n一一多方指数 般地1≤n≤V 特例下:n=0等压 n=1等温 n=v绝热 n=0等容 功:I(P1,V1)到Ⅱ(P2,V2) PV=PV=P,V=恒量 Av-RNg-R答-治
膨胀后的体积也是 4.1×10-3m3,问这时气体做功又是多少?4 解:已知,M=0.008Kg,Mmol=0.032Kg,T1=300K,V1=0.41×10-3m3,V2 =4.1×10-3m3 绝热过程: (T ,V ) (T ,V ) 1 1 → 2 2 C (T T ) M M A V 2 1 mol 1 = − − 求 T2, V T V T2 , 1.40 1 1 2 1 1 = = − − ) 119K V V T T ( 1 2 1 2 = 1 = − 双原子 O2, 1 1 V R 20.8J mol K 2 5 C − − = = 图 7-5-3 本例用图 C (T T ) 941J M M A V 2 1 mol 1 = − − = 等温过程, (T ,V ) (T ,V ) 1 1 → 1 2 1435J V V RT ln M M A 1 2 1 mol 2 = − = 二、多方过程 大多数实验过程既非等温又非绝热 PVn = 恒量,V n−1T = 恒量,P n−1T −n = 恒量,n —— 多方指数 一般地 1 n 特例下:n=0 等压 n=1 等温 n = 绝热 n = 等容 功:Ⅰ(P1,V1)到Ⅱ(P2,V2) PVn = P1V1 n = P2V2 n = 恒量 ) 1 n V 1 n V P V ( V dV A PdV P V 1 n 1 1 n n 2 1 1 V V n n 1 1 V V 2 1 2 1 − − − = = = − − (T1 ,V1 ) (T2 ,V2 ) (T1 ,V2 ) 等 温 绝 热 P V1 V2 V
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第一篇 力学 1.4 狭义相对论.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第一篇 力学 1.3 刚体转动.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第一篇 力学 1.2 质点动力学.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第一篇 力学 1.1 质点运动学.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)绪论.doc
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第四章 冲量和动量.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十章 变化的磁场和电场.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十六章 量子物理基础.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十八章 粒子物理.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十五章 狭义相对论.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十九章 波动与光学——振动.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十三章 机械波.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第十七章 原子核物理.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第六章 刚体动力学.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第五章 刚体运动学.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第二章 牛顿运动定律.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第三章 功和能.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第七章 机械震动.ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第一章 质点的运动(质点运动学).ppt
- 广东工业大学:《大学物理》课程教学课件(PPT讲稿)第九章 恒定磁场 §9.5 磁场对电流的作用 §9.6 带电粒子在磁场中的运动 §9.7 物质的磁性.ppt
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第三篇 电磁学(电场和磁场)3.1 真空中的静电场.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第三篇 电磁学(电场和磁场)3.2 导体和电介质中的静电场.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第三篇 电磁学(电场和磁场)3.3 电流的磁场.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第三篇 电磁学(电场和磁场)3.4 磁场对电流的作用.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第三篇 电磁学(电场和磁场)3.6 物质的磁性.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第四篇 振动和波动 4.1 振动.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第四篇 振动和波动 4.2 波动学基础——机械波的产生与传播.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第四篇 振动和波动 4.3 波动光学——光的干涉.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第四篇 振动和波动 4.4 光的衍射、惠更斯-菲涅耳原理.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第四篇 振动和波动 4.5 光的偏振.doc
- 合肥工业大学:《大学物理》课程教学资源(教案讲义)第五篇 量子物理 5.1 早期量子论和量子力学基础.doc
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十章 恒定电流和恒定电场.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十一章 真空中的恒定磁场.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十二章 磁介质中的磁场.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十三章 磁场 §13-4 互感和自感 §13-5 磁场的能量.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十六章 波 §16-5 惠更斯原理 §16-6 波的干涉 §16-7 驻波.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第十七章 波动光学.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第二章 牛顿运动定律.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第三章 运动守恒定律.ppt
- 西安科技大学:《大学物理》课程教学资源(PPT课件)第四章 刚体的转动.ppt
