《高等有机化学》课程电子教案(PPT教学课件)第1章 化学键与分子结构

第1章化学键与分子结构 一.键能,键长,偶极矩 二.电子效应和空间效应 三.分子轨道理论 四.芳香性和休克尔规则
第1章 化学键与分子结构 二. 电子效应和空间效应 三. 分子轨道理论 一. 键能, 键长, 偶极矩 四. 芳香性和休克尔规则

教学目的和要求 ■1、幸握电子效应(诱导、共轭、超共轭) 的基本概念(定义、方向、强弱、传导) ■2、幸握电子效应,场效应和空间效应对性 能的影响, 3、熟悉分子轨道理论的基本概念和初步应 ■ 用。 ■4、掌握芳香性、同芳香性和反芳香性的基本概 念,能运用休克尔规则判断环状化合物的芳香性, 课时安排:4h
教学目的和要求 ▪ 1、掌握电子效应(诱导、共轭、超共轭) 的基本概念(定义、方向、强弱、传导). ▪ 2、掌握电子效应,场效应和空间效应对性 能的影响. ▪ 3、熟悉分子轨道理论的基本概念和初步应 用。 ▪ 4、掌握芳香性、同芳香性和反芳香性的基本概 念, 能运用休克尔规则判断环状化合物的芳香性. 课时安排:4h
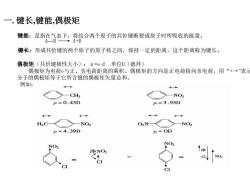
一.键长,键能,偶极矩 键能:是指在气态下,将结合两个原子的共价键断裂成原子时所吸收的能量。 A-B- A+B 键长:形成共价键的两个原子的原子核之间,保持一定的距离,这个距离称为键长。 偶极矩(共价键极性大小):μ=ed单位D(德拜) 偶极矩为电荷与正、负电荷距离的乘积。偶极矩的方向是正电荷指向负电荷,用“+→”表示 分子的偶极矩等于它所含键的偶极矩矢量总和。 例如: CH3 H=0.43D u=3.93D H3C -NO2 O2N —NO H=4.39D =OD NO 净NO2 NO
一. 键长,键能,偶极矩 键能:是指在气态下,将结合两个原子的共价键断裂成原子时所吸收的能量。 A—B A+B 键长:形成共价键的两个原子的原子核之间,保持一定的距离,这个距离称为键长。 偶极矩(共价键极性大小):μ=e·d 单位D(德拜) 偶极矩为电荷e与正、负电荷距离的乘积。偶极矩的方向是正电荷指向负电荷,用“+→”表示。 分子的偶极矩等于它所含键的偶极矩矢量总和。 例如:

二.电子效应和空间效应 诱导效应 (,π) 电子效应 共轭效应 (π-π,p-π) 超共轭效应 取代基效 (c-元,-p) 应 场效 应 空间传递 空间效 (立体效应) 应 电子效应(Electronic effect): 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响
二. 电子效应和空间效应 电子效应(Electronic effect): 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响. 取代基效 应 电子效应 场效 应 空间效 应 诱导效应 共轭效应 超共轭效应 (立体效应) (σ, π) ( π-π, p-π) (σ- π,σ- p) 空间传递

(一).诱导效应(Inductive effect) i 因某一原子或原子团的电负 8.( 性不同所引起的极性效应,通过化 学键传递到分子的其它部分,这种 作用称为诱导效应 结构特征:单、双、叁键 传递方式:0、π键 传递强度:与距离相关。距离越大,强度越弱。 诱导效应的相对强度: 取 取代基 中心原子 决 C-C-Z 电负性(Electronegativeties)
(一). 诱导效应 (Inductive effect) C C Cl δ δ δ C C Cl δ δ C C Cl δ δ 因某一原子或原子团的电负 性不同所引起的极性效应, 通过化 学键传递到分子的其它部分, 这种 作用称为诱导效应. 结构特征:单、双、叁键 传递方式:σ、π键 传递强度:与距离相关。距离越大,强度越弱。 诱导效应的相对强度: C C Z 取 决 中心原子 电负性 (Electronegativeties) 取代基

诱导效应(Ⅱ)分为I效应(吸电子基)和+效应(给电子基) -I效应一般规律: 1.同周期的原子:-CH3Cl>Br>I 电负性: 4.03.02.82.5 3.相同的原子:不饱和度越大,-I效应越强 -C=CR>-CH-CHR 4.带正电荷的取代基的-I强:-:NR3>NO2>-NR2 +I效应一般规律:带负电荷的取代基的+I强
诱导效应( I )分为 -I 效应(吸电子基)和+ I效应(给电子基). -I 效应一般规律: 1. 同周期的原子: -CH3 Cl > Br > I 电负性: 4.0 3.0 2.8 2.5 3. 相同的原子: 不饱和度越大,-I 效应越强 C CR > CH CHR 4. 带正电荷的取代基的-I 强: +I 效应一般规律: 带负电荷的取代基的+ I 强. -NR3 > -NO2 > -NR2 -I:
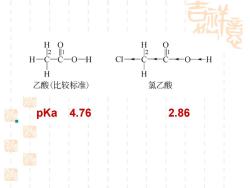
孤美 H O 21 H H 乙酸(比较标准) 氯乙酸 家 pKa 4.76 2.86 起 庭
▪ pKa 4.76 2.86
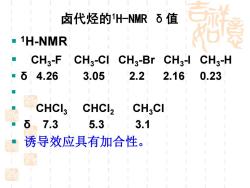
卤代烃的H-NMRδ值 -1H-NMR CHg-F CH3-CI CH3-Br CH3-1 CH3-H 6 4.26 3.05 2.2 2.16 0.23 CHCI3 CHCI2 CHgCI δ7.3 5.3 3.1 诱导效应具有加合性
▪ 1H-NMR ▪ CH3 -F CH3 -Cl CH3 -Br CH3 -I CH3 -H ▪ δ 4.26 3.05 2.2 2.16 0.23 ▪ ▪ CHCl3 CHCl2 CH3Cl ▪ δ 7.3 5.3 3.1 ▪ 诱导效应具有加合性。 卤代烃的1H-NMR δ值
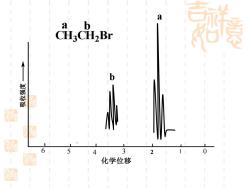
a b CH3CH2Br 嬴 6 4 3 2 化学位移
6 5 4 3 0 吸收强度 化学位移 2 1 CH3 CH2 Br a b a b

诱导效应对反应性能的影响 1、对反应方向的影响: Cl3C-HC=CH2 +HBr->Cl3C-H2C-CH2Br 反马氏加成 又如:+N(CH3)3具有强烈的-效应,是一很强的间 位定位基。 2、对反应速率的影响 。如亲核加成反应活性: CI C-CHO >CI2CHCHO>CICH2CHO>CH3CHO ·又如RX发生SN反应的活性次序为:RI>RBr>RCI ·后者是动态诱导(极化)的结果
诱导效应对反应性能的影响 ▪ 1、对反应方向的影响: ▪ ▪ ▪ 又如:+N(CH3 )3具有强烈的-I效应,是一很强的间 位定位基。 ▪ 2、对反应速率的影响 ▪ 如亲核加成反应活性: ▪ Cl3C-CHO >Cl2CHCHO> ClCH2CHO> CH3CHO ▪ 又如RX发生SN反应的活性次序为:RI>RBr>RCl ▪ 后者是动态诱导(极化)的结果。 ▪ HC CH2 + HBr Cl 3 C H2 C CH2 Br 反马氏加成 Cl 3 C
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《高等有机化学》课程电子教案(PPT教学课件)序论及目录.ppt
- 长沙理工大学:《高等有机化学》课程教学资源(试卷习题)考研有机化学复习专题(模拟试题,无答案).doc
- 北京化工大学:《有机化学》课程教学资源(试卷习题)攻读硕士学位研究生入学考试有机化学试题(样题).pdf
- 长沙理工大学:《高等有机化学》课程教学资源(教案讲义)高等有机化学课程教案.doc
- 长沙理工大学:《高等有机化学》课程教学资源(教案讲义)高等有机化学大纲(研究生课程).doc
- 运城学院:《有机化学实验》课程教学资源(PPT课件)22 阿司匹林的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)24 乙酸乙酯的制备及表征.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)23 肉桂酸的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)21 茶叶中咖啡因的提取.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)20 甲基橙的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)18 呋喃甲醇和呋喃甲酸的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)19 己二酸的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)17 卤代烃、醇、酚、醛、酮性质实验和鉴定.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)16 苯乙酮的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)15 苄叉酮和二苄叉丙酮的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)14 乙酰苯胺的制备及表征.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)13 1-苯乙醇的制备及旋光度的测定.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)12 2-甲基-2-氯丙烷的制备.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)11 正丁醚的制备及折光率的测定.ppt
- 运城学院:《有机化学实验》课程教学资源(PPT课件)10 无水乙醇的制备.ppt
- 《高等有机化学》课程电子教案(PPT教学课件)第2章 立体化学原理.ppt
- 《高等有机化学》课程电子教案(PPT教学课件)第3章 有机化学反应机理的研究.ppt
- 《高等有机化学》课程电子教案(PPT教学课件)第4章 亲核取代反应(Aliphatic Nucleophilic Substitution).ppt
- 《高等有机化学》课程电子教案(PPT教学课件)第5章 加成与消除反应.ppt
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第一章 绪论(主讲:李丹).pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第二章 误差及分析数据的统计处理.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第三章 滴定分析法概论.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第四章 酸碱滴定法.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第五章 配位滴定法.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第六章 氧化还原滴定法.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第七章 重量分析法和沉淀滴定法.pdf
- 长沙理工大学:《分析化学》课程教学资源(课件讲稿)第八章 吸光光度法.pdf
- 《高等食品化学》课程电子教案(PPT教学课件)食品化学课件 ADVANCED FOOD CHEMISTRY(共五章).ppt
- 长沙理工大学:《高等食品化学》课程教学资源(教学大纲)Food Chemistry(负责人:易翠平).pdf
- 北京化工大学:《生化分离工程》课程教学资源(教案讲义)教学大纲 Bio-separations.pdf
- 北京化工大学:《生化分离工程》课程电子教案(课件讲稿)第一章 绪论(负责人:苏海佳).pdf
- 北京化工大学:《生化分离工程》课程电子教案(课件讲稿)第二章 发酵液预处理与固液分离.pdf
- 北京化工大学:《生化分离工程》课程电子教案(课件讲稿)第三章 细胞破碎 Cell Disruption.pdf
- 北京化工大学:《生化分离工程》课程电子教案(课件讲稿)第四章 萃取 Extraction.pdf
- 北京化工大学:《生化分离工程》课程电子教案(PPT课件)第五章 膜分离 membrane separation.ppt
