《无机化学》课程教学资源(实验讲稿)

实验溶液的配制 实验目的 1.学习电子天平、比重计、移液管、容量瓶的使用方法。 2.练习称量、溶解、移液等基本操作。 3.掌握溶液的一般配置方法和基本操作。 4.了解特殊溶液的配置。 实验原理 溶液的浓度指一定量溶液或溶剂中所含溶质的量。 在化学实验室经常需要配制各种溶液来满足不同实验的需要。一般定性实验所需的 溶液对浓度要求不高,利用托盘天平、量筒等仪器来配制溶液就能满足需要。而定量实 验所需的溶液对浓度要求较高,配制时需要使用电子天平、移液管、容量瓶等高准确度 的仪器进行配制。对于易水解的药品,在配制时要考虑如何防止水解。 1.普通溶液的配制方法和步骤 (1)计算:根据要配制溶液的体积和浓度计算出所需溶质的量,固体溶质计算出 所需质量,液体溶质计算出所需体积。 (2)称量或量取:用托盘天平称量固体溶质的质量,或用量筒量取液体溶质的体 积,放入烧杯中。 (3)溶解:用量筒量取与所需配制溶液体积相同的蒸馏水,倒入烧杯中,进行搅 拌,使之溶解均匀。有时为了加快溶解,需要进行加热。注意:浓硫酸稀释要将浓硫酸 慢慢沿壁加入水中,同时不停的搅拌。 (4)装瓶:将配制好的溶液装入试剂瓶中,贴上标签。标签内容包括:药品名称、 浓度、配制日期和配制者。 2.准确浓度溶液的配制方法和步骤 准确浓度溶液的配制:溶质是基准物质才能直接配制,或者用准确浓度的浓溶液进 行配制:溶质是非基准物质,要用配制普通溶液的方法,先配制成近似浓度的溶液,然 后进行标定。 (1)计算:根据要配制溶液的体积和浓度计算出所需溶质的量,固体溶质计算出 所需质量,液体溶质计算出所需体积。 (2)称量或量取:用电子天平称量固体溶质的质量,或用移液管量取液体溶质的 体积,放入洁净的小烧杯中
1 实验 溶液的配制 实验目的 1.学习电子天平、比重计、移液管、容量瓶的使用方法。 2.练习称量、溶解、移液等基本操作。 3.掌握溶液的一般配置方法和基本操作。 4.了解特殊溶液的配置。 实验原理 溶液的浓度指一定量溶液或溶剂中所含溶质的量。 在化学实验室经常需要配制各种溶液来满足不同实验的需要。一般定性实验所需的 溶液对浓度要求不高,利用托盘天平、量筒等仪器来配制溶液就能满足需要。而定量实 验所需的溶液对浓度要求较高,配制时需要使用电子天平、移液管、容量瓶等高准确度 的仪器进行配制。对于易水解的药品,在配制时要考虑如何防止水解。 1.普通溶液的配制方法和步骤 (1)计算:根据要配制溶液的体积和浓度计算出所需溶质的量,固体溶质计算出 所需质量,液体溶质计算出所需体积。 (2)称量或量取:用托盘天平称量固体溶质的质量,或用量筒量取液体溶质的体 积,放入烧杯中。 (3)溶解:用量筒量取与所需配制溶液体积相同的蒸馏水,倒入烧杯中,进行搅 拌,使之溶解均匀。有时为了加快溶解,需要进行加热。注意:浓硫酸稀释要将浓硫酸 慢慢沿壁加入水中,同时不停的搅拌。 (4)装瓶:将配制好的溶液装入试剂瓶中,贴上标签。标签内容包括:药品名称、 浓度、配制日期和配制者。 2.准确浓度溶液的配制方法和步骤 准确浓度溶液的配制:溶质是基准物质才能直接配制,或者用准确浓度的浓溶液进 行配制;溶质是非基准物质,要用配制普通溶液的方法,先配制成近似浓度的溶液,然 后进行标定。 (1)计算:根据要配制溶液的体积和浓度计算出所需溶质的量,固体溶质计算出 所需质量,液体溶质计算出所需体积。 (2)称量或量取:用电子天平称量固体溶质的质量,或用移液管量取液体溶质的 体积,放入洁净的小烧杯中

(3)溶解:取所需配制溶液体积约40%的蒸馏水,倒入烧杯中,进行搅拌,使之 溶解均匀。 (4)洗涤及转移:将溶解好的溶液沿玻璃棒转移到洁净的容量瓶中,然后用取所 需配制溶液体积约10%的蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤水全部转移到容量瓶中 此时溶液的液面应该在容量瓶的刻度线以下,否则要从新配制。 (5)定容:向容量瓶中加蒸馏水到刻度线以下1~2厘米,改用胶头滴管滴加蒸馏 水至凹液面刚好与刻度线相切,然后,盖好瓶塞,双手握住容量瓶,上下倒置20次, 将溶液摇匀。 (6)装瓶:将配制好的溶液装入试剂瓶中,贴上标签。标签内容包括:药品名称、 浓度、配制日期和配制者。 实验步骤 1.质量分数浓度溶液的配制: 配制5%的NaCI溶液50ml. 2.物质的量浓度溶液的配制: 用NaOH固体配制2moL-NaOH溶液50ml。 用浓硫酸配制2moL1硫酸溶液50ml, 用FeCh固体配制0.1moL-1FeCh溶液50ml。 3.准确浓度溶液的配制 用NaC1固体配制0.1000moL-lNaC1溶液100ml 用1.000molL1HAc溶液配制02000 mol-L-HAc溶液50m 数据记录 溶液 所配溶液 所需药品及用量 5%的NaC1溶液50ml NaOH 2moL-NaOH溶液50ml 2molL1硫酸溶液50ml. FeCls 0.1 mol-L-1FeCls溶液50ml 0.1000molL-NaC1溶液100ml HAc 0.2000 nol-L-HAc溶液50ml 思考与习题 1.怎样称量NaOH固体(或易潮解的固体)? 2.配制一定量的溶液时,若取用5mL浓盐酸,常用10mL量筒而不用100mL量 筒,为什么?
2 (3)溶解:取所需配制溶液体积约 40%的蒸馏水,倒入烧杯中,进行搅拌,使之 溶解均匀。 (4)洗涤及转移:将溶解好的溶液沿玻璃棒转移到洁净的容量瓶中,然后用取所 需配制溶液体积约 10%的蒸馏水洗涤烧杯和玻璃棒 2~3 次,洗涤水全部转移到容量瓶中, 此时溶液的液面应该在容量瓶的刻度线以下,否则要从新配制。 (5)定容:向容量瓶中加蒸馏水到刻度线以下 1~2 厘米,改用胶头滴管滴加蒸馏 水至凹液面刚好与刻度线相切,然后,盖好瓶塞,双手握住容量瓶,上下倒置 20 次, 将溶液摇匀。 (6)装瓶:将配制好的溶液装入试剂瓶中,贴上标签。标签内容包括:药品名称、 浓度、配制日期和配制者。 实验步骤 1.质量分数浓度溶液的配制: 配制 5%的 NaCl 溶液 50ml。 2.物质的量浓度溶液的配制: 用 NaOH 固体配制 2mol·L-1NaOH 溶液 50ml。 用浓硫酸配制 2 mol·L-1 硫酸溶液 50ml。 用 FeCl3 固体配制 0.1 mol·L-1 FeCl3 溶液 50ml。 3.准确浓度溶液的配制 用 NaCl 固体配制 0.1000mol·L-1NaCl 溶液 100ml 用 1.000mol·L-1HAc 溶液配制 0.2000mol·L-1HAc 溶液 50ml 数据记录 溶液 所配溶液 所需药品及用量 NaCl 5%的 NaCl 溶液 50ml NaOH 2mol·L-1NaOH 溶液 50ml H2SO4 2mol·L-1 硫酸溶液 50ml。 FeCl3 0.1 mol·L-1 FeCl3 溶液 50ml NaCl 0.1000mol·L-1NaCl 溶液 100ml HAc 0.2000mol·L-1HAc 溶液 50ml 思考与习题 1.怎样称量 NaOH 固体(或易潮解的固体)? 2.配制一定量的溶液时,若取用 5 mL 浓盐酸,常用 10 mL 量筒而不用 100 mL 量 筒,为什么?

3.实验室有50%的酒精200ml及足量的95%酒精,如何充分利用50%的酒精来配 制1000m75%的消毒酒精 4.用容量瓶配制溶液时,要不要把容量瓶干燥?为什么? 5.怎样洗移液管?水洗净后的移液管在使用前还要用吸取的溶液来洗涤,为什么? 6.是否需将残留在移液管尖嘴内的液体吹出,为什么? 7.由浓H2SO4配制稀H2SO4溶液过程中应注意哪些问题? 附注 1.在配制硫酸溶液时,一定将浓硫酸慢慢倒入水中,并不断搅拌,切不可将水 倒入浓硫酸中。 2.吸量管在使用前一定要用所装的溶液洗涤。 3.配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同,容 量瓶使用之前一定要检查瓶塞是否漏水。 4.不能把溶质直接放入量筒或容量瓶等量具中溶解或稀释,也不能量热液体。 5.所配制的溶液均回收。 6.说明:化学试剂的种类(原装) 代标符号:GR AR CP IP 试剂纯度:优级纯分析纯 化学纯实验试剂 瓶签颜色: 绿 红 篮 黄 7.实验报告要求简要说明实验步骤中的计算和溶液的配制过程。 实验二氧化碳分子量的测定 实验目的 1.掌握气体密度法测定二氧化碳相对分子质量的原理和方法。 2.熟悉启普发生器的使用和气体净化、干燥技术。 3.理解理想气体状态方程式和阿伏伽德罗定律。 4.了解误差的概念,学会实验结果误差的分析。 实验原理 根据理想气体状态方程PV=nRT= W PV 积的 任何气体含有相同数目的分子,所以只要在相同温度和压力下,测定相同体积的两种气 体的质量,其中一种气体的分子量已知,即可求得另一种气体的分子量。 3
3 3.实验室有 50%的酒精 200ml 及足量的 95%酒精,如何充分利用 50%的酒精来配 制 1000ml75%的消毒酒精 4.用容量瓶配制溶液时,要不要把容量瓶干燥?为什么? 5.怎样洗移液管?水洗净后的移液管在使用前还要用吸取的溶液来洗涤,为什么? 6.是否需将残留在移液管尖嘴内的液体吹出,为什么? 7.由浓 H2SO4 配制稀 H2SO4 溶液过程中应注意哪些问题? 附注 1.在配制硫酸溶液时,一定将浓硫酸慢慢倒入水中,并不断搅拌,切不可将水 倒入浓硫酸中。 2.吸量管在使用前一定要用所装的溶液洗涤。 3.配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同,容 量瓶使用之前一定要检查瓶塞是否漏水。 4.不能把溶质直接放入量筒或容量瓶等量具中溶解或稀释,也不能量热液体。 5.所配制的溶液均回收。 6.说明:化学试剂的种类(原装) 代标符号: GR AR CP LP 试剂纯度: 优级纯 分析纯 化学纯 实验试剂 瓶签颜色: 绿 红 篮 黄 7.实验报告要求 简要说明实验步骤中的计算和溶液的配制过程。 实验 二氧化碳分子量的测定 实验目的 1.掌握气体密度法测定二氧化碳相对分子质量的原理和方法。 2.熟悉启普发生器的使用和气体净化、干燥技术。 3.理解理想气体状态方程式和阿伏伽德罗定律。 4.了解误差的概念,学会实验结果误差的分析。 实验原理 根据理想气体状态方程 RT M W PV = nRT = , RT PV M W n = = ,即同温同压下同体 积的 任何气体含有相同数目的分子,所以只要在相同温度和压力下,测定相同体积的两种气 体的质量,其中一种气体的分子量已知,即可求得另一种气体的分子量

若将二氧化碳与空气均看作理想气体,在同温同压下,相同体积的二氧化碳与空气 (其 平均分子量为29.0)所含分子数目也应相同,即no,=n空气,公式推导如下 根据 n W PV MRT 则 PV (A) RT 即:在同温同压下,相同体积的两种气体的质量比等于其相对分子质量之比。 所以 。器气0 (B) 式中W。,为二氧化碳气体的质量,可通过天平称量测得,即: W空气为空气的质量,可通过公式W气=PVM空气/RT (C) (C)式中P一为实验条件下的大气压强,可由气压计读出。 T一为实验温度,可由温度计读出。 V一为盛装C0:的容器的容积。可由下式求出 V-(W本一Wp本(W本一W空1.00 为了提高测得的二氧化碳气体质量的准确性,要求测试用的二氧化碳气体纯净、干 燥,所收集的二氧化碳气体体积必须与上式中的V相等。 实验步骤 1.二氧化碳的制备、净化、干燥与收集 如图装配好二氧化碳气体发生与净化装置。石灰石与盐酸在启普发生器中反应生成 C0,气体(含有硫化氢、酸雾和水汽),通过洗气瓶2的CuSO4溶液(除去什么?)和 洗气瓶3的NaHCO溶液(除去什么?)后,经过干燥管导出的气体即为干燥的纯净的 C02气体。 1.石灰石和稀盐酸2.CuSO4溶液3.NaHC0,溶液4.无水氯化钙5.锥形瓶
4 1.石灰石和稀盐酸 2. CuSO4 溶液 3. NaHCO3 溶液 4.无水氯化钙 5.锥形瓶 若将二氧化碳与空气均看作理想气体,在同温同压下,相同体积的二氧化碳与空气 (其 平均分子量为 29.0)所含分子数目也应相同,即 nCO2 =n空气 ,公式推导如下: 根据 RT PV M W n = = 则 RT PV M W M W = = 空气 空气 2 2 CO CO (A) 即:在同温同压下,相同体积的两种气体的质量比等于其相对分子质量之比。 所以 29.0 空气 29.0 2 2 2 CO 空气 CO CO = = PVM W RT W M W (B) 式中 WCO2 为二氧化碳气体的质量,可通过天平称量测得,即: W空气 为空气的质量,可通过公式 W空气 =PVM空气 RT (C) (C)式中 P —为实验条件下的大气压强,可由气压计读出。 T —为实验温度,可由温度计读出。 V —为盛装 CO2 的容器的容积。可由下式求出 V =(W 水-W 空气)/ρ 水 ≈ (W 水-W 空气)/1.00 为了提高测得的二氧化碳气体质量的准确性,要求测试用的二氧化碳气体纯净、干 燥,所收集的二氧化碳气体体积必须与上式中的 V 相等。 实验步骤 1.二氧化碳的制备、净化、干燥与收集 如图装配好二氧化碳气体发生与净化装置。石灰石与盐酸在启普发生器中反应生成 CO2 气体(含有硫化氢、酸雾和水汽),通过洗气瓶 2 的 CuSO4 溶液(除去什么?)和 洗气瓶 3 的 NaHCO3 溶液(除去什么?)后,经过干燥管导出的气体即为干燥的纯净的 CO2 气体
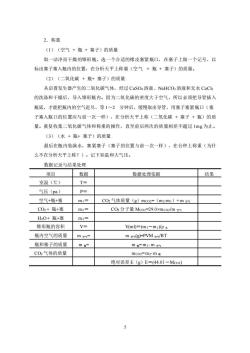
2.称重 (1)(空气+瓶+塞子)的质量 取一洁净而干燥的锥形瓶,选一个合适的橡皮塞紧瓶口,在塞子上做一个记号,以 标出塞子塞入瓶内的位置,在分析天平上称量(空气+瓶+塞子)的质量。 (2)(二氧化碳+瓶+塞子)的质量 从启普发生器产生的二氧化碳气体,经过CuSO:溶液、NaHCO:溶液和无水CaC2 的洗涤和干燥后,导入锥形瓶内。因为二氧化碳的密度大于空气,所以必须把导管插入 瓶底,才能把瓶内的空气赶尽,等1~2分钟后,缓慢取出导管,用塞子塞紧瓶口(塞 子塞入瓶口的位置应与前一次一样),在分析天平上称(二氧化碳+塞子+瓶)的质 量。重复收集二氧化碳气体和称重的操作,直至前后两次的质量相差不超过1mg为止。 (3)(水+瓶+塞子)的质量 最后在瓶内装满水,塞紧塞子(塞子的位置与前一次一样),在台秤上称重(为什 么不在分析天平上称?)。记下室温和大气压。 数据记录与结果处理 项目 数据 数据处理依据 结果 室温(℃) T= 气压(pa) P= 空气+瓶+塞 m1= C02气体质量(g)mco2=(m2-m1)+m4 C02+瓶+塞 m2三 C02分子量Mc02=29.0×mco2/m数 H20+瓶+塞 m5 锥形瓶的容积 V= Vml)=(m-m1p本 瓶内空气的质量 m m x(g)-PVMg-/RT 瓶和塞子的质量 m mmm空数 CO2气体的质量 mco2=m2-m 绝对误差E(g)E=(44.01-Mco2)
5 2.称重 (1)(空气 + 瓶 + 塞子)的质量 取一洁净而干燥的锥形瓶,选一个合适的橡皮塞紧瓶口,在塞子上做一个记号,以 标出塞子塞入瓶内的位置,在分析天平上称量(空气 + 瓶 + 塞子)的质量。 (2)(二氧化碳 + 瓶+ 塞子)的质量 从启普发生器产生的二氧化碳气体,经过 CuSO4 溶液、NaHCO3 溶液和无水 CaCl2 的洗涤和干燥后,导入锥形瓶内。因为二氧化碳的密度大于空气,所以必须把导管插入 瓶底,才能把瓶内的空气赶尽,等 1~2 分钟后,缓慢取出导管,用塞子塞紧瓶口(塞 子塞入瓶口的位置应与前一次一样),在分析天平上称(二氧化碳 + 塞子 + 瓶)的质 量。重复收集二氧化碳气体和称重的操作,直至前后两次的质量相差不超过 1mg 为止。 (3)(水 + 瓶+ 塞子)的质量 最后在瓶内装满水,塞紧塞子(塞子的位置与前一次一样),在台秤上称重(为什 么不在分析天平上称?)。记下室温和大气压。 数据记录与结果处理 项目 数据 数据处理依据 结果 室温(℃) T= 气压(pa) P= 空气+瓶+塞 m1= CO2 气体质量(g)mCO2=(m2-m1)+ m 空气 CO2 + 瓶+塞 m2= CO2 分子量 MCO2=29.0×mCO2/m 空气 H2O+ 瓶+塞 m3= 锥形瓶的容积 V= V(ml)=(m3-m1)/ρ 水 瓶内空气的质量 m 空气= m 空气(g)=PVM 空气/RT 瓶和塞子的质量 m 瓶= m 瓶= m1- m 空气 CO2 气体的质量 mCO2= m2-m 瓶 绝对误差 E(g)E=(44.01-MCO2)

思考与习题 1.为什么当(C02+瓶+塞子)达到恒重时,即可以为锥形中已充 满C02气体? 2.为什么(C02+瓶+塞子)的质量要在分析天平上称重,而(水+ 瓶+塞子)的质量则可以在台秤上称量? 3.为什么在计算锥形瓶的容量时不考虑空气的质量,而在计算C0 的质量时却要考虑空气的质量? 4.讨论C0,的净化干燥的原理。 5.做好本实验的关键有哪些?如何减少实验误差? 6.指出实验装置图中各部分的作用并写出有关反应方程式。 附注 基本知识一气压计的使用 气压计是用来测量大气压的仪器。气压计的种类很多,这里介绍本 系无机化学实验室中使用的福廷式气压计。它是以水银柱平衡大气压 力,水银柱的高度即表示大气压的大小。其主要结构是一根一端密封的 玻璃管,里面装水银。开口的一端插入水银槽内,玻璃 管顶部水银面以上的空室是真空。当拧松通气钉,大气 压力就作用在水银槽内的水银面上,使玻璃管中的水银 柱升高,水银 柱高度即与大气压平衡。扭转游标尺调节手柄使游标尺 零线基面与 玻璃管内水银柱弯月面相切,即可进行读数。 当大气压发生变化时,玻璃管内水银柱的高度与水 银槽内水银 液面的位置也发生相应的变化。由于在计算气压表的游 标尺时已补 偿了水银槽内水银液面的变化量,因而游标尺所示值经订正后,即为当时的大气压值。 附属温度表是用来测定玻璃管内水银柱和外管的温度,以便对气压计的示值进行温 度校正。 压计的观测按下列步骤进行: ①气压计必须垂直安装。旋转汞液面调节螺丝,使皮囊上方汞槽内汞面与象牙针恰 好相接触。用手指轻敲外管,使玻璃管内水银柱的弯月面处于正常状态。 ②转动标尺调节手柄,使游标尺移到稍高于水银柱的位置。慢慢移下游标尺,使游 标尺基面与水银弯月面顶端刚好相切。 ③在刻度标尺上,读取游标尺零线以下最接近的毫米整数,再读游标尺上正好与刻 度上某一刻度相吻合的刻度的数值,即为毫米读数的十分位小数。 ④读取附属温度表的温度,准确到0.1℃。 6
6 思考与习题 1.为什么当(CO2 + 瓶 + 塞子)达到恒重时,即可以为锥形中已充 满 CO2 气体? 2.为什么(CO2 + 瓶 + 塞子)的质量要在分析天平上称重,而(水 + 瓶 + 塞子)的质量则可以在台秤上称量? 3.为什么在计算锥形瓶的容量时不考虑空气的质量,而在计算 CO2 的质量时却要考虑空气的质量? 4.讨论 CO2 的净化干燥的原理。 5.做好本实验的关键有哪些?如何减少实验误差? 6.指出实验装置图中各部分的作用并写出有关反应方程式。 附注 基本知识-气压计的使用 气压计是用来测量大气压的仪器。气压计的种类很多,这里介绍本 系无机化学实验室中使用的福廷式气压计。它是以水银柱平衡大气压 力,水银柱的高度即表示大气压的大小。其主要结构是一根一端密封的 玻璃管,里面装水银。开口的一端插入水银槽内,玻璃 管顶部水银面以上的空室是真空。当拧松通气钉,大气 压力就作用在水银槽内的水银面上,使玻璃管中的水银 柱升高,水银 柱高度即与大气压平衡。扭转游标尺调节手柄使游标尺 零线基面与 玻璃管内水银柱弯月面相切,即可进行读数。 当大气压发生变化时,玻璃管内水银柱的高度与水 银槽内水银 液面的位置也发生相应的变化。由于在计算气压表的游 标尺时已补 偿了水银槽内水银液面的变化量,因而游标尺所示值经订正后,即为当时的大气压值。 附属温度表是用来测定玻璃管内水银柱和外管的温度,以便对气压计的示值进行温 度校正。 压计的观测按下列步骤进行: ①气压计必须垂直安装。旋转汞液面调节螺丝,使皮囊上方汞槽内汞面与象牙针恰 好相接触。用手指轻敲外管,使玻璃管内水银柱的弯月面处于正常状态。 ②转动标尺调节手柄,使游标尺移到稍高于水银柱的位置。慢慢移下游标尺,使游 标尺基面与水银弯月面顶端刚好相切。 ③在刻度标尺上,读取游标尺零线以下最接近的毫米整数,再读游标尺上正好与刻 度上某一刻度相吻合的刻度的数值,即为毫米读数的十分位小数。 ④读取附属温度表的温度,准确到 0.1℃

水银气压计因受温度和纬度等的影响,有一定的误差,当需要精密的气压数值时, 则需做温度、器差、重力等项校正,但由于校正后的数值和气压表读数相差很小,在通 常情况下可不进行校正。 实验氯化钠的提纯 实验目的 1.掌握用化学方法提纯NaC1的原理和方法。 2.学习溶解、沉淀、过滤、抽滤、蒸发浓缩、结晶和烘干等操作。 3.了解沉淀溶解平衡原理的应用,学习在分离提纯物质过程中,定性检验某种物 质是否已除去的方法。 实验原理 化学试剂或医用的CI都是以粗盐为原料提纯的。粗盐中除了含有泥沙等不溶性 杂质外,还含有C2、Mg*、K*、S02等相应盐类的可溶性杂质。泥沙等不溶性杂质可 将氯化钠溶于水后,用过滤的方法除去,Ca2+、Mg2+和S02-等可溶性杂质离子则要用化 学处理方法才能除去。具体方法是: 先加入稍过量的BaCh溶液,使溶液中的SO2转化为BaSO:沉淀 Ba2*+S042-=BaSO4 然后再溶液中加入Na2CO,溶液,除去Ca2+,Mg*和过量的Ba2 Ca2++CO32-=CaCO3l 2Mg2++20H-+CO32-=Mg2(OH)2CO3 Ba2++C032-=BaSO4l(多余的Ba2+) 过量的N2CO,溶液用盐酸中和。粗盐中的K与这些沉淀剂不起作用,仍留在溶液 中。由于KCI的溶解度比NaCI的大,而且在粗盐中的含量较少,所以在蒸发浓食盐溶 液时,NaC1结品出来,KCI仍留在母液中,抽滤除去。 实验步骤 1.用托盘天平称取7g粗盐,放入100ml烧杯中,加入30ml水,搅拌并加热使其 溶解,至沸腾时,边搅拌边滴加1molL1BaCh溶液(20滴),继续加热3mim。 停止加热,让溶液静置,在上层澄清中加1-2滴BaCh溶液,若无沉淀产生,示S042 己除尽:若有沉淀,需再加BaCh至SO42-沉淀完全。 2.除去Ca2+M巴+和过量Ba2+:将上述混合物加热至沸腾,边搅拌边滴加饱和Na2CO 溶液,直至沉淀完全。用普通漏斗过滤,保留母液。 7
7 水银气压计因受温度和纬度等的影响,有一定的误差,当需要精密的气压数值时, 则需做温度、器差、重力等项校正,但由于校正后的数值和气压表读数相差很小,在通 常情况下可不进行校正。 实验 氯化钠的提纯 实验目的 1.掌握用化学方法提纯 NaCl 的原理和方法。 2.学习溶解、沉淀、过滤、抽滤、蒸发浓缩、结晶和烘干等操作。 3.了解沉淀溶解平衡原理的应用,学习在分离提纯物质过程中,定性检验某种物 质是否已除去的方法。 实验原理 化学试剂或医用的 NaCl 都是以粗盐为原料提纯的。粗盐中除了含有泥沙等不溶性 杂质外,还含有 Ca 2+、Mg2+、K+、SO4 2-等相应盐类的可溶性杂质。泥沙等不溶性杂质可 将氯化钠溶于水后,用过滤的方法除去,Ca 2+、Mg2+和 SO4 2-等可溶性杂质离子则要用化 学处理方法才能除去。具体方法是: 先加入稍过量的 BaCl2 溶液,使溶液中的 SO4 2-转化为 BaSO4 沉淀, Ba 2+ + SO42- = BaSO4↓ 然后再溶液中加入 Na 2CO3 溶液,除去 Ca 2+,Mg2+和过量的 Ba 2+ Ca 2+ + CO3 2- = CaCO3↓ 2Mg2+ + 2OH- + CO3 2- = Mg2(OH)2CO3↓ Ba 2+ + CO3 2- = BaSO4↓(多余的 Ba 2+) 过量的 Na 2CO3 溶液用盐酸中和。粗盐中的 K +与这些沉淀剂不起作用,仍留在溶液 中。由于 KCl 的溶解度比 NaCl 的大,而且在粗盐中的含量较少,所以在蒸发浓食盐溶 液时,NaCl 结晶出来,KCl 仍留在母液中,抽滤除去。 实验步骤 1.用托盘天平称取 7g 粗盐,放入 100ml 烧杯中,加入 30ml 水,搅拌并加热使其 溶解,至沸腾时,边搅拌边滴加 1mol.L-1 BaCl2 溶液(20 滴),继续加热 3min。 停止加热,让溶液静置,在上层澄清中加 1~2 滴 BaCl2 溶液,若无沉淀产生,示 SO4 2- 已除尽;若有沉淀,需再加 BaCl2 至 SO4 2-沉淀完全。 2.除去 Ca 2+、Mg2+和过量 Ba 2+:将上述混合物加热至沸腾,边搅拌边滴加饱和 Na 2CO3 溶液,直至沉淀完全。用普通漏斗过滤,保留母液

3.用HC1调酸度,除去C032:在滤液中滴加2 mol.L-HC1溶液,搅匀,用玻璃棒 蘸取母液在pH试纸上检验,直至pH为3一4左右。 4.加热,蒸发,结晶:将滤液倒在蒸发皿中,用小火加热蒸发,浓缩至稀糊状(勿 蒸干),停止加热,冷却、结品、抽滤。用少量2:1酒精洗涤沉淀,抽干。 5.烘干:将抽滤得到的NaC1晶体,在干净干燥的蒸发皿中小火烘干,冷却,称重 一g,计算产率。 6.产品纯度的检验 称取粗盐和精盐各0.5g,分别用5ml蒸馏水溶解各用。 (1)SO42-的检验:各取上述两种盐溶液1ml,各加2滴1molL~BaCh溶液,观察 有无白色BaSO4沉淀。 (2)Ca2*的检验: 各取上述两种盐溶液1ml,各加几滴2molL-1HAc酸化,分别滴加3一4滴饱和 NH4hC2O:溶液,观察有无CaC2O:白色沉淀。 (3)Mg*的检验:各取上述两种盐溶液1ml,各加2~3滴2 nolL-NaOH摇匀,各 加3一4滴镁试剂,若有蓝色絮状沉淀,表示含Mg2*。 实验结果 1产品外观: (1)粗盐 (2)精盐 2计算产率 思考与习题 1.粗盐中除了含有泥沙等不溶性杂质,还会有可溶性杂质,主要有 Ca2+,Mg2+,SO42,K*,在提纯过程中涉及哪些基本操作? 2.怎样检验粗食盐中的Ca2+,Mg2+,S02离子是否沉淀完全? 3.溶液与沉淀的分离方法有哪三种? 4.在使用布氏漏斗和吸滤瓶进行减压抽滤操作时,对滤纸大小有什么样的要 求?漏斗和吸滤瓶的位置有什么要求? 5.为什么用毒性很大的BaC12而不用无毒性的CaCl,来除去S02? .加入沉淀剂除S02、Ca2+、Mg2+、Ba”时,为什么要加热? 附注 1.加热除杂质时,保持溶液呈微沸状态,当溶液体积太少时,要适当补加蒸馏 水
8 3.用 HCl 调酸度,除去 CO3 2-:在滤液中滴加 2mol.L-1HCl 溶液,搅匀,用玻璃棒 蘸取母液在 pH 试纸上检验,直至 pH 为 3-4 左右。 4.加热,蒸发,结晶:将滤液倒在蒸发皿中,用小火加热蒸发,浓缩至稀糊状(勿 蒸干),停止加热,冷却、结晶、抽滤。用少量 2:1 酒精洗涤沉淀,抽干。 5.烘干:将抽滤得到的 NaCl 晶体,在干净干燥的蒸发皿中小火烘干,冷却,称重 _ g,计算产率。 6.产品纯度的检验 称取粗盐和精盐各 0.5g,分别用 5ml 蒸馏水溶解备用。 (1) SO4 2-的检验:各取上述两种盐溶液 1ml,各加 2 滴 1mol.L-1 BaCl2 溶液,观察 有无白色 BaSO4 沉淀。 (2) Ca 2+的检验: 各取上述两种盐溶液 1ml,各加几滴 2mol.L-1HAc 酸化,分别滴加 3-4 滴饱和 (NH4)2C2O4 溶液,观察有无 CaC2O4 白色沉淀。 (3)Mg2+的检验:各取上述两种盐溶液 1ml,各加 2~3 滴 2mol.L-1NaOH 摇匀,各 加 3-4 滴镁试剂,若有蓝色絮状沉淀,表示含 Mg2+。 实验结果 1 产品外观: (1)粗盐 _ (2)精盐 _ 2 计算产率 思考与习题 1.粗盐中 除了含有 泥沙等不 溶性杂 质,还会 有可溶性 杂质,主 要有 Ca2+,Mg2+,SO4 2-,K+,在提纯过程中涉及哪些基本操作? 2.怎样检验粗食盐中的 Ca2+,Mg2+,SO4 2-离子是否沉淀完全? 3.溶液与沉淀的分离方法有哪三种? 4.在使用布氏漏斗和吸滤瓶进行减压抽滤操作时,对滤纸大小有什么样的要 求?漏斗和吸滤瓶的位置有什么要求? 5.为什么用毒性很大的 BaCl2 而不用无毒性的 CaCl2 来除去 SO4 2- ? 6.加入沉淀剂除 SO4 2、Ca2+、Mg2+、Ba2+时,为什么要加热? 附注 1.加热除杂质时,保持溶液呈微沸状态,当溶液体积太少时,要适当补加蒸馏 水

2.检查离子是否沉淀完全,应该等沉淀完全沉降,然后沿烧杯内壁滴加沉淀剂, 观察溶液是否出现混浊。 3.蒸发浓缩过程中,当有部分品体析出时,要不断用玻璃棒搅拌,以防品体飞 溅。 4.洗涤晶体时,应遵循少量多次的洗涤原则。 实验1一 一I2+厂体系平衡常数的测定 实验目的 1.测定1 亡+平衡常数。 2,了解化学平衡移动的原理 3.练习滴定操作。 实验原理 碘溶于碘化钾溶液中形成离子13,并建立下列平衡。 =I+I 在一定温度条件下其平衡常数: k-a)a)_()c() a1) y1x) c1,) 式中a为活度,Y为活度系数,c、c2以c3)为平衡浓度。由于在离子强度不大 的溶液中 ) kr)e(l,) c(I) (2) 为了测定平衡时的c,c2以、c),可用过量固体碘与已知浓度的碘化钾溶液 起摇荡,达到平衡后,取上层清液,用标准硫代硫酸钠溶液滴定。 2NaS2Oj+I2-2NaI+Na2S4Oo 由于溶液中存在Is一 一+2的平衡,所以用硫代硫酸钠溶液滴定,最终测到的 是平衡时碘和I3的总浓度。设这个浓度为c,则: c=c(12)+d(l3) 3)
9 2.检查离子是否沉淀完全,应该等沉淀完全沉降,然后沿烧杯内壁滴加沉淀剂, 观察溶液是否出现混浊。 3.蒸发浓缩过程中,当有部分晶体析出时,要不断用玻璃棒搅拌,以防晶体飞 溅。 4.洗涤晶体时,应遵循少量多次的洗涤原则。 实验 I3 - I2 + I- 体系平衡常数的测定 实验目的 1.测定 I3 - I -+I2 平衡常数。 2.了解化学平衡移动的原理。 3.练习滴定操作。 实验原理 碘溶于碘化钾溶液中形成离子 I3 -,并建立下列平衡。 I3 - I -+I2 (1) 在一定温度条件下其平衡常数: (I ) (I ) (I ) • (I ) (I ) (I ) (I ) (I ) (I ) = 3 2 3 2 3 2 c c c γ γ γ = α α α K 式中 α 为活度,γ 为活度系数,c(I - )、c(I2)、c(I3 - )为平衡浓度。由于在离子强度不大 的溶液中 ≈ (I ) (I ) (I ) - 3 2 - γ γ γ 1 (I ) (I ) (I ) ≈ - 3 2 - c c c K (2) 为了测定平衡时的 c(I - )、c(I2)、c(I3 - ),可用过量固体碘与已知浓度的碘化钾溶液一 起摇荡,达到平衡后,取上层清液,用标准硫代硫酸钠溶液滴定。 2NaS2O3+I2===2NaI+Na 2S4O6 由于溶液中存在 I3 - I -+I2 的平衡,所以用硫代硫酸钠溶液滴定,最终测到的 是平衡时碘和 I3 -的总浓度。设这个浓度为 c,则: c= c(I2)+c(I3 - ) (3)
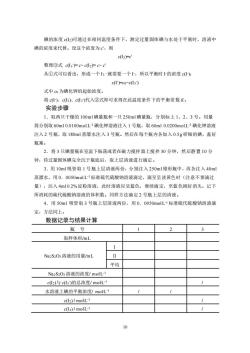
碘的浓度2)可通过在相同温度条件下,测定过量固体碘与水处于平衡时,溶液中 碘的浓度来代替。设这个浓度为,则 dc 整理③式c(l3)=c-c(I2Fcc 从①式可以看出,形成一个就需要一个上,所以平衡时上的浓度c: c(I)-co-c(13) 式中cm为碘化钾的起始浓度。 将c以c2以c)代入②式即可求得在此温度条件下的平衡常数K。 实验步骤 1.取两只干燥的100ml碘量瓶和一只250m1碘量瓶,分别标上1、2、3号。用量 筒分别取60ml0.0100molL1碘化钾溶液注入1号瓶,取60ml0.0200molL1碘化钾溶液 注入2号瓶,取180ml蒸溜水注入3号瓶。然后在每个瓶内各加入0.5g研细的碘,盖好 瓶塞。 2.将3只碘量瓶在室温下振荡或者在磁力搅拌器上搅拌30分钟,然后静置10分 钟,待过量固体碘完全沉于瓶底后,取上层清液进行滴定。 3.用10ml吸管取1号瓶上层清液两份,分别注入250ml锥形瓶中,再各注入40m 蒸溜水,用0.0050molL1标准硫代硫酸钠溶液滴定,滴至呈淡黄色时(注意不要滴过 量),注入4m10.2%淀粉溶液,此时溶液应呈蓝色,继续滴定,至蓝色刚好消失。记下 所消耗的硫代硫酸钠溶液的体积数。同样方法滴定2号瓶上层的清液。 4.用50ml吸管取3号瓶上层清液两份,用0.0050moL1标准硫代硫酸钠溶液滴 定,方法同上。 数据记录与结果计算 瓶号 取样体积/mL Na2S203溶液的用量/mL 平均 Na2SO溶液的浓度/moL c2)与cl3)的总浓度/moL 水溶液上碘的平衡浓度/molL~ c(l2)/moHL-1 c(3)/molL-I
10 碘的浓度 c(I2)可通过在相同温度条件下,测定过量固体碘与水处于平衡时,溶液中 碘的浓度来代替。设这个浓度为 c',则 c(I2)=c' 整理③式 c(I3 - )= c- c(I2)= c- c' 从①式可以看出,形成一个 I3 -就需要一个 I -,所以平衡时 I -的浓度 c(I - ): c(I - )=c0-c(I3 - ) 式中 c0 为碘化钾的起始浓度。 将 c(I - )、c(I2)、c(I3 - )代入②式即可求得在此温度条件下的平衡常数 K。 实验步骤 1.取两只干燥的 100ml 碘量瓶和一只 250ml 碘量瓶,分别标上 1、2、3 号。用量 筒分别取 60ml 0.0100mol.L-1 碘化钾溶液注入 1 号瓶,取 60ml 0.0200mol.L-1 碘化钾溶液 注入 2 号瓶,取 180ml 蒸溜水注入 3 号瓶。然后在每个瓶内各加入 0.5g 研细的碘,盖好 瓶塞。 2.将 3 只碘量瓶在室温下振荡或者在磁力搅拌器上搅拌 30 分钟,然后静置 10 分 钟,待过量固体碘完全沉于瓶底后,取上层清液进行滴定。 3.用 10ml 吸管取 1 号瓶上层清液两份,分别注入 250ml 锥形瓶中,再各注入 40ml 蒸溜水,用 0.0050mol.L-1 标准硫代硫酸钠溶液滴定,滴至呈淡黄色时(注意不要滴过 量),注入 4ml 0.2%淀粉溶液,此时溶液应呈蓝色,继续滴定,至蓝色刚好消失。记下 所消耗的硫代硫酸钠溶液的体积数。同样方法滴定 2 号瓶上层的清液。 4.用 50ml 吸管取 3 号瓶上层清液两份,用 0.0050mol.L -1 标准硫代硫酸钠溶液滴 定,方法同上。 数据记录与结果计算 瓶 号 1 2 3 取样体积/mL Na 2S2O3 溶液的用量/mL Ⅰ Ⅱ 平均 Na 2S2O3 溶液的浓度/ mol.L -1 c(I2)与 c(I3 - )的总浓度/ mol.L -1 / 水溶液上碘的平衡浓度/ mol.L -1 / / c(I2) / mol.L -1 / c(I3) / mol.L -1 /
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程教学资源(教案讲稿,共十九章).doc
- 石河子大学:《无机化学》课程教学资源(实验讲稿,共十六个实验).doc
- 石河子大学:《无机化学》课程授课教案(讲义,药学专业).doc
- 石河子大学:《无机及分析化学》课程教学资源(授课教案,材料专业).doc
- 石河子大学:《无机化学实验》课程授课教案(讲义,化工专业).doc
- 石河子大学:《无机化学》课程教学大纲 Inorganic Chemistry(化学专业).doc
- 石河子大学:《无机化学》课程教学大纲(应化、化工、环工、材料).doc
- 石河子大学:《普通化学》课程教学大纲 general chemistry(农水、土建、给排水).doc
- 《基础化学》课程教学资源(教案讲义)蛋白质和核酸.pdf
- 《基础化学》课程教学资源(教案讲义)氨基酸.pdf
- 《基础化学》课程教学资源(教案讲义)二糖和多糖.pdf
- 《基础化学》课程教学资源(教案讲义)单糖.pdf
- 《基础化学》课程教学资源(教案讲义)胺.pdf
- 《基础化学》课程教学资源(教案讲义)杂环化合物.pdf
- 《基础化学》课程教学资源(教案讲义)有机含氮化合物.pdf
- 《基础化学》课程教学资源(教案讲义)对映异构现象.pdf
- 《基础化学》课程教学资源(教案讲义)第五章 对映异构.pdf
- 《基础化学》课程教学资源(教案讲义)物质的旋光性.pdf
- 《基础化学》课程教学资源(教案讲义)羧酸衍生物.pdf
- 《基础化学》课程教学资源(教案讲义)羧酸和取代羧酸.pdf
- 石河子大学:《无机化学》课程教学资源(作业习题)第一章 气体(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第二章 热化学(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第五章 酸碱平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第四章 化学平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第六章 沉淀平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第七章 氧化还原反应(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第八章 原子结构(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第九章 分子结构(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十章 固体结构(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十一章 配合物(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十二章 s区元素——主族元素(一,含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十二章 s区元素——主族元素(二,含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十六章 d区元素——过度元素(一,含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第十六章 d区元素——过度元素(二,含参考答案).doc
- 《无机化学》课程教学资源(作业习题)北师大版无机化学(上册)部分习题答案.doc
- 《无机化学》课程教学资源(作业习题)大连理工无机化学(第五版)习题答案.pdf
- 《无机化学》课程教学实验指导书(讲义,共四十个实验).doc
- 《无机化学》课程教学资源(作业习题)计算题及答案.doc
- 《无机化学》课程教学资源(作业习题)选择题(习题).doc
- 《无机化学》课程教学资源(作业习题)选择题(答案).doc
