《基础化学》课程教学资源(教案讲义)单糖

单糖 糖类是自然界存在最多、分布最广的一类重要有机化合物,主要来自绿色植 物的光合作用。糖类是构成生物体的基本成分之一,是生物体维持生命活动所需 能量的主要来源,是生物体合成其他有机化合物的基本原料。从化学结构特点来 看,糖类是多羟基醛或多羟基酮以及它们的脱水缩合产物和衍生物。 根据糖类能否水解和水解后的产物不同,可将其分为以下三类: 单糖是不能水解的多羟基醛或多羟基酮,如葡萄糖、果糖、核糖等。 低聚糖又称寡糖,是水解后能生成2~10个单糖分子的糖,其中最常见的 是二糖,如蔗糖、麦芽糖、乳糖等。 多糖又称高聚糖,是水解后能生成10个以上单糖分子的糖,如糖原、淀粉、 纤维素等。 糖类的名称常根据其来源采用俗名。如蔗糖,葡萄糖即因其来源而得名。 一、单糖的结构 单糖按其结构分为醛糖和酮糖:按分子中所含碳原子的数目又可分为丙糖 丁糖、戊糖和己糖等。 单糖是构成低聚糖和多糖的基本单位,了解单糖的结构是研究糖类化学的基 础。 (一)葡萄糖的结构 1.葡萄糖的链状结构和构型葡萄糖的分子式为C6H1206,具有五羟基己醛 的基本结构,属于己醛糖。己醛糖的直链结构式为: CH2-CH-CH-CH-CH-COOH OHOHOHOHOH 该结构中含有4个不同的手性碳原子(C2、C3、C4、C5),应有2=16个旋 光异构体,自然界中的葡萄糖只是16个己醛糖之一。葡萄糖其分子的空间构型 用费歇尔(Fischer)投影式表示如(I),为了书写方便,还可用()或(D等简式 表示
单 糖 糖类是自然界存在最多、分布最广的一类重要有机化合物,主要来自绿色植 物的光合作用。糖类是构成生物体的基本成分之一,是生物体维持生命活动所需 能量的主要来源,是生物体合成其他有机化合物的基本原料。从化学结构特点来 看,糖类是多羟基醛或多羟基酮以及它们的脱水缩合产物和衍生物。 根据糖类能否水解和水解后的产物不同,可将其分为以下三类: 单糖 是不能水解的多羟基醛或多羟基酮,如葡萄糖、果糖、核糖等。 低聚糖 又称寡糖,是水解后能生成 2~10 个单糖分子的糖,其中最常见的 是二糖,如蔗糖、麦芽糖、乳糖等。 多糖 又称高聚糖,是水解后能生成 10 个以上单糖分子的糖,如糖原、淀粉、 纤维素等。 糖类的名称常根据其来源采用俗名。如蔗糖,葡萄糖即因其来源而得名。 一、单糖的结构 单糖按其结构分为醛糖和酮糖;按分子中所含碳原子的数目又可分为丙糖、 丁糖、戊糖和己糖等。 单糖是构成低聚糖和多糖的基本单位,了解单糖的结构是研究糖类化学的基 础。 (一)葡萄糖的结构 1.葡萄糖的链状结构和构型 葡萄糖的分子式为 C6H12O6 ,具有五羟基己醛 的基本结构,属于己醛糖。己醛糖的直链结构式为: CH2-CH-CH-CH-CH-COOH OH OH OH OH OH 该结构中含有 4 个不同的手性碳原子(C2、C3、C4、C5),应有 2 4 =16 个旋 光异构体,自然界中的葡萄糖只是 16 个己醛糖之一。葡萄糖其分子的空间构型 用费歇尔(Fischer)投影式表示如(Ⅰ),为了书写方便,还可用(Ⅱ)或(Ⅲ)等简式 表示

CHO OH OH HO- 一H HO- H -0 -OH H -OH -OH CH-OH CH-OH (1) (I) 2变旋光现象和葡萄糖的环状结构 )葡萄糖有两种比旋光度不同的晶体,从冷乙醇中结晶出来的称为-型,其 新配制的水溶液比旋光度为+112°;另一种是从热的吡啶中结晶出来的,称为B 型,其新配制的水溶液比旋光度为+18.7。上述两种水溶液的比旋光度都会逐 渐变化,并且都在达到+52.7°时保持稳定不再改变。某些旋光性化合物溶液的 旋光度自行改变逐渐达到一个定值的现象称为变旋光现象, OH H 0 HQ H H -OH HO -HO HO -HHO -OH -OH -OH OH H CH.OH -D-(+)-吡喃葡萄糖 D-(+)-葡萄糖链状结构 B-D-(+)-吡喃葡萄糖 (约36%) (微量) (约64%) 单糖成环时,醛基碳原子C,变成了一个新的手性碳原子,新形成的C-羟基 称为半缩醛羟基或苷羟基(亦称为潜在醛基),因此环状结构无论是吡喃型还是呋 喃型都有两种异构体。以直立费歇尔投影式表示D-型糖的环状结构时,其苷羟 基在碳链右侧的称为α-型,苷羟基在碳链左侧的称为阝型。 由于葡萄糖的α一型和阝-型的比旋光度不一样,而在水溶液中两种环状结构 中的任何一种均可通过开链结构相互转变,在趋向平衡的过程中,α-型和阝-型 的相对含量不断改变,溶液的比旋光度也随之发生改变,当这种互变达到平衡时, 比旋光度也就不再改变,此即葡萄糖产生变旋光现象的原因。 D-(+)-吡喃葡萄糖一开链式一阝-D-(+)-吡喃葡萄糖 [a]0=+112 [a0=+18.79 约36% 微量 约64%
CHO OH HO OH OH H H H H CH2OH CHO OH HO OH OH CH2OH (Ⅰ) (Ⅱ) (Ⅲ) 2.变旋光现象和葡萄糖的环状结构 )葡萄糖有两种比旋光度不同的晶体,从冷乙醇中结晶出来的称为 α-型,其 新配制的水溶液比旋光度为+112º;另一种是从热的吡啶中结晶出来的,称为 β- 型,其新配制的水溶液比旋光度为+18.7º。上述两种水溶液的比旋光度都会逐 渐变化,并且都在达到+52.7º时保持稳定不再改变。某些旋光性化合物溶液的 旋光度自行改变逐渐达到一个定值的现象称为变旋光现象。 C OH HO OH OH H H H H CH2OH D-(+)-吡喃葡萄糖 D-(+)-葡萄糖链状结构 -D-(+)-吡喃葡萄糖 H O C OH HO OH H H H H CH2OH O H OH C OH HO OH H H H H CH2OH O HO H (约 36%) (微量) (约 64%) 单糖成环时,醛基碳原子 C1 变成了一个新的手性碳原子,新形成的 C1-羟基 称为半缩醛羟基或苷羟基(亦称为潜在醛基),因此环状结构无论是吡喃型还是呋 喃型都有两种异构体。以直立费歇尔投影式表示 D-型糖的环状结构时,其苷羟 基在碳链右侧的称为 α-型,苷羟基在碳链左侧的称为 β-型。 由于葡萄糖的 α-型和 β-型的比旋光度不一样,而在水溶液中两种环状结构 中的任何一种均可通过开链结构相互转变,在趋向平衡的过程中,α-型和 β-型 的相对含量不断改变,溶液的比旋光度也随之发生改变,当这种互变达到平衡时, 比旋光度也就不再改变,此即葡萄糖产生变旋光现象的原因。 α-D-(+)-吡喃葡萄糖 开链式 β-D-(+)-吡喃葡萄糖 [α]20 D = +112º [α]20 D = +18.7º 约 36% 微量 约 64%
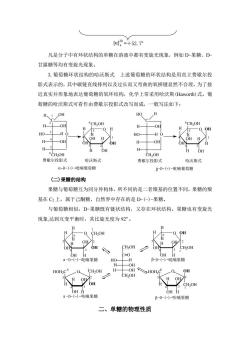
[a20=+52.7° 凡是分子中有环状结构的单糖在溶液中都有变旋光现象,例如D-果糖、D 甘露糖等均有变旋光现象。 3.葡萄糖环状结构的哈沃斯式上述葡萄糖的环状结构是用直立费歇尔投 影式表示的,其中碳链直线排列以及过长而又弯曲的氧桥键显然不合理。为了接 近真实并形象地表达葡萄糖的氧环结构,化学上常采用哈沃斯(Haworth)式。葡 萄糖的哈沃斯式可看作由费歇尔投影式改写而成,一般写法如下: HO H -OH CHOH 6CH-OH H H Q OH HO- H HO HH H -OH 6CH-OH 费歇尔投影式 哈沃斯式 费敏尔投影式 哈沃斯式 aD-(+)-吡喃葡萄糖 B-D-()-吡喃葡萄糖 (二)果糖的结构 果糖与葡萄糖互为同分异构体,所不同的是二者羰基的位置不同,果糖的羰 基在C2上,属于己酮糖,自然界中存在的是D-(-)-果糖 与葡萄糖相似,D-果糖既有链状结构,又存在环状结构。果糖也有变旋光 现象,达到互变平衡时,其比旋光度为92°。 CH.OH H -Q OH OH H B-D-一)-吡南果糖 CH.OH H HOH.C OH CH2OH OH H OH H -D)呋喃果糖 B-D-(一)-呋喃果糖 二、单糖的物理性质
[α]20 D =+52.7º 凡是分子中有环状结构的单糖在溶液中都有变旋光现象,例如 D-果糖、D- 甘露糖等均有变旋光现象。 3.葡萄糖环状结构的哈沃斯式 上述葡萄糖的环状结构是用直立费歇尔投 影式表示的,其中碳链直线排列以及过长而又弯曲的氧桥键显然不合理。为了接 近真实并形象地表达葡萄糖的氧环结构,化学上常采用哈沃斯(Haworth)式。葡 萄糖的哈沃斯式可看作由费歇尔投影式改写而成,一般写法如下: C OH HO OH H H H H CH2OH O H OH C OH HO OH H H H H CH2OH O HO H 3 4 5 2 6 3 4 5 6 1 费歇尔投影式 哈沃斯式 费歇尔投影式 哈沃斯式 2 1 O OH H OH H H OH OH H CH2OH 3 4 5 6 2 1 O OH H OH H H OH OH H CH2OH H D-(+)-吡喃葡萄糖 -D-(+)-吡喃葡萄糖 H (二)果糖的结构 果糖与葡萄糖互为同分异构体,所不同的是二者羰基的位置不同,果糖的羰 基在 C2 上,属于己酮糖,自然界中存在的是 D-(-)-果糖。 与葡萄糖相似,D-果糖既有链状结构,又存在环状结构。果糖也有变旋光 现象,达到互变平衡时,其比旋光度为 92º。 a -D (-)-吡喃果糖 β O 1 2 β a -D-(-)-呋喃果糖 3 4 5 6 2 1 O OH H OH H H OH OH H CH2OH H 4 3 5 6 2 1 O OH H OH H H OH OH H CH2OH H CH2OH OH HOH2C OH H H OH H 3 4 5 6 O 1 2 3 CH2OH HOH OH 2C OH H H OH H 4 5 6 CH2OH C=O CH2OH OH OH HO H H H -D-(-)-呋喃果糖 -D-(-)-吡喃果糖 二、单糖的物理性质

单糖都是结晶性物质,具有吸湿性,易溶于水,难溶于有机溶剂。单糖都有 甜味,但甜度各不相同。凡能发生开链结构和环状结构互变单糖都有变旋光现象。 三、单糖的化学性质 (一)差向异构化 含有多个手性碳原子的旋光异构体若只有一个手性碳原子的构型不同,它们 互称为差向异构体。例如D葡萄糖和D-甘露糖只是手性碳原子C2的构型不同, 其他手性碳原子的构型完全相同,所以它们互为差向异构体,称为Cz差向异构 体。此外,葡萄糖和半乳糖只是手性碳原子C:构型不同,属于C4-差向异构体 用稀碱溶液处理D-葡萄糖、D-甘露糖和D-果糖中的任何一种,都可得到 这三种单糖的互变平衡混合物,这是因为糖在稀碱作用下可形成烯二醇式中间体, 烯二醇式中间体很不稳定,能可逆地进行不同方式的互变异构化,从而实现三种 单糖之间的相互转变。生物体内,在酶的催化下,也能发生类似转化。 H OH COH烯醇式中间体 HOH CH-OH 0 0 H OH 0 -OH H-OH CHOH D-简萄轴 D-甘落糖 D果糖 在上述互变异构化反应中既有醛糖和酮糖(D-葡萄糖、D-甘露糖与D-果糖) 之间的互变异构化,也有差向异构体(D-葡萄糖和D-甘露糖)之间的互变异构 化,其中差向异构体之间的互变异构化称为差向异构化。 在碱性条件下,酮糖能显示某些醛糖的性质(如还原性),就是因为此时酮 糖可异构化为醛糖。 (二)氧化反应 1.与弱氧化剂反应单糖无论是醛糖或酮糖都可与碱性弱氧化剂发生氧化
单糖都是结晶性物质,具有吸湿性,易溶于水,难溶于有机溶剂。单糖都有 甜味,但甜度各不相同。凡能发生开链结构和环状结构互变单糖都有变旋光现象。 三、单糖的化学性质 (一)差向异构化 含有多个手性碳原子的旋光异构体若只有一个手性碳原子的构型不同,它们 互称为差向异构体。例如 D-葡萄糖和 D-甘露糖只是手性碳原子 C2的构型不同, 其他手性碳原子的构型完全相同,所以它们互为差向异构体,称为 C2-差向异构 体。此外,葡萄糖和半乳糖只是手性碳原子 C4 构型不同,属于 C4-差向异构体。 用稀碱溶液处理 D-葡萄糖、D-甘露糖和 D-果糖中的任何一种,都可得到 这三种单糖的互变平衡混合物,这是因为糖在稀碱作用下可形成烯二醇式中间体, 烯二醇式中间体很不稳定,能可逆地进行不同方式的互变异构化,从而实现三种 单糖之间的相互转变。生物体内,在酶的催化下,也能发生类似转化。 CH2OH H OH H OH HO H H OH C H D-葡萄糖 D-甘露糖 D-果糖 CH2OH C H CH2OH C=O CH2OH HO H H C H OH H OH HO H OH C H OH H CH2OH OH H H OH H H HO HO O O OH OH 烯醇式中间体 在上述互变异构化反应中既有醛糖和酮糖(D-葡萄糖、D-甘露糖与 D-果糖) 之间的互变异构化,也有差向异构体(D-葡萄糖和 D-甘露糖)之间的互变异构 化,其中差向异构体之间的互变异构化称为差向异构化。 在碱性条件下,酮糖能显示某些醛糖的性质(如还原性),就是因为此时酮 糖可异构化为醛糖。 (二)氧化反应 1.与弱氧化剂反应 单糖无论是醛糖或酮糖都可与碱性弱氧化剂发生氧化

反应。常用的碱性弱氧化剂有托伦(Tollens)试剂、斐林(Fehling)试剂和班氏 (Benedict).试剂。单糖被托伦试剂氧化产生银镜,与班氏试剂和斐林试剂反应生 成砖红色的Cu20沉淀。 单糖+Ag(配离子)H→糖酸(混合物)+Ag! 单糖+C㎡(配离子)OI二→糖酸(混合物)+Cu,0! 酮糖能发生上述反应是因为在碱性条件下能异构化为醛糖。 凡能与托伦试剂、班氏试剂、斐林试剂反应的糖称为还原糖:不能反应的糖 称为非还原糖。单糖都是还原糖。托伦试剂、班氏试剂、斐林试剂常用于单糖的 定性或定量测定。 2.与溴水反应溴水是一种酸性弱氧化剂,能把醛糖氧化成为醛糖酸,而不 能氧化糖。醛糖溶液中加溴水,稍微加热后,溴水的红棕色即可褪去,利用这 个性质可区别醛糖和酮糖。 HO-H D-葡萄糖 D-葡萄糖酸 3.与稀硝酸反应用强氧化剂如稀硝酸氧化醛糖时,醛基和羟甲基均被氧化 成羧基,生成糖二酸。如D-葡萄糖被硝酸氧化则生成D-葡萄糖二酸。 HO十H Ho十H CH-OH D-葡萄糖 D葡萄糖二酸 酮糖在上述条件下则发生C1一C2键断裂,生成较小分子的二元酸。 (三)生成糖脎 单糖和过量的苯肼一起加热即生成糖脎。生成糖脎是α羟基醛或α-羟基酮 的特有反应。D-葡萄糖、D-果糖与苯肼反应生成糖脎的总反应如下:
反应。常用的碱性弱氧化剂有托伦(Tollens)试剂、斐林(Fehling)试剂和班氏 (Benedict)试剂。单糖被托伦试剂氧化产生银镜,与班氏试剂和斐林试剂反应生 成砖红色的 Cu2O 沉淀。 单糖 + Ag+ (配离子) OH - 糖酸(混合物) + Ag↓ 单糖 + Cu2+(配离子) OH - 糖酸(混合物) + Cu2O↓ 酮糖能发生上述反应是因为在碱性条件下能异构化为醛糖。 凡能与托伦试剂、班氏试剂、斐林试剂反应的糖称为还原糖;不能反应的糖 称为非还原糖。单糖都是还原糖。托伦试剂、班氏试剂、斐林试剂常用于单糖的 定性或定量测定。 2.与溴水反应 溴水是一种酸性弱氧化剂,能把醛糖氧化成为醛糖酸,而不 能氧化酮糖。醛糖溶液中加溴水,稍微加热后,溴水的红棕色即可褪去,利用这 个性质可区别醛糖和酮糖。 CH2OH H OH H OH HO H H OH CHO D-葡萄糖 溴水 CH2OH H OH H OH HO H H OH COOH D-葡萄糖酸 3.与稀硝酸反应 用强氧化剂如稀硝酸氧化醛糖时,醛基和羟甲基均被氧化 成羧基,生成糖二酸。如 D-葡萄糖被硝酸氧化则生成 D-葡萄糖二酸。 CH2OH H OH H OH HO H H OH CHO D-葡萄糖 COOH H OH H OH HO H H OH COOH D-葡萄糖二酸 稀硝酸 100℃ 酮糖在上述条件下则发生 C1-C2 键断裂,生成较小分子的二元酸。 (三)生成糖脎 单糖和过量的苯肼一起加热即生成糖脎。生成糖脎是 α-羟基醛或 α-羟基酮 的特有反应。D-葡萄糖、D-果糖与苯肼反应生成糖脎的总反应如下:

CHO CH-N-NH-CHa CH2OH C=N-NH-CHs =0 H HaN-NH-CHs HO- N-NH-Cal,HOH H-COH -0 H-C-OH CHOH CHOH CH.OH D葡萄糖 糖豚 D-果糖 糖脎是黄色结晶,不同的糖脎晶型不同,各有一定的熔点,所以成脎反应常 用作糖的定性反应和制备衍生物用。 (四)成苷反应 单糖环状结构中的苷羟基活泼性高于一般的醇羟基,能与含活泼氢的化合物 脱水,生成的产物称为糖苷,此反应则称为成苷反应。 例如:D-葡萄糖在干燥HC的催化下可与甲醇反应生成D-葡萄糖甲苷。成 苷的产物是型和阝型的混合物,以a-型为主,反应式如下: CHOH CH OH H -Q H OH H CH H OH H CH2OH +2CH,OH操HCa-D-葡萄糖甲苷 -Q OH CHOH -Q OCH OH HOH D-葡萄糖 B-D-吡喃葡萄糖甲苷 形成糖苷时,单糖脱去苷羟基后的部分称为糖苷基,另一种含活泼氢的化合 物脱去活泼氢后的部分称为糖苷配基或苷元。 (五)显色反应 1.莫立许(Molish)反应a-萘酚的乙醇溶液称为莫立许试剂。在糖的水溶液 中加入莫立许试剂,然后沿试管壁缓慢加入浓硫酸,静置,密度比较大的浓硫酸 沉到管底。在糖溶液与浓硫酸的交界面很快出现美丽的紫色环,此反应称为莫立 许反应。 单糖、低聚糖和多糖均能发生莫立许反应,而且这个反应非常灵敏,因此常 用于糖类物质的鉴定
D-葡萄糖 糖脎 H2N-NH-C6H5 N-NH-C6H5 D-果糖 H2N-NH-C6H5 C OH CHO C C C CH2OH OH OH HO H H H H C= C C C CH2OH OH OH HO H H H CH= N-NH-C6H5 C=O C C C CH2OH OH OH HO H H H CH2OH 糖脎是黄色结晶,不同的糖脎晶型不同,各有一定的熔点,所以成脎反应常 用作糖的定性反应和制备衍生物用。 (四)成苷反应 单糖环状结构中的苷羟基活泼性高于一般的醇羟基,能与含活泼氢的化合物 脱水,生成的产物称为糖苷,此反应则称为成苷反应。 例如:D-葡萄糖在干燥 HCl 的催化下可与甲醇反应生成 D-葡萄糖甲苷。成 苷的产物是 α-型和 β-型的混合物,以 α-型为主,反应式如下: β -D-吡喃葡萄糖甲苷 + 2 CH3OH 干燥HCl D-葡萄糖 α -D-吡喃葡萄糖甲苷 OCH3 O OH OH H OH H H OH H H CH2OH O OH OH H OH H H OH H H CH2OH O OH OH H OH H H H H CH2OH O OH OH H OH H H H CH2OH OCH3 H 形成糖苷时,单糖脱去苷羟基后的部分称为糖苷基,另一种含活泼氢的化合 物脱去活泼氢后的部分称为糖苷配基或苷元。 (五) 显色反应 1.莫立许(Molish)反应 α-萘酚的乙醇溶液称为莫立许试剂。在糖的水溶液 中加入莫立许试剂,然后沿试管壁缓慢加入浓硫酸,静置,密度比较大的浓硫酸 沉到管底。在糖溶液与浓硫酸的交界面很快出现美丽的紫色环,此反应称为莫立 许反应。 单糖、低聚糖和多糖均能发生莫立许反应,而且这个反应非常灵敏,因此常 用于糖类物质的鉴定

2.塞利凡诺夫(Seliwanoff)反应间苯二酚的盐酸溶液称为塞利凡诺夫试剂。 在酮糖(游离态或结合态)的溶液中,加入塞利凡诺夫试剂并加热,很快出现鲜红 色产物,此反应称为塞利凡诺夫反应。 同样条件下,醛糖比酮糖的显色反应慢15~20倍,据此可鉴别醛糖和酮糖。 四、重要的单糖 (一)D-核糖和D-2-脱氧核糖 D-核糖和D-2-脱氧核糖是两种极为重要的戊醛糖,具有左旋光性,它们也 具有开链结构和环式结构,通常以呋喃糖形式存在。 (二)D-葡萄糖 D葡萄糖是自然界分布最广的单糖,在葡萄中含量较多,因而得名,它是 构成糖苷和许多低聚糖、多糖的组成部分。D-葡萄糖的水溶液具有右旋光性, 所以又称其为右旋糖,其甜度约为蔗糖的70%。 葡萄糖是人体所需能量的主要来源。人和动物的血液中也含有葡萄糖(血糖), 正常人空腹时的血糖浓度为3.9~6.1molL,保持血糖浓度的恒定具有重要的 生理意义。一般情况下,人的尿液中无葡萄糖,但糖尿病患者因体内糖代谢紊乱 其尿液中带有葡萄糖。 葡萄糖在工业上多由淀粉水解制得。在医药上可用作营养品,具有强心、利 尿和解毒的作用:在人体失血、失水时常用葡萄糖溶液补充体液,增加能量:还 可用于治疗水肿、心肌炎、血糖过低等。 (三)D-果糖 D-果糖是最甜的一种糖,以游离状态存在于水果和蜂蜜中。D-果糖的水溶 液具有左旋光性,因此又称其为左旋糖。 (四)D-半乳糖 D-半乳糖是D-葡萄糖的C4差向异构体,二者结合形成乳糖,存在于哺乳 动物的乳汁中。半乳糖具有右旋光性,其甜度仅为蔗糖的30%。 人体中的半乳糖是乳糖的水解产物,半乳糖在酶作用下发生差向异构化生成 葡萄糖,然后参与代谢,为母乳喂养的婴儿提供能量
2.塞利凡诺夫(Seliwanoff)反应 间苯二酚的盐酸溶液称为塞利凡诺夫试剂。 在酮糖(游离态或结合态)的溶液中,加入塞利凡诺夫试剂并加热,很快出现鲜红 色产物, 此反应称为塞利凡诺夫反应。 同样条件下,醛糖比酮糖的显色反应慢 15~20 倍,据此可鉴别醛糖和酮糖。 四、重要的单糖 (一)D-核糖和 D-2-脱氧核糖 D-核糖和 D-2-脱氧核糖是两种极为重要的戊醛糖,具有左旋光性,它们也 具有开链结构和环式结构,通常以呋喃糖形式存在。 (二)D-葡萄糖 D-葡萄糖是自然界分布最广的单糖,在葡萄中含量较多,因而得名,它是 构成糖苷和许多低聚糖、多糖的组成部分。D-葡萄糖的水溶液具有右旋光性, 所以又称其为右旋糖,其甜度约为蔗糖的 70%。 葡萄糖是人体所需能量的主要来源。人和动物的血液中也含有葡萄糖(血糖), 正常人空腹时的血糖浓度为 3.9~6.1mmol∙L -1,保持血糖浓度的恒定具有重要的 生理意义。一般情况下,人的尿液中无葡萄糖,但糖尿病患者因体内糖代谢紊乱 其尿液中带有葡萄糖。 葡萄糖在工业上多由淀粉水解制得。在医药上可用作营养品,具有强心、利 尿和解毒的作用;在人体失血、失水时常用葡萄糖溶液补充体液,增加能量;还 可用于治疗水肿、心肌炎、血糖过低等。 (三)D-果糖 D-果糖是最甜的一种糖,以游离状态存在于水果和蜂蜜中。D-果糖的水溶 液具有左旋光性,因此又称其为左旋糖。 (四)D-半乳糖 D-半乳糖是 D-葡萄糖的 C4 差向异构体,二者结合形成乳糖,存在于哺乳 动物的乳汁中。半乳糖具有右旋光性,其甜度仅为蔗糖的 30%。 人体中的半乳糖是乳糖的水解产物,半乳糖在酶作用下发生差向异构化生成 葡萄糖,然后参与代谢,为母乳喂养的婴儿提供能量
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程教学资源(教案讲义)胺.pdf
- 《基础化学》课程教学资源(教案讲义)杂环化合物.pdf
- 《基础化学》课程教学资源(教案讲义)有机含氮化合物.pdf
- 《基础化学》课程教学资源(教案讲义)对映异构现象.pdf
- 《基础化学》课程教学资源(教案讲义)第五章 对映异构.pdf
- 《基础化学》课程教学资源(教案讲义)物质的旋光性.pdf
- 《基础化学》课程教学资源(教案讲义)羧酸衍生物.pdf
- 《基础化学》课程教学资源(教案讲义)羧酸和取代羧酸.pdf
- 《基础化学》课程教学资源(教案讲义)羧酸.pdf
- 《基础化学》课程教学资源(教案讲义)醛、酮、醌.pdf
- 《基础化学》课程教学资源(教案讲义)醛和酮.pdf
- 山东中医药高等专科学校:《基础化学》课程授课教案(PPT课件)醚.pptx
- 《基础化学》课程教学资源(教案讲义)酚和醚.pdf
- 《基础化学》课程教学资源(教案讲义)醇.pdf
- 《基础化学》课程教学资源(教案讲义)卤代烃.pdf
- 《基础化学》课程教学资源(教案讲义)卤代烃.pdf
- 《基础化学》课程教学资源(教案讲义)芳香烃.pdf
- 《基础化学》课程教学资源(教案讲义)芳香烃.pdf
- 《基础化学》课程教学资源(教案讲义)烯烃和炔烃.pdf
- 《基础化学》课程教学资源(教案讲义)不饱和烃.pdf
- 《基础化学》课程教学资源(教案讲义)二糖和多糖.pdf
- 《基础化学》课程教学资源(教案讲义)氨基酸.pdf
- 《基础化学》课程教学资源(教案讲义)蛋白质和核酸.pdf
- 石河子大学:《普通化学》课程教学大纲 general chemistry(农水、土建、给排水).doc
- 石河子大学:《无机化学》课程教学大纲(应化、化工、环工、材料).doc
- 石河子大学:《无机化学》课程教学大纲 Inorganic Chemistry(化学专业).doc
- 石河子大学:《无机化学实验》课程授课教案(讲义,化工专业).doc
- 石河子大学:《无机及分析化学》课程教学资源(授课教案,材料专业).doc
- 石河子大学:《无机化学》课程授课教案(讲义,药学专业).doc
- 石河子大学:《无机化学》课程教学资源(实验讲稿,共十六个实验).doc
- 《无机化学》课程教学资源(教案讲稿,共十九章).doc
- 《无机化学》课程教学资源(实验讲稿).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第一章 气体(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第二章 热化学(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第五章 酸碱平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第四章 化学平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第六章 沉淀平衡(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第七章 氧化还原反应(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第八章 原子结构(含参考答案).doc
- 石河子大学:《无机化学》课程教学资源(作业习题)第九章 分子结构(含参考答案).doc
