兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第一章 化学热力学基础(第二定律)

维原一一章?动早 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生 主讲教师:董文魁、许力、李静萍等
使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生 主讲教师:董文魁、许力、李静萍等

学习目的和要求: 掌握自发过程的定义,掌握熵、熵变和绝 对熵的概念、意义。 掌屋化学反应的标准摩尔吉布斯函数的引 入和△rGm(T)的近似计算,能用其判 定化学反应进行的方向。 掌握热力学第二定律
学习目的和要求: 掌握自发过程的定义. 掌握熵、熵变和绝 对熵的概念、意义。 掌握化学反应的标准摩尔吉布斯函数的引 入和△rGθm(T)的近似计算,能用其判 定化学反应进行的方向。 掌握热力学第二定律
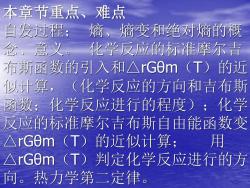
本章节重点、难点 自发过程;熵、熵变和绝对熵的概 念、意。化学反应的标准摩尔吉青 布斯函数的引入和△rGm(T)的近 似计算,(化学反应的方向和吉布斯 函数;化学反应进行的程度);化学 反应的标准摩尔吉布斯自由能函数变 △rG0m(T)的近似计算;用 △rGm(T)判定化学反应进行的方 向。热力学第二定律
本章节重点、难点 自发过程; 熵、熵变和绝对熵的概 念、意义。 化学反应的标准摩尔吉 布斯函数的引入和△rGθm(T)的近 似计算,(化学反应的方向和吉布斯 函数;化学反应进行的程度);化学 反应的标准摩尔吉布斯自由能函数变 △rGθm(T)的近似计算; 用 △rGθm(T)判定化学反应进行的方 向。热力学第二定律

学时分配 1,自发过程与其相关的概念(0.5学时) 2.熵、熵变和绝对熵的概念、意义(2学 时)。 3,化学反应的标准摩尔吉布斯函数的引入和 △rG0m(T)的近似计算,能用其判定化学 反应进行的方向。(2学时)
学时分配 1. 自发过程与其相关的概念(0.5学时)。 2. 熵、熵变和绝对熵的概念、意义(2学 时)。 3. 化学反应的标准摩尔吉布斯函数的引入和 △rGθm(T)的近似计算,能用其判定化学 反应进行的方向。(2学时)

1自发变化 水从高处流向低处: 热从高温物体传向低温物体; 铁在潮湿的空气中锈蚀; 锌置换硫酸铜溶液反应: Zn(s)+Cu2+(aq)Zn2+(ag)+Cu(s) 在没有外界作用下,系统自身发生 变化的过程称为自发变化
1 自发变化 •水从高处流向低处; •热从高温物体传向低温物体; •铁在潮湿的空气中锈蚀; •锌置换硫酸铜溶液反应: 在没有外界作用下,系统自身发生 变化的过程称为自发变化。 Zn(s)+Cu2+(aq) Zn2+(aq)+Cu(s)


2焓和自发变化 许多放热反应能够自发进行。例如: Hgr20,g)→H00 △H298K=-285.83 kJ'mol- H(aq)+OH(aq)→H2O) △H(298K)=-55.84 kJmol- 最低能量原理(焓变判据): 1878年,法国化学家M.Berthelot和丹麦 化学家J.Thomsen:提出:自发的化学反应趋 向于使系统放出最多的能量
许多放热反应能够自发进行。例如: 最低能量原理(焓变判据): 1878年,法国化学家M.Berthelot和丹麦 化学家 J.Thomsen提出:自发的化学反应趋 向于使系统放出最多的能量。 2 焓和自发变化 (298K) = -285.83kJ·mol-1 △ rHm H2 (g)+ O2 (g) → H2O(l) 2 1 (298K) = -55.84kJ·mol-1 △ rHm H+ (aq) + OH- (aq) → H2O(l)

有些吸热反应也能自发进行。例如: NH,Cl(s)→NH'(aq)+C(aq) △rH-9.76 kJ.mol- CaCO(s)△,CaO(s)+CO2(g) △rl9=17832 kJmol-1 H,0010C HO(g〉 △/=44.0 kJ:mol-1 焓变只是影响反应自发性的因素之一, 但不是唯一的影响因素
焓变只是影响反应自发性的因素之一, 但不是唯一的影响因素。 有些吸热反应也能自发进行。例如: ⎯⎯⎯⎯→ 100 C H2O(l) H2O(g) CaCO3 (s) CaO(s)+CO2 (g) NH4Cl (s) →NH4 + (aq)+Cl- (aq) = 9.76kJ·mol-1 △ rHm = 178.32kJ·mol-1 △ rHm = 44.0kJ·mol-1 △ rHm

3 混乱度、熵和微观态数 1.混乱度 许多自发过程有混乱度增加的趋势。 ·冰的融化 建筑物的倒塌 系统有趋向于最大混乱度的倾向 系统混乱度增大有利于反应自发地进行
1.混乱度 • 冰的融化 • 建筑物的倒塌 系统有趋向于最大混乱度的倾向, 系统混乱度增大有利于反应自发地进行。 3 混乱度、熵和微观态数 许多自发过程有混乱度增加的趋势

2.熵和微观状态数 嫡是表示系统中微观粒子混乱度的一个 热力学函数,其符号为S。 系统的混乱度愈大,熵愈大。 嫡是状态函数。 嫡的变化只与始态、终态有关,而与途 径无关
熵是表示系统中微观粒子混乱度的一个 热力学函数,其符号为S。 系统的混乱度愈大,熵愈大。 熵是状态函数。 熵的变化只与始态、终态有关,而与途 径无关。 2.熵和微观状态数
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学多媒体教学课件相关研究.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验课程的相关探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学考核体系的建立及效果.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学课程建设的主要措施及成效.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验的任务及其措施的探讨.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革的探索与实践.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷H.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷G.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷F.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷E.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学作业批改.doc
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第七章 化学与环境.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第三章 溶液与离子平衡.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第二章 化学动力学基础.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第五章 物质结构基础.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第八章 化学与工程材料.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第六章 化学与能源.ppt
- 兰州交通大学:《环境化学》课程教学资源(课件讲稿)第一章 绪论(负责人:赵保卫).pdf
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题02参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题03参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题04参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题05参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题06参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题02试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题03试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题04试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题05试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题06试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷九.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷二.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷八.doc
