兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学作业批改

工程化学作业批改时发现的常见间圆 关于盖斯定律的用途:用盖斯定律,可以使热化学方程式能够像普通代数方程式那样进行 运算,可以根据已知反应的热效应来计算难以测定或未知反应的反应热。盖斯定律是在热 力学第一定律建立之前提出的。由热力学第一定律可以得出不做非体积功时,恒容条件下 Qv=AU,恒压条件下Qp=△H。因为△U和△H与过程的途径无关,只要反应物和产物的 状态确定,不论反应是一步还是分几步完成,其Q,Q都是定值 同学们一定要注意应用的条件。 关于m的理解:△Hm°,△Gm°,△Sm°的单位中都有“m”,此处的"mol”不是指1mol 产物或1m0反应物,而是指1mo的化学反应。对化学反应aA+bB=dD+eE而言,当反应消 mol的A物质 B 物质,同时生成 l的D物质和e o1的E物质时 称该反应技 所给的化学反应方程式进行了1个mol的化学反应 ,即1mo化学反应指各物质的量的变化在 数值上正好等于化学反应方程式中各自的化学计量系数。也可以说反应进度为1m0。 同学们要注意这里的m,与以前学的m是完全不同的概念 关于状态函数:状态函数是描述系统状态的物理量。状态函数具有下列三个性质系统的状 态确定后,状 函数有惟 确定值。)系统的状态发 化,则状老 的值也发生变化 其变化值只取决于系统的始态和终态,而与变化途径无关。当系统恢复原状态时,状态西 数也恢复原来的值。显然,循环过程的状态函数变化值为零。根据这一点,可以判断功和 热不是状态函数。 同学们要注意如何判断状态函数 关于自发问题:“凡是自发过程都要对外做功:凡是非自发过程都要消耗外功”。这种说 法后半句对,前半句不对。非自发过程如果不消耗外功,就不能继续进行。因此,凡是非 自发过程都要消耗外功。自发过程进行时,可以对外做功(如水从高处流到低处,可利用 水位差发电或推动水车做功),也可以不对外做功(如两种气体的混合过程、热传导过程 等) 所以,题中的前半 话不对。可以说 “自发过程具 有 对外做功日 但“具有 对外做功的能力”并不等于 定要对外做功1 同学们要注意自发过程是在没有外力下自动进行的过程 关于标准平衡常数和化学平衡的关系:标准平衡常数改变,说明温度发生了变化,平衡一 定移动。平衡发生移动,标准平衡常数不一定改变。若温度保持不变,但反应物浓度或分 压等其他因素改变而引起平衡的移动,这时标准平衡常数不变:若由于温度改变引起平衡 移动,这时标准平衡常数改变。 同学们要注意彭亨和平衡常数的关系 关于状态:“标准状态”与“标准状况的含义是不同的。“标准状态”简称“标准态” 或“标态”。对于 气体,其标准态是指气体的分压均为10 对于溶液,其标准 态指处于下,溶质的浓度均为1mokg:液体和固体的标准态则是指处于下的纯物质, “标准态”中对温度并未作出规定。有些同学看到一般的热力学数据多为298K下的数值, 就误认为标准态的另一个条件是"298K”,这是不正确的。所谓“标准状况”,是指气体 在压力为1个标准大气压(即101.325ka)、温度为0℃时所处的状况。它对压力(101.325
工程化学作业批改时发现的常见问题 关于盖斯定律的用途:用盖斯定律,可以使热化学方程式能够像普通代数方程式那样进行 运算,可以根据已知反应的热效应来计算难以测定或未知反应的反应热。盖斯定律是在热 力学第一定律建立之前提出的。由热力学第一定律可以得出不做非体积功时,恒容条件下 Qv=AU,恒压条件下Qp=ΔH。因为ΔU和ΔH与过程的途径无关,只要反应物和产物的 状态确定,不论反应是一步还是分几步完成,其Qv,Qp都是定值。 同学们一定要注意应用的条件。 关于m的理解:ΔHmº,ΔGmº, ΔSmº的单位中都有“m”,此处的"mol”不是指1 mol 产物或1 mol反应物,而是指1 mol的化学反应。对化学反应aA+bB = dD+eE而言,当反应消 耗掉amol的A物质,bmol的B物质,同时生成dmol的D物质和emol的E物质时,称该反应按 所给的化学反应方程式进行了1个mol的化学反应。即l mol化学反应指各物质的量的变化在 数值上正好等于化学反应方程式中各自的化学计量系数。也可以说反应进度为1 mol。 同学们要注意这里的m,与以前学的m是完全不同的概念 关于状态函数:状态函数是描述系统状态的物理量。状态函数具有下列三个性质系统的状 态确定后,状态函数有惟一确定值。)系统的状态发生变化,则状态函数的值也发生变化, 其变化值只取决于系统的始态和终态,而与变化途径无关。当系统恢复原状态时,状态函 数也恢复原来的值。显然,循环过程的状态函数变化值为零。根据这一点,可以判断功和 热不是状态函数。 同学们要注意如何判断状态函数 关于自发问题:“凡是自发过程都要对外做功;凡是非自发过程都要消耗外功”。这种说 法后半句对,前半句不对。非自发过程如果不消耗外功,就不能继续进行。因此,凡是非 自发过程都要消耗外功。自发过程进行时,可以对外做功(如水从高处流到低处,可利用 水位差发电或推动水车做功),也可以不对外做功(如两种气体的混合过程、热传导过程 等)。所以,题中的前半句话不对。可以说“自发过程具有对外做功的能力”,但“具有 对外做功的能力”并不等于“一定要对外做功”。 同学们要注意自发过程是在没有外力下自动进行的过程 关于标准平衡常数和化学平衡的关系:标准平衡常数改变,说明温度发生了变化,平衡一 定移动。平衡发生移动,标准平衡常数不一定改变。若温度保持不变,但反应物浓度或分 压等其他因素改变而引起平衡的移动,这时标准平衡常数不变;若由于温度改变引起平衡 移动,这时标准平衡常数改变。 同学们要注意彭亨和平衡常数的关系 关于状态:“标准状态”与“标准状况”的含义是不同的。“标准状态”简称“标准态” 或“标态”。对于气体,其标准态是指气体的分压均为100kPa,即Pº;对于溶液,其标准 态指处于Pº下,溶质的浓度均为1mol/kg;液体和固体的标准态则是指处于Pº下的纯物质。 “标准态”中对温度并未作出规定。有些同学看到一般的热力学数据多为298K下的数值, 就误认为标准态的另一个条件是"298 K”,这是不正确的。所谓“标准状况”,是指气体 在压力为1个标准大气压(即101.325kPa)、温度为0℃时所处的状况。它对压力(101.325

kPa)和温度(0℃)都作了规定。大家熟知的标准状况下气体的摩尔体积即指1mol理想气 体在101.325kPa和0℃时的体积为22.4L. 同学们要注意标准状态和标准状况是两个念 关于标准状态下和非标准状态下吉布斯函数的确定:化学反应的△Gm°(T)和△Gm(T) 是不相同的,不同的条件下,用△Gm°和△Gm(T)判断化学反应进行的方向。△Gm(T) 指任意状本时,化学反应的意尔吉布斯预数变(也称自由能变)。而△Gm°(T)指化学反 应处于标准状态(即反应系统中各物厅 均处于标准状态)时的摩尔吉布斯函数变。 学们要注意△Gm()和AGm(T)是不相同的 关于溶液的饱和蒸汽压:所谓溶液的蒸气压是指在一定温度下,液体的蒸发与凝聚达平衡 时气体所具有的压力,称该溶液的饱和燕气压。对纯液体来说,在一定温度下,其饱和燕 气压为 常数。难挥发的非电解质稀溶液其蒸气压与该溶液的浓度有关,符合拉乌尔定律 (即存在蒸气压下 其原因主要 有两点 是由于溶质分子与溶剂分子结合 形 溶剂化分子从而减少了一些高能量(即能脱高液体进入气体)的溶剂分子:二是由溶质婴 占据溶剂的部分表面,使得单位表面、单位时间内逸出的溶剂分子相应减少,这样使得溶 质溶于溶剂后所形成的溶液的蒸气压要比纯溶剂低一些。 同学们要注意蒸汽压的影响因素 关于如何配制缓冲溶液:在缓冲溶液中,根据所需的H范围选取缓冲对。所需的H范围 酸(或碱)的强度即K以及酸与盐的浓度之比有关。以酸为例当所选酸(或碱)与其盐的 浓度之比为1山时,pH=pKa°;很显然可根据弱酸(或弱碱)的解离平衡常数与H的关系来 选取缓冲对。当然调节弱酸(或弱碱)与其盐浓度之比也可调整其出值。但调整的幅度有 限,且这种调节会直接影响缓冲 容流的经冲能力」 在配制抗酸性(或抗碱性)更强的缓冲 溶液时,根据缓冲原理,可适当政变弱碱(或弱聪 与其盐的浓度之 比来达到此目的 同学们要注意缓冲液在pH=pKa°时,缓冲效果最好 关于水的凝固点和三相点的区别:水的三相点和水的冰点是不相同的。在这一类问题中应 明确纯水的凝固点和水的三相点属同 一个问题,而不同于水的冰点。前者是指纯水在平衡 水蒸气压下的疑固点, 气液固三相都是纯净的水 经测定这 098C,4.579 mmHg (粗略值常取为0.01,1℃,4.6mmg)。而水的冰点是指在一个大气压下,被空气饱和的 水的凝固点。即由空气饱和了的水溶液和冰的平衡温度。液相是含有少量氨气,氧气,氢 气等气体的水溶液,固相是纯冰。水的冰点是一个比较复杂的系统,随外界条件的不同略 有差异。而水的三相点是指一个纯净简单的系统,是一个固定不变的状态。 同学们要注意水的三相点和水的冰点是不相同的 关于凝固点下降问题的应用:把一块C的冰放在C的水中和把它放在°C的盐水中现象是 不相同的。0C的冰与0C的水的蒸气压相同,两相可达到平衡状态,即冰水共存。但0°C的 盐水(无论何种盐,浓度如何)的蒸气压比0°C的冰的蒸气压要小。因此冰会溶化于0°C的 盐水中 同学们要注意利用此原理可以制造低温系统 关于不同定义的浓度:物质量的浓度与质量摩尔浓度在定义上是不同的,物质量的浓度是 指在1L溶液中所溶质的物质的量,单位是mo/L;质量摩尔浓度是指在1kg溶剂中所含溶质
kPa)和温度(0℃)都作了规定。大家熟知的标准状况下气体的摩尔体积即指1 mol理想气 体在101.325 kPa和0℃时的体积为22.4 L。 同学们要注意标准状态和标准状况是两个概念 关于标准状态下和非标准状态下吉布斯函数的确定:化学反应的ΔGmº(T)和ΔGm(T) 是不相同的,不同的条件下,用ΔGmº和ΔGm(T)判断化学反应进行的方向。ΔGm(T) 指任意状态时,化学反应的摩尔吉布斯函数变(也称自由能变)。而ΔGmº(T)指化学反 应处于标准状态(即反应系统中各物质均处于标准状态)时的摩尔吉布斯函数变。 同学们要注意ΔGmº(T)和ΔGm(T)是不相同的 关于溶液的饱和蒸汽压:所谓溶液的蒸气压是指在一定温度下,液体的蒸发与凝聚达平衡 时气体所具有的压力,称该溶液的饱和蒸气压。对纯液体来说,在一定温度下.其饱和蒸 气压为一常数。难挥发的非电解质稀溶液其蒸气压与该溶液的浓度有关,符合拉乌尔定律 (即存在蒸气压下降)。其原因主要有两点:一是由于溶质分子与溶剂分子结合.形成了 溶剂化分子从而减少了一些高能量(即能脱离液体进入气体)的溶剂分子;二是由溶质要 占据溶剂的部分表面,使得单位表面、单位时间内逸出的溶剂分子相应减少,这样使得溶 质溶于溶剂后所形成的溶液的蒸气压要比纯溶剂低一些。 同学们要注意蒸汽压的影响因素 关于如何配制缓冲溶液:在缓冲溶液中,根据所需的pH范围选取缓冲对。所需的pH范围与 酸(或碱)的强度pKaº以及酸与盐的浓度之比有关。以酸为例当所选酸(或碱)与其盐的 浓度之比为1l时,pH=pKaº;很显然可根据弱酸(或弱碱)的解离平衡常数与pH的关系来 选取缓冲对。当然调节弱酸(或弱碱)与其盐浓度之比也可调整其pH值。但调整的幅度有 限,且这种调节会直接影响缓冲溶液的缓冲能力。在配制抗酸性(或抗碱性)更强的缓冲 溶液时,根据缓冲原理,可适当改变弱碱(或弱酸)与其盐的浓度之比来达到此目的。 同学们要注意缓冲液在pH=pKaº 时,缓冲效果最好 关于水的凝固点和三相点的区别:水的三相点和水的冰点是不相同的。在这一类问题中应 明确纯水的凝固点和水的三相点属同一个问题,而不同于水的冰点。前者是指纯水在平衡 水蒸气压下的疑固点,气液固三相都是纯净的水,经测定这个值为0.0098ºC,4.579 mmHg (粗略值常取为0.01,l ºC,4.6 mmHg)。而水的冰点是指在一个大气压下,被空气饱和的 水的凝固点。即由空气饱和了的水溶液和冰的平衡温度。液相是含有少量氮气,氧气,氩 气等气体的水溶液,固相是纯冰。水的冰点是一个比较复杂的系统,随外界条件的不同略 有差异。而水的三相点是指一个纯净简单的系统,是一个固定不变的状态。 同学们要注意水的三相点和水的冰点是不相同的 关于凝固点下降问题的应用:把一块0ºC的冰放在0ºC的水中和把它放在0ºC的盐水中现象是 不相同的。0ºC的冰与0ºC的水的蒸气压相同,两相可达到平衡状态,即冰水共存。但0ºC的 盐水(无论何种盐,浓度如何)的蒸气压比0ºC的冰的蒸气压要小.因此冰会溶化于0ºC的 盐水中。 同学们要注意利用此原理可以制造低温系统 关于不同定义的浓度:物质量的浓度与质量摩尔浓度在定义上是不同的,物质量的浓度是 指在l L溶液中所溶质的物质的量,单位是mol/L;质量摩尔浓度是指在l kg溶剂中所含溶质

的物质的量,单位是mokg, 同学们要注意不同的扬合引用不同的单位的浓度 关于电化学中的电极电势:电对的电极电势的大小分别说明了很多问题。金属在其盐溶液 中。由于金属中的离子会向溶液中扩散。而溶液中的金属离子也要在金属表面沉积。在特 定的条件下对于特定的金属.这种扩散和沉积总会达到某种平衡(当然金属不同,溶液的 浓度不同,这种平衡的状态也不同)。若金属中的离子更容易进入溶液,必造成金屑表面 留下利余的电子 由 于静电吸引力 这些带有负电白 电子会把 吸到 属表面的附近,形成了双电层。双电层间有电势差,这个电势差就称为电极电势。很显 电极电势的大小,取决于金属中的高子(或电子)向溶液中扩散的趋势。但单个电极的电 极电势的大小现在尚无法确定。在标准电极电势表中的各电对的电极电势,都是该电对相 对于标准氢电极之差,从而人为地把标准氢电极的电极电势确定为零。电对的电极电势越 ,说明该电对中的氧化态物质的氧化夺电子能力器 应还原态物质的还原 (失由 子)能力越弱:反之,电对的电极电势越小,说明该电对中的还原态物质的还原(失电子 能力越强,因而它的氧化态物质的氧化能力必定越调。 同学们要注意电化学中的电极电势的来源 关于原电池的电动势:电动势是指组成原电池的两个电对的电极电势之差。电动势与电极 的关系是, 它等于正极的 极电势减去负极的电极电势, 同学们要学会计算电动势 关于电极电势的应用:为什么说二价铜离子可以氧化金属铁。而三价铁离子又可以氧化金 属铜,这两者之间有无矛盾?电极电势的高低可以很好的解决这个问题,两者之间并无矛 盾。根据电极电势的原理, 标准电极电势: Fe小于Cu*C 所以二价铜高子可以氧化金属铁。而三价铁离子又可以氧化金属铜,但此时要注意的是, 三价铁的还原产物是二价铁离子,而不是铁。 同学们要注意应用电极电势判断反应的自发性 关于化学腐蚀的应用:为什么纱窗在铁丝相交处生锈最为严重?纱窗在铁丝交又处,由于 其重叠压迫,造成此点与大气接触受阻。而不交又处却与大气正常接触。金属在大气中花 腐蚀时,阴极发生的是吸氧反应。很明显,相交处由于氧气分压低,其电势值就小,而不 相交处由于氧气分压高,其电势值就大。这样两点间必有电势差,电子将自动地从电势低 处流向电势高处。所以相交点处的金属失去电子(被腐蚀),电子流向不相交点的阴极发 生吸氧反应。因此在这个腐蚀屯池中不相交点发生吸氧反应(阴极),而相交点发生金属 的腐蚀反应(阳极) 同学们要注意腐蚀发生的条件 关于电解过程:由于在阳极发生的是氧化(失电子)反应,而电极电势较低的还原态物质 更容易失电子,因此在阳策是电极电势较低的还原态物质先放电:同理在阴极发生的是还 原(得电子)反应,而电极电势较高的氧化态物质更容易夺取电子。 因此在阴极是电极 势较高的氧化态物质先放电。在比较大小时,应以实际析出电势比较(即考虑超电势的 响)。 同学们要注意电解过程还要考虑超电势的影响
的物质的量.单位是mol/kg。 同学们要注意不同的场合引用不同的单位的浓度 关于电化学中的电极电势:电对的电极电势的大小分别说明了很多问题。金属在其盐溶液 中.由于金属中的离子会向溶液中扩散.而溶液中的金属离子也要在金属表面沉积.在特 定的条件下对于特定的金属.这种扩散和沉积总会达到某种平衡(当然金属不同,溶液的 浓度不同,这种平衡的状态也不同)。若金属中的离子更容易进入溶液,必造成金屑表面 留下剩余的电子。而由于静电吸引力,这些带有负电的电子会把溶液中的正高子吸引到金 属表面的附近,形成了双电层.双电层间有电势差,这个电势差就称为电极电势。很显然 电极电势的大小,取决于金属中的离子(或电子)向溶液中扩散的趋势。但单个电极的电 极电势的大小现在尚无法确定。在标准电极电势表中的各电对的电极电势,都是该电对相 对于标准氢电极之差,从而人为地把标准氢电极的电极电势确定为零。电对的电极电势越 大,说明该电对中的氧化态物质的氧化(夺电子)能力越强;相应地还原态物质的还原(失电 子)能力越弱;反之,电对的电极电势越小,说明该电对中的还原态物质的还原(失电子) 能力越强,因而它的氧化态物质的氧化能力必定越弱。 同学们要注意电化学中的电极电势的来源 关于原电池的电动势:电动势是指组成原电池的两个电对的电极电势之差。电动势与电极 电势的关系是,它等于正极的电极电势减去负极的电极电势。 同学们要学会计算电动势 关于电极电势的应用:为什么说二价铜离子可以氧化金属铁。而三价铁离子又可以氧化金 属铜,这两者之间有无矛盾? 电极电势的高低可以很好的解决这个问题,两者之间并无矛 盾。根据电极电势的原理,标准电极电势:Fe3+/Fe2+大于Cu2+ /Cu,Fe2+ /Fe小于 Cu2+/Cu, 所以二价铜离子可以氧化金属铁。而三价铁离子又可以氧化金属铜,但此时要注意的是, 三价铁的还原产物是二价铁离子,而不是铁。 同学们要注意应用电极电势判断反应的自发性 关于化学腐蚀 的应用:为什么纱窗在铁丝相交处生锈最为严重?纱窗在铁丝交叉处,由于 其重叠压迫,造成此点与大气接触受阻.而不交又处却与大气正常接触。金属在大气中被 腐蚀时,阴极发生的是吸氧反应。很明显,相交处由于氧气分压低,其电势值就小,而不 相交处由于氧气分压高,其电势值就大。这样两点间必有电势差,电子将自动地从电势低 处流向电势高处。所以相交点处的金属失去电子(被腐蚀),电子流向不相交点的阴极发 生吸氧反应。因此在这个腐蚀屯池中不相交点发生吸氧反应(阴极),而相交点发生金属 的腐蚀反应(阳极)。 同学们要注意腐蚀发生的条件 关于电解过程:由于在阳极发生的是氧化(失电子)反应,而电极电势较低的还原态物质 更容易失电子.因此在阳缀是电极电势较低的还原态物质先放电;同理在阴极发生的是还 原(得电子)反应,而电极电势较高的氧化态物质更容易夺取电子。因此在阴极是电极电 势较高的氧化态物质先放电。在比较大小时,应以实际析出电势比较(即考虑超电势的影 响)。 同学们要注意电解过程还要考虑超电势的影响
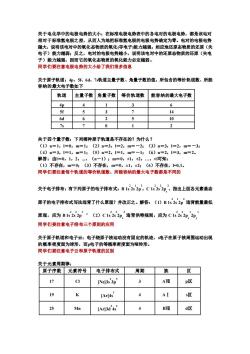
关于电化学中的电极电势的大小:在标准电极电势表中的各电对的电极电势,都是该电对 相对于标准氢电极之差,从而人为地把标准氢电极的电极电势确定为零。电对的电极电势 说明该电对中的氧化态物质的氧化(夺电子能力越强! 还原(失 )能力越弱:反之,电对的电极电劳鹅小,说明该电对中的还原套物质的还 态物质的 子)能力越强,因而它的氧化态物质的氧化能力必定越弱。 同学们要注意电极电势的大小给了我们很多信息 关于原子轨道: p 56d、7轨道主量子数、角量子数的值,所包含的等价轨道数、所能 容纳的最大电子数如下 轨道 主量子数角量子数等价轨道数 能容纳的最大电子数 4p 4 3 6 5f 5 3 14 6d 10 7s 0 1 2 关于四个量子数:下列哪种原子轨道是不存在的?为什么? ()=1,=0,m-1 n=3,1=2,m=-24 (3)n=3,1=2,m=-3 (4)n=3,1=1,m=1:(5)n=2,1=1,m=-1:(6)n=2,1=3,m=2。 解答:1=0,1,2,,(n一1);m=0,h,2,,可知: (1)不存在,m=0:(3)不存在,m=0,±1,±2;(6)不存在,0,1。 同学们要注意每个轨道的等价轨道数、所能容纳的最大电子数都是不同的 关于电子排布:有下列原子的电子排布式:B1s2s2p,C1s2s2p’,指出上面各元素基态 原子的电子排布式写法违背了什么原理?并改正之。解答:(1)B15252印违背能量最低 原理,应为B1s2s2p ,(2)C122违背洪特规则,应为C1522印,2, 同学们要注意电子排布三个原则的应用 关于原子轨道和电子云:电子绕原子核运动没有固定的轨迹,s电子在原子核周围运动出现 的橛率密度面为球形,而电子的等概率密度面为哑铃形。 同学们要注意电子云和原子轨道的区别 关于元素周期律: 原子序数元素符号电子排布式 周期 族区 17 9 [Ne]3s 3p AVI p区 19 [Ar]4s AI 冷 25 Mn LArB3d'4s 4 d区
关于电化学中的电极电势的大小:在标准电极电势表中的各电对的电极电势,都是该电对 相对于标准氢电极之差,从而人为地把标准氢电极的电极电势确定为零。电对的电极电势 越大,说明该电对中的氧化态物质的氧化(夺电子)能力越强;相应地还原态物质的还原(失 电子)能力越弱;反之,电对的电极电势越小,说明该电对中的还原态物质的还原(失电 子)能力越强,因而它的氧化态物质的氧化能力必定越弱。 同学们要注意电极电势的大小给了我们很多信息 关于原子轨道:4p、5f、6d、7s轨道主量子数、角量子数的值,所包含的等价轨道数、所能 容纳的最大电子数如下 轨道 主量子数 角量子数 等价轨道数 能容纳的最大电子数 4p 4 1 3 6 5f 5 3 7 14 6d 6 2 5 10 7s 7 0 1 2 关于四个量子数:下列哪种原子轨道是不存在的?为什么? (1)n=1,l=0,m=1;(2)n=3,l=2,m=-2;(3)n=3,l=2,m=-3; (4)n=3,l=1,m=1;(5)n=2,l=1,m=-1;(6)n=2,l=3,m=2。 解答:由l=0,1,2,...,(n-1);m=0,±1,±2,…,±l可知: (1)不存在,m=0;(3)不存在,m=0,±1,±2;(6)不存在,l=0,1。 同学们要注意每个轨道的等价轨道数、所能容纳的最大电子数都是不同的 关于电子排布:有下列原子的电子排布式:B 1s 2 2s 1 2p 2 ,C 1s 2 2s 2 2p x 2 ,指出上面各元素基态 原子的电子排布式写法违背了什么原理?并改正之。解答:(1)B 1s 2 2s 1 2p 2 违背能量最低 原理,应为 B 1s 2 2s 2 2p 1 ,(2)C 1s 2 2s 2 2p x 2 违背洪特规则,应为 C 1s 2 2s 2 2p x 1 2p y 1 同学们要注意电子排布三个原则的应用 关于原子轨道和电子云:电子绕原子核运动没有固定的轨迹,s电子在原子核周围运动出现 的概率密度面为球形,而p电子的等概率密度面为哑铃形。 同学们要注意电子云和原子轨道的区别 关于元素周期律: 原子序数 元素符号 电子排布式 周期 族 区 17 Cl [Ne]3s 2 3p 5 3 AⅦ p区 19 K [Ar]4s 1 4 AⅠ s区 25 Mn [Ar]3d 5 4s 2 4 BⅦ d区

29 Cu IAr3d"4s' 4 ds区 24 Cr [Ar)3d'4s 4 BVI d区 关于原子的性质:由元素的第一电离能具有周期性的变化规律:同一周期中从左至右增大 同一主族自上而下减少。下列原子第一电离能的大小比较为: P>S;Mg>Al;Sr>Rb Zn>Cr:CsAt 同学们要注意电子排布三个原则的应用 关于化学成键:常见的共价键是健和健,健的原子轨道是沿健轴方向以“头碰头”的形式 重叠的。健的原 轨道是 向以 “肩并肩“的形式重叠的 说来健的轨道重叠 程度比健的重叠程度要小,因而能量要高,不如健稳定。共价健单健一般为如德,在共价 双健和三键中除了一个键外,其余的为1健。 同学们要注意σ键和.1健的区别 关于杂化方式:C0,:sp杂化,直线型,偶极矩为零: gC:sp杂化,直线型,偶极炬为零: BF,:sp杂化,平面三角形,偶极矩为零 C1:sp等性杂化,正四面体,偶极矩为零: CHC:sp不等性杂化,三角锥,偶极矩不为零; NH:sp不等性杂化,三角锥,偶极矩不为零: PH:sp不等性杂化,三角锥,偶极矩不为早: H,0:sp不等性杂化,V形,偶极矩不为零。 BF,中B原子sp'杂化,杂化轨道间的夹角为120°,呈平面三角形 而BF,中B原子为s即杂化,整个离子呈正四面体的构型。 同学们要注意杂化与分子结构的区别 关于分子结构:S0,和N0,两者都是极性的,而C0,是非极性的,说明分子结构不同,S0, 为sp杂化,其中2个轨道上为S0共用电子对,另1个轨道上为S提供的孤对电子,N0,为sp 杂化,其中2个轨道上为N0哄用电子对,另1个轨道上为提供的孤对电子,因此,整个分 子的偶极矩不为零,S0和N0,两者都是极性的。而C0,为sp杂化,两个轨道上都是C-0哄
29 Cu [Ar]3d 10 4s 1 4 BⅠ ds区 24 Cr [Ar}3d 5 4s 1 4 BⅥ d区 关于原子的性质:由元素的第一电离能具有周期性的变化规律:同一周期中从左至右增大; 同一主族自上而下减少。 下列原子第一电离能的大小比较为: P>S;Mg>Al;Sr>Rb; Zn>Cr;CsAt 同学们要注意电子排布三个原则的应用 关于化学成键:常见的共价键是σ键和л键,σ键的原子轨道是沿键轴方向以“头碰头”的形式 重叠的。л键的原子轨道是沿键轴方向以“肩并肩”的形式重叠的。一般说来л键的轨道重叠 程度比σ键的重叠程度要小,因而能量要高,不如σ键稳定。共价键单键一般为σ键,在共价 双键和三键中除了一个σ键外,其余的为л键。 同学们要注意σ键和л键的区别 关于杂化方式:CO 2 :sp杂化,直线型,偶极矩为零; HgCl 2:sp杂化,直线型,偶极矩为零; BF 3:sp 2 杂化,平面三角形,偶极矩为零 CH 4 :sp 3 等性杂化,正四面体,偶极矩为零; CHCl 3 :sp 3 不等性杂化,三角锥,偶极矩不为零; NH 3:sp 3 不等性杂化,三角锥,偶极矩不为零; PH 3:sp 3 不等性杂化,三角锥,偶极矩不为零; H 2 O:sp 3 不等性杂化,V形,偶极矩不为零。 BF 3中B原子sp 2 杂化,杂化轨道间的夹角为120°,呈平面三角形。 而[BF 4 ] - 中B原子为sp 3 杂化,整个离子呈正四面体的构型。 同学们要注意杂化与分子结构的区别 关于分子结构:SO 2和NO 2两者都是极性的,而CO 2是非极性的,说明分子结构不同,SO 2 为sp 2 杂化,其中2个轨道上为S-O共用电子对,另1个轨道上为S提供的孤对电子;NO 2 为sp 2 杂化,其中2个轨道上为N-O共用电子对,另1个轨道上为N提供的孤对电子;因此,整个分 子的偶极矩不为零,SO 2和NO 2两者都是极性的。 而CO 2为sp杂化,两个轨道上都是C-O共

用电子对,因此整个分子偶极矩为0。 同学们要注意杂化与分子结构的区别 关于共价键的基本特征:从价键理论的要点可知,自旋方向相反的电子配对以后就不再与 另一个原子中的未成对电子配对了,这就是共价键的饱和性。而根据轨道的最大重叠原理, 除了球形的s轨道之外,d、p轨道的最大值总是沿重叠最多的方向取向,因而决定了共价键 的方向性。 同学们一定要掌握共价键的基本特征 关于晶体的结构:食盐、金刚石、干冰(CO2)以及金属都是固态晶体,但它们的溶解性, 熔沸点、硬度和导电性等物理性质相差甚远,食盐属于离子晶体,离子晶体的晶格结点上 排布的是正、负离子,以离子键相结合,因此一般具有较高的熔点、沸点和硬度;金刚石 为共价晶体,晶格结点上排布的是原子,以共价键相结合,因此一般具有非常高的熔点和 硬度:干冰属于分子晶体,晶格结点上排布的是分子,以分子间力相结合,由于分子间力 较化学键的键能小,所以分子晶体一般具有较低的熔点、沸点和较小的硬度,这类固体一 般不导电。金属属于金属晶体,晶格结点上排布的是金属原子,以金属键相结合,由于有 很多自由电子,因此导电、导热性强,具有良好的延展性。 同学们要注意晶体的结构决定了晶体的性质 关于化学键的极性:下列物质中键的极性的相对大小排序是:NaF>HF>HC>HB>H>I 关于化学键的极性和分子极性之间的关系:双原子分子中键的极性与分子极性一致,多原 子分子整个分子的极性由键的极性和分子空间构型共同决定。前者如H,非极性,HC极性: 后者如C0,C一0键极性,分子非极性;S0,分子中S一O键极性,分子极性。 同学们要注意关于化学键的极性和分子的极性是不同的 关于结构和性质的关系:以石墨的结构为例,石墨晶体中,即有共价键,又有非定域大键, 还有分子间力,所以石墨晶体是一种混合键型的晶体。石墨晶体中碳原子是以一个2s轨道 和两个2p轨道进行sp2杂化,每个碳原子与其他三碳原子以o键相连,键角120°,形成无数 正六角形构成的网状平面层。所以石墨晶体具有层状结构。每个碳原子中还有一个未杂化 的2即轨道,这些2p轨道与六角网状平面垂直,并相互平行。这些相互平行的p轨道可形成1 键。由于这种键由很多原子形成,称为大键。大键中的电子与金属中的自由电子有些类 似。因此石墨具有良好的导电性。石墨晶体中层与层之间以分子间力联系,这种作用力较 弱,层与层之间容易滑动和断裂,因此石墨可用作润滑剂。在金刚石中,碳原子采用$3杂 化,碳原子间以极强的共价键联系,因此有极高的熔点与很大的硬度。 同学们要注意晶体的结构决定了晶体的性质
用电子对,因此整个分子偶极矩为0。 同学们要注意杂化与分子结构的区别 关于共价键的基本特征:从价键理论的要点可知,自旋方向相反的电子配对以后就不再与 另一个原子中的未成对电子配对了,这就是共价键的饱和性。而根据轨道的最大重叠原理, 除了球形的s轨道之外,d、p轨道的最大值总是沿重叠最多的方向取向,因而决定了共价键 的方向性。 同学们一定要掌握共价键的基本特征 关于晶体的结构:食盐、金刚石、干冰(CO2)以及金属都是固态晶体,但它们的溶解性, 熔沸点、硬度和导电性等物理性质相差甚远,食盐属于离子晶体,离子晶体的晶格结点上 排布的是正、负离子,以离子键相结合,因此一般具有较高的熔点、沸点和硬度;金刚石 为共价晶体,晶格结点上排布的是原子,以共价键相结合,因此一般具有非常高的熔点和 硬度;干冰属于分子晶体,晶格结点上排布的是分子,以分子间力相结合,由于分子间力 较化学键的键能小,所以分子晶体一般具有较低的熔点、沸点和较小的硬度,这类固体一 般不导电。金属属于金属晶体,晶格结点上排布的是金属原子,以金属键相结合,由于有 很多自由电子,因此导电、导热性强,具有良好的延展性。 同学们要注意晶体的结构决定了晶体的性质 关于化学键的极性:下列物质中键的极性的相对大小排序是:NaF>HF>HCl>HBr>HI>I 2 关于化学键的极性和分子极性之间的关系:双原子分子中键的极性与分子极性一致,多原 子分子整个分子的极性由键的极性和分子空间构型共同决定。前者如H 2,非极性,HCl极性; 后者如CO 2 ,C-O键极性,分子非极性;SO 2 分子中S—O键极性,分子极性。 同学们要注意关于化学键的极性和分子的极性是不同的 关于结构和性质的关系:以石墨的结构为例,石墨晶体中,即有共价键,又有非定域大л键, 还有分子间力,所以石墨晶体是一种混合键型的晶体。石墨晶体中碳原子是以一个2s轨道 和两个2p轨道进行sp2杂化,每个碳原子与其他三碳原子以σ键相连,键角120°,形成无数 正六角形构成的网状平面层。所以石墨晶体具有层状结构。每个碳原子中还有一个未杂化 的2p轨道,这些2p轨道与六角网状平面垂直,并相互平行。这些相互平行的p轨道可形成л 键。由于这种键由很多原子形成,称为大л键。大л键中的电子与金属中的自由电子有些类 似。因此石墨具有良好的导电性。石墨晶体中层与层之间以分子间力联系,这种作用力较 弱,层与层之间容易滑动和断裂,因此石墨可用作润滑剂。在金刚石中,碳原子采用sp3杂 化,碳原子间以极强的共价键联系,因此有极高的熔点与很大的硬度。 同学们要注意晶体的结构决定了晶体的性质
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学自测试卷及参考答案(二).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学自测试卷及参考答案(一).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第6章 化学与能源、第7章 化学与环境、第8章 化学与工程材料.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第5章 物质结构基础(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第4章 电化学(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第3章 溶液与离子平衡(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第2章 化学动力学基础(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第1章 热力学(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)附录.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第三部分 开放、综合及设计实验.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第二部分 基本实验(共十个实验).doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第一部分 实验基本操作及数据处理.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)绪论(负责人:董文魁).doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第8章 化学与工程材料.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第7章 化学与环境.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第6章 化学与能源.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第5章 物质结构基础.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第4章 电化学.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第3章 溶液与离子平衡.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第2章 化学动力学基础.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷E.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷F.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷G.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷H.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革的探索与实践.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验的任务及其措施的探讨.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学课程建设的主要措施及成效.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学考核体系的建立及效果.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验课程的相关探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学多媒体教学课件相关研究.doc
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第一章 化学热力学基础(第二定律).ppt
