兰州交通大学:《工程化学》课程教学资源(授课教案)第5章 物质结构基础

工程化学教案 第五章 工程化学教案—第五章物质结构基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生
工程化学教案 第 五章 • • 1 工程化学教案——第五章 物质结构基础 主讲教师:董文魁、许力、李静萍等 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生

工程化学教案 第五章 第五章物质结构基础(讲授时数:8学时) 一,学习目的和要求 1.掌握原子核外电子分布的一般规律(描述核外电子运动状态的四个量子数的物理意 义和可能取值,核外电子排布原理,电子排布式和轨道表示式)及其与元素周期表 的关系: 2.了解原子核外电子运动的基本特征,5,P,d轨道波函数与电子云的空间分布情况: 3.了解化学健的本质及共价健健长、健角等概念: 4,熟悉杂化轨道理论,能用该理论判定某些分子的空间构型: 5。了解分子间力和晶体结构及对物理性质的影响: 6。了解原子光谱和分子振动光谱的基本原理及应用情况 二。本章节重点、难点 核外电子分布的一般规律:杂化轨道理论:分子间力和晶体结构及对物理性质的影响 三.学时分配 原子结构理论的近代概念 (2学时) 多电子原子的电子分布和周期系 (2学时) 化学键与分子间作用力 (2学时) 分子间的作用力和氢键 (1学时) 晶体结构 (1学时) 四。教学内容: 第一节原子结构的近代概念 物质发生化学反应主要是核外电子的排布等诸方面的改变,其原子核却无变化。 一、微观粒子的波粒二象性 我们已知,光不仅有微粒的性质,而且有波动性即光具有波粒二象性。 原子中的电子是一种有确定体积(d1015m)和质量(9c011×1031kg)的粒子。这一 点无须证明。电子运动是否也象光子一样,表现出波动的性质呢? 1927年美国物理学家戴维逊通过电子衍射实验证实了电子运动时确实具有波动性。 后来人们相继发现质子、中子等微观粒子均能产生衍射现象,同样具有波动性。 所以,微观粒子如电子、质子、中子等都具有波粒二象性,它们波动性与微粒性通过 如下式子联系起来: 动量p=mv=hM,能量E=N m、v是微粒的质量与速度,属于微粒性质。h是普朗克常量,数值为6.626XI01s
工程化学教案 第 五章 2 第五章 物质结构基础(讲授时数: 8 学时) 一. 学习目的和要求 1. 掌握原子核外电子分布的一般规律(描述核外电子运动状态的四个量子数的物理意 义和可能取值,核外电子排布原理,电子排布式和轨道表示式)及其与元素周期表 的关系; 2. 了解原子核外电子运动的基本特征,s,p,d 轨道波函数与电子云的空间分布情况; 3. 了解化学键的本质及共价键键长、键角等概念; 4. 熟悉杂化轨道理论,能用该理论判定某些分子的空间构型; 5. 了解分子间力和晶体结构及对物理性质的影响; 6. 了解原子光谱和分子振动光谱的基本原理及应用情况. 二. 本章节重点、难点 核外电子分布的一般规律; 杂化轨道理论; 分子间力和晶体结构及对物理性质的影响 三. 学时分配 原子结构理论的近代概念 (2 学时) 多电子原子的电子分布和周期系 (2 学时) 化学键与分子间作用力 (2 学时) 分子间的作用力和氢键 (1 学时) 晶体结构 (1 学时) 四. 教学内容: 第一节 原子结构的近代概念 物质发生化学反应主要是核外电子的排布等诸方面的改变,其原子核却无变化。 一、微观粒子的波粒二象性 我们已知,光不仅有微粒的性质,而且有波动性即光具有波粒二象性。 原子中的电子是一种有确定体积(d=10-15m)和质量(9 ִ 011×10-31 ̣kg)的粒子。这一 点无须证明。电子运动是否也象光子一样,表现出波动的性质呢? 1927 年美国物理学家戴维逊通过电子衍射实验证实了电子运动时确实具有波动性。 后来人们相继发现质子、中子等微观粒子均能产生衍射现象,同样具有波动性。 所以,微观粒子如电子、质子、中子等都具有波粒二象性,它们波动性与微粒性通过 如下式子联系起来: 动量 p = mv = h/λ ,能量 E = hv m、v 是微粒的质量与速度,属于微粒性质。h 是普朗克常量,数值为 6.626╳10-34 J.S

工程化学教案 第五章 、v是波长与频率,属于波的性质 二、几率、几率密度与电子云 原子中的 高速运动 它的运动无确定的轨道,但原子中的电子在核外出现的机全 在原子核外的分布还是有规律的。核外空间某些区域电子出现的几率较大,而一些区域则出 现的几率较小。 电子在原子核外空间某处单位体积内出现的几率称为几率密度。 电子云则是用密度不同的小黑点来表示电子在空间单位体积内出现的机会即几率密度 的相对大小,黑点较密处,表示电子出现的几率密度较大,黑点较稀处,表示电子出现的几 率密度较小 三、核外电子运动状态的描述-一薛定谔方程一波函数中一三个量子数 炮弹在空中飞行的运动状态,可以用弹道方程来描述,弹道方程的每一组合理解 亦即弹道函数的每一个值,就表示炮弹运动的一种状态,与此类似,电子的运动也用相应的 方程…亦即薛定谔方程(见书P204)米描述,它是描述核外电子运动状态的基本方程, 空间坐 生微 方程和关于时间的一阶 微分方程 5程的 组合 解办 即波函数中及其对应的能量E就表示了原子中电子的一种可能运动状态,是粒子坐标(空 间位置)的函数,波函数进一步求解的结果是三个量子数,再加上电子自旋量子数总共四个 量子数一起决定电子的运动状态。 核外电子运动状态的描述-薛定谔方程.-波函数中-三个量子数(n,1,m,n为主 量子数,L为角量子数,m为磁量子数) 。决定原子轨道 (m/ →决定电子运动状态 ms 波函数俗称原子轨道 描述核外电子运动状态的四个量子数 1、主量子数(n) 代表电子层,主量子数为n,表示第n层电子层。是电子能量的 主要决定因素。n可取正整数即n=1、2、3n。 K M N n 第一层 第二层 第三层第四层 值越大,电子层越远离原子核,其能级越高。 2、角量子数(L)代表电子亚层,是电子能量的次要决定因素,决定原子轨道的形状。 1取0、1、2、3…(n-1) d f 0 一电子层中L值越小,该电子亚层的能级越低。 3、磁量子数(m)代表原子轨道在空间的取向。 每一个m值代表一个具有一定空间取向的原子轨道,m的总取值数即、L相同的原 子轨道(叫简并轨道)的数目。 0、±1 2 4、自旋量子数(m)代表电子的自旋,只有两个取值,士1/2。 例写出第M层电子的各量子数的取值及相应原子轨道符号 解答如下:
工程化学教案 第 五章 3 λ、v 是波长与频率,属于波的性质。 二、几率、几率密度与电子云. 原子中的电子高速运动,它的运动无确定的轨道,但原子中的电子在核外出现的机会 在原子核外的分布还是有规律的。核外空间某些区域电子出现的几率较大,而一些区域则出 现的几率较小。 电子在原子核外空间某处单位体积内出现的几率称为几率密度。 电子云则是用密度不同的小黑点来表示电子在空间单位体积内出现的机会即几率密度 的相对大小,黑点较密处,表示电子出现的几率密度较大,黑点较稀处,表示电子出现的几 率密度较小。 三、核外电子运动状态的描述-----薛定谔方程---波函数ψ---三个量子数 炮弹在空中飞行的运动状态,可以用弹道方程来描述,弹道方程的每一组合理解 亦即弹道函数的每一个值,就表示炮弹运动的一种状态,与此类似,电子的运动也用相应的 方程---亦即薛定谔方程(见书 P204)来描述,它是描述核外电子运动状态的基本方程,是 一个关于空间坐标的二阶线性微分方程和关于时间的一阶微分方程,方程的每一组合理解亦 即波函数ψ及其对应的能量 E 就表示了原子中电子的一种可能运动状态,是粒子坐标(空 间位置)的函数,波函数进一步求解的结果是三个量子数,再加上电子自旋量子数总共四个 量子数一起决定电子的运动状态。 核外电子运动状态的描述----薛定谔方程----波函数ψ----三个量子数(n,l,m,n 为主 量子数,ɭ为角量子数,m 为磁量子数)。 n l m ms 决定电子运动状态 决定原子轨道 波函数俗称原子轨道 ⚫ 描述核外电子运动状态的四个量子数 1、主量子数(n) 代表电子层,主量子数为 n,表示第 n 层电子层。是电子能量的 主要决定因素。n 可取正整数即 n = 1、2、3……n。 K L M N …… n 1 2 3 4 第一层 第二层 第三层 第四层 n 值越大,电子层越远离原子核,其能级越高。 2、 角量子数(ɭ) 代表电子亚层,是电子能量的次要决定因素,决定原子轨道的形状。 ɭ取 0、1、2、3……(n-1) s p d f ɭ 0 1 2 3 同一电子层中 ɭ 值越小,该电子亚层的能级越低。 3、 磁量子数(m) 代表原子轨道在空间的取向。 每一个 m 值代表一个具有一定空间取向的原子轨道,m 的总取值数即 n、ɭ 相同的原 子轨道(叫简并轨道)的数目。 m = 0、±1、±2、……±ɭ 4、 自旋量子数(ms) 代表电子的自旋,只有两个取值,±1/2。 例 写出第 M 层电子的各量子数的取值及相应原子轨道符号 解答如下:
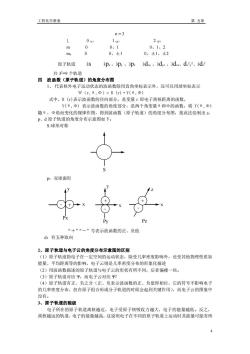
工程化学教案 第五章 n=3 1 2 d) m 、 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3S 3p,3p,3p 3dy,3d.,3d、d3,2、3d 共3=9个轨道 四波函数(原子轨道)的角度分布图 1、代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(m,8,Φ)=R(r)·Y(8,Φ) 式中,R()表示波函数的径向部分,是变量r即电子离核距离的函数, Y(0,中)表示波函数的角度部分,是两个角变量0和中的函数,将Y(0,中) 随、Φ角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出5 P、d原子轨道的角度分布示意图如下 S:球形对称 p:双球面形 ”“一”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 1)原 子轨道指电子在 一定空间的运动状态 除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应甲,而电子云对应2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所 4
工程化学教案 第 五章 4 n = 3 ɭ 0(s) 1(p) 2(d) m 0 0、1 0、1、2 ms 0 0、±1 0、±1、±2 原子轨道 3s 3px ,3py ,3pz 3dxy ,3dyz ,3dxz、dx 2 y 2、3dz 2 共 3 2=9 个轨道 四 波函数(原子轨道)的角度分布图 1、 代表核外电子运动状态的波函数除用直角坐标表示外,还可以用球坐标表示 Ψ(r,θ,Ф)= R (r)·Y(θ,Ф) 式中,R (r)表示波函数的径向部分,是变量 r 即电子离核距离的函数, Y(θ,Ф) 表示波函数的角度部分,是两个角变量θ和Ф的函数,将 Y(θ,Ф) 随θ、Ф角而变化的规律作图,得到波函数(原子轨道)的角度分布图,按此法绘制出 s、 p、d 原子轨道的角度分布示意图如下: S:球形对称 S p:双球面形 - + + - + - + - Px Py Pz x y z x y x “+”“-”号表示波函数的正、负值 d:有五种取向 2、原子轨道与电子云的角度分布示意图的区别 (1)原子轨道指电子在一定空间的运动状态,除受几率密度影响外,还受其他物理性质如 能量、平均距离等的影响,电子云则是几率密度分布的形象化描述 (2)用波函数描述的原子轨道与电子云的形状有所不同,后者偏瘦一些。 (3)原子轨道对应 Ψ,而电子云对应 Ψ2 (4)原子轨道有正、负之分(正、负表示波函数的正、负值即相位,它的符号不影响电子 的几率密度分布,但在原子组合形成分子轨道的时候会起到关键作用),而电子云的图象中 没有。 3、原子轨道的能级 电子所在的原子轨道离核越近,电子受原子核吸收力越大,电子的能量越低。反之, 离核越远的轨道,电子的能量越高,这说明电子在不同的原子轨道上运动时其能量可能有所

工程化学教案 第五章 不同。原子中电子所处的不同能量状态称原子轨道的能级。 根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q 电子层又可以划分为若干个电子亚层,如s、p、d、f等。每个电子亚层包含若干个原 子轨 原子轨道的能级可以通过光谱实验确定,也可以应用薛定谔方程求得。原子轨道的能 级与其所在电子的电子层及电子亚层有关,还与原子序数有关。 ELE.EECE<ELCEM<ELEsCEECEACEs 规则E:np B、同一电子层不同亚层:ns<np<nd<nf. C、同一亚层内各原子轨道能级相同,称为简并轨道。 D、原子轨道能级随原子序数增大而降低。 结果使其所在的 了某些轨道能级出现交错现象。 第二节多电子原子结构和元素周期律 排布原理 1、泡利原理每一个原子轨道中,最多只能容纳2个自旋相反的电子。 如:B(5) 电子排布式:1s22s22p 泡利原理的重要意义在于,它解决了每一个原子轨道以及各电子层中可容纳的电子数 问题 2、能量最低原理 多申子原子处干基态时,在不违反泡利原理的前提下,核外申子一般是分布在能量较低 的轨道上,以使原子处于能量最低的稳定状态。它解决了或1值不同的轨道中,电子在 各轨道中填充的先后顺序问题。 3、洪特规则 ●基态原子中,同一电子亚层上,电子尽可能单独分布在不同的轨道上,且自旋方向相同 ● 等价轨道在全充满、半充满或全空状态更稳定 它解决了、1值相同的轨道(简并轨道)中电子的分布规律 二、 基态原子核外电子的排布 1、电子排布式 多电子原子核外电子分布的表达式叫做电子排布式(电子分布式)也即电子组态:用符 号(如1s、2印)表示出所有被占轨道,将每个轨道中填充的电子数标注在该轨道符号的右 上角 如: 152s2 2p 3s Ne1o 1s 2s2 2p5 厂最外层最多填充8个 (1)规律 次外层最多填充18个 若只有一层,最多填充2个电子。 一倒数第三层最多为32 (2)价层电子构型即外围电子构型是指价层(指价电子所在的电子亚层)的电子排布式 注意,价层中的电子非一定全是价电子。如:Ag,价层电子标型为4d5s,Ag只有 +1、+2、+3。可见,4d亚层中的10e并非全是价电子。 2、轨道表示式 5
工程化学教案 第 五章 5 不同。原子中电子所处的不同能量状态称原子轨道的能级。 根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q…. 同一电子层又可以划分为若干个电子亚层,如 s、p、d、f 等。每个电子亚层包含若干个原 子轨道。 原子轨道的能级可以通过光谱实验确定,也可以应用薛定谔方程求得。原子轨道的能 级与其所在电子的电子层及电子亚层有关, 还与原子序数有关。 E1s<E2s<E2p<E3s<E3p<E4s<E4d<E4p<E5s<E5p<E6s<E4f<E5d 规则 E:np>(n-1)d>(n-2)f>ns A、不同电子层能级相对高低 K<L<M<N… B、同一电子层不同亚层:ns<np<nd<nf… C、同一亚层内各原子轨道能级相同,称为简并轨道。 D、原子轨道能级随原子序数增大而降低。 其原因在于原子序数增大亦即核电荷数增大,核对电子的吸引力增强,电子向核靠近的 结果使其所在轨道能级降低。另一方面,由于各原子轨道能级下降的幅度不完全相同,造成 了某些轨道能级出现交错现象。 第二节 多电子原子结构和元素周期律 一、 排布原理 1、泡利原理 每一个原子轨道中,最多只能容纳 2 个自旋相反的电子。 如:B(5), 电子排布式:1s2 2s2 2p1 泡利原理的重要意义在于,它解决了每一个原子轨道以及各电子层中可容纳的电子数 问题 2、能量最低原理 多电子原子处于基态时,在不违反泡利原理的前提下,核外电子一般是分布在能量较低 的轨道上,以使原子处于能量最低的稳定状态。它解决了 n 或 l 值不同的轨道中,电子在 各轨道中填充的先后顺序问题。 3、洪特规则 ⚫ 基态原子中,同一电子亚层上,电子尽可能单独分布在不同的轨道上,且自旋方向相同 ⚫ 等价轨道在全充满、半充满或全空状态更稳定。 它解决了 n、l 值相同的轨道(简并轨道)中电子的分布规律。 二、 基态原子核外电子的排布 1、 电子排布式 多电子原子核外电子分布的表达式叫做电子排布式(电子分布式)也即电子组态:用符 号(如 1s、2p)表示出所有被占轨道,将每个轨道中填充的电子数标注在该轨道符号的右 上角。 如: Na11 1s2 2s2 2p6 3s1 Ne10 1s2 2s2 2p6 最外层最多填充 8 个 (1)规律 次外层最多填充 18 个 若只有一层,最多填充 2 个电子。 倒数第三层最多为 32 (2)价层电子构型即外围电子构型是指价层(指价电子所在的电子亚层)的电子排布式。 注意,价层中的电子非一定全是价电子。如:Ag,价层电子标型为 4d105s1,Ag 只有 +1、+2、+3。可见,4d 亚层中的 10e 并非全是价电子。 2、 轨道表示式

工程化学教案 第五章 在电子排布式基础上,将电子所占轨道用一小方框表示,并在轨道下方标出轨道符号 轨道方框内所占电子用↑↓形象表示,简并轨道联在一起,如氨原子的电子排布示为: N:1S22S23P 其轨道表示式为: N: W 1S 2S 2P 三、简单基态离子的电子排布 ·原子失去电子而成为正离子时,优先失去最外层电子。 原子失电子的先后顺序一般为np,s,(m-1)d,(a-2 例 ,A3d4s2 [Ar]3d 不是失的的电城时最后充 再如,Mn2+的外层电子构型是323p63d5,而不是3s23p53d4s2或3d4s2 又如,Ti4+的外层电子构型是3s23p6。 ·原子成为负离子时,原子所得的电子总是分布在它的最外电子层上。 例如 C1-的外层电子分布式是323p6。 四。核外电子分布和周期系 原子核外电子分布的周期性是元素周期律的基础。而元素周期表是周期律的表现形式。 周期表有多种形式,现在常用的是长式周期表(见本书后附的元素周期表) 将原子核外电子分布与周期表对照能十 清楚的看出元素的周期性与原子结构的关系, 揭示周期律的实质。下面讨论元素性质的周期性与原子结构的关系: 1.元素在周期表中的位置与结构的关系 (1)周期号数=原子的电子层数 每增加一个电子层就开始一个新的周期。 )主族元素:族号数=最外层电子数 63) 副族元素:IB~B 族号数=最外层电子数: 川B~VⅦB族号数=最外层电子数+次外层d电子数 Ⅷ元素最外层电子数与次外层d电子数之和为8至10 零族元素最外层电子数为8或2 2.元素的分区 根据原 子的外层电子构型可将长式周期表分成5个区,即s区p区,d区,ds区和f区。具 体分区情况见书P216表5.3 3.元素的氧化值 同周期主族元素从左到右最高氧化数值逐新升高,并等于元素的最外层电子数 4.电离能气态原子失去一个电子成为+1价离子所需吸收的能量叫该元素的第一电离能, 它的大小反映原子得失电子的难易,电离能越大 夫电子越难。同一周期 人左到右,随着 原子核电荷数的增加,核对外层电子的吸引力也增加,原子半径减小,电离能随之增大,元 素金属活泼性逐渐减弱:同一主族,从上到下,电子层数增加,核对外层电子的吸引力减 小,原子半径增大,电离能逐渐减小,元素金属活泼性逐渐增强。 5.电负性分子中各原子吸引电子的能力大小的量度电负性数值越大,表明原子在分子
工程化学教案 第 五章 6 在电子排布式基础上,将电子所占轨道用一小方框表示,并在轨道下方标出轨道符号, 轨道方框内所占电子用 形象表示,简并轨道联在一起,如氮原子的电子排布示为: N:1S2 2S2 3P3 其轨道表示式为: 1S 2S 2P N: 三、简单基态离子的电子排布 ⚫ 原子失去电子而成为正离子时,优先失去最外层电子。 原子失电子的先后顺序一般为 np,ns,(n-1)d,(n-2)f, 例如, Fe :[Ar] 3d 64s2 Fe3+:[Ar] 3d5 不是先失去能量较高的 3d 的电子(而电子填充时最后填充 3d) 再如,Mn2+的外层电子构型是 3s23p63d5 ,而不是 3s23p63d34s2 或 3d34s2, 又如,Ti4+的外层电子构型是 3s23p6。 ⚫ 原子成为负离子时,原子所得的电子总是分布在它的最外电子层上。 例如, C1-的外层电子分布式是 3s23p6。 四.核外电子分布和周期系 原子核外电子分布的周期性是元素周期律的基础。而元素周期表是周期律的表现形式。 周期表有多种形式,现在常用的是长式周期表(见本书后附的元素周期表)。 将原子核外电子分布与周期表对照能十分清楚的看出元素的周期性与原子结构的关系, 揭示周期律的实质。下面讨论元素性质的周期性与原子结构的关系: 1. 元素在周期表中的位置与结构的关系 (1) 周期号数=原子的电子层数 每增加一个电子层就开始一个新的周期。 (2) 主族元素: 族号数=最外层电子数 (3) 副族元素:ⅠB~ⅡB 族号数=最外层电子数; ⅢB~ⅦB 族号数=最外层电子数+次外层 d 电子数 Ⅷ 元素 最外层电子数与次外层 d 电子数之和为 8 至 10 零族元素 最外层电子数为 8 或 2 2.元素的分区 根据原子的外层电子构型可将长式周期表分成 5 个区,即 s 区,p 区,d 区,ds 区和 f 区。具 体分区情况见书 P216 表 5.3 3. 元素的氧化值 同周期主族元素从左到右最高氧化数值逐渐升高,并等于元素的最外层电子数 4. 电离能 气态原子失去一个电子成为+1 价离子所需吸收的能量叫该元素的第一电离能, 它的大小反映原子得失电子的难易,电离能越大,失电子越难。同一周期,从左到右,随着 原子核电荷数的增加,核对外层电子的吸引力也增加,原子半径减小,电离能随之增大,元 素金属活泼性逐渐减弱;同一主族,从上到下,,电子层数增加,核对外层电子的吸引力减 小,原子半径增大,电离能逐渐减小,元素金属活泼性逐渐增强。 5. 电负性 分子中各原子吸引电子的能力大小的量度 电负性数值越大,表明原子在分子

工程化学教案 第五章 中吸引电子的能力越强:电负性值越小,表明原子在分子中吸引电子的能力越弱。 各元素的由负性的数值见书P218图512 6.原子光谱(看书P219,做一般性了解) 第三节化学键与分子结构 分子或品体内原子(或离子)间较强的相互吸引作用称为化学键。 离子键:阴、阳离子间福列吸引所成的化学键 共价能:原子之间由于成键电子 化学键 的原子轨道重叠所形成的化学键 金属键 金属晶体内部金属原子、金属阳离子与自由电子间的结合力 本节主要谈共价键的有关问题。 一、共价健参数。 1、键长成键的两个原子的核间距 ·般说,健长越小,健越稳定、越牢固 2、健能 共价键形成时,体系放出热量:断裂时,吸收能量。 a、双原子分子的键能等于气态时使分子离解为气态原子所需的能量。 如HC+H+Cl+1032kal.mol厂1. b、多原子分子的键能等于有关键离解能总和的平均值, -C+4 H 1661K1m0-1 C-H键能=16614=415.2 KJmol° 显然,四个C一H键断裂的难易程度不同,第一个最易断裂,吸收的能量少些。 键能表示了共价键强弱,键能越大,形成的键越牢固,含该键的分子越稳定。 3、键角 分子中原子(中心原子)形成多个共价键时,键与健之间的夹角,它反映了分子的空间 结构 健角(与键长)可用分子光谱或x衍射法测得,对简单分子来说,可以从理论上算出 其近似值。 4、极性与非极性。 ①极性与非极性 单质分子中】 同种原子形成共价键时,两个原子吸电子能力相同,电子云均等地 分布在原子间,不偏向任何一方。这种键就是非极性键。 不同原子形成共价健时,两原子电负性不同,电子云分布偏向吸电子能力强也就是电 负性较大的一方,使该方呈现一定的负电性,而另一方呈现一定正电性,这样的键有极性, 称为极性键。如H一C1。 ②偶极矩,是键极性大小的量度 所谓偶极矩是正电荷中心的距离d与电荷电量q之积。μ=q·d,它是矢量,用 “一”表示,表由正指向负。单位:D(德拜)。偶极矩越大,表明该键的极性越大。 分子的极性是分子中各个健极性的矢量和,它不只取决于健的极性,还决定于各个键在 空间的分布。分子的极性可用分子的偶极矩来衡量,所谓分子的偶极矩是分子中各个键的偶 极矩的矢量和。若分子的偶极矩为0,分子对称,分子无极性。 一单原子,简单的双原子分子。 如H、O2, μ=0,无极性 不同原子的双原子分子,u≠0,分子有极性。 一μ=0,无极性。如CH4、CC4(分子对称) 一多原子分子
工程化学教案 第 五章 7 中吸引电子的能力越强;电负性值越小,表明原子在分子中吸引电子的能力越弱。 各元素的电负性的数值见书 P218 图 5.12 6.原子光谱(看书 P219,做一般性了解)。 第三节 化学键与分子结构 分子或晶体内原子(或离子)间较强的相互吸引作用称为化学键。 离子键:阴、阳离子间强烈吸引所成的化学键。 化学键 共价键:原子之间由于成键电子的原子轨道重叠所形成的化学键。 金属键:金属晶体内部金属原子、金属阳离子与自由电子间的结合力。 本节主要谈共价键的有关问题。 一、共价键参数。 1、键长 成键的两个原子的核间距。 一般说,键长越小,键越稳定、越牢固。 2、键能 共价键形成时,体系放出热量;断裂时,吸收能量。 a、 双原子分子的键能等于气态时使分子离解为气态原子所需的能量。 如 HCl(g)→H(g)+Cl(g)+103ֽ2 kal. mol-1。 b、 多原子分子的键能等于有关键离解能总和的平均值。 如、 CH4(g)→C(g)+4 H(g)+1661 KJmol-1。 则、 C—H 键能 = 1661⁄4 = 415.2 KJmol-1。 显然,四个 C—H 键断裂的难易程度不同,第一个最易断裂,吸收的能量少些。 键能表示了共价键强弱,键能越大,形成的键越牢固,含该键的分子越稳定。 3、键角 分子中原子(中心原子)形成多个共价键时,键与键之间的夹角, 它反映了分子的空间 结构。 键角(与键长)可用分子光谱或 x 衍射法测得,对简单分子来说,可以从理论上算出 其近似值。 4、极性与非极性。 ① 极性与非极性 单质分子中,同种原子形成共价键时,两个原子吸电子能力相同,电子云均等地 分布在原子间,不偏向任何一方。这种键就是非极性键。 不同原子形成共价键时,两原子电负性不同,电子云分布偏向吸电子能力强也就是电 负性较大的一方,使该方呈现一定的负电性,而另一方呈现一定正电性,这样的键有极性, 称为极性键。 如 H—Cl。 ② 偶极矩,是键极性大小的量度, 所谓偶极矩是正电荷中心的距离 d 与电荷电量 q 之积。µ= q·d ,它是矢量,用 “→”表示,表由正指向负。单位:D(德拜)。偶极矩越大,表明该键的极性越大。 分子的极性是分子中各个键极性的矢量和,它不只取决于键的极性, 还决定于各个键在 空间的分布。分子的极性可用分子的偶极矩来衡量,所谓分子的偶极矩是分子中各个键的偶 极矩的矢量和。若分子的偶极矩为 0,分子对称,分子无极性。 单原子,简单的双原子分子。 如 H、O2, µ= 0,无极性。 不同原子的双原子分子,µ ≠0,分子有极性。 µ= 0,无极性。如 CH4、CCl4(分子对称) 多原子分子

工程化学教案 第五章 一u≠0,有极性。如NH:(分子不对称 共价键特 1、饱和性 个原子形成共价健的能力是有限的,有多少个未成对电子,就最多能与 别的原子的多少个自旋相反的电子配对成多少个共价键。 2、方向性成键时,沿两个能最大重叠的方向去重叠。 三、共价糖的类刑 强极性键HC 一极性键 1、按是否具有极性可分为 弱极性健CO2,Ⅲ 一非极性键 2、按成键原子轨道重叠方式的不同。分为·键与π键。 成键轨道沿键轴(键合原子核间连线)方向以“头碰头”的方式重叠所成的键为。 键。成键电子为0电子。 B、元键 成键原子轨道沿键轴方向以“启并启”的方式重叠所成的键为π键,成鞋的电子称 为π电子 双键和叁键即有键又有π键。 如N=N(一个δ键、二个π键》 四、 杂化轨道理论及分子的几何构型 按电子配对理论,B的价层电子构型为2S2,无未成对电子,不能形成共价键。即使价 层电子激发成2S'2P',形成的两个共价键是不等同的。事实上,BeC12分子中的两个BC C1键却是等同的。再如,C的价电子层构型为2S2P,只两个未成对电子,按电子配对理 论C只能形成2个共价键,即使激发成2S2P,所形成的4个共价键应不完全相同。为解释 这些现象,1931鲍林在电子配对理论基础上,建立了杂化轨道理论。 1、杂化轨道理论要点 )假设某原子成键时,在成键作用下,该原子内能级相近的不同原子轨道有可能混合 起来,重新组合成一组有利于成键的新轨道(称杂化轨道)。原子成键时价层中不同类型的 原子轨道的混合重组的过程称为条化。杂化后形成形状、能量完全相同,有一定空间构型的 新的对等轨道 简并 轨道)就是杂化轨道 (2)原子轨道数目。 同一原子的能级相近的几个原子轨道杂化后形成相关杂化轨道。前后轨道数目相等。 因为杂化前后价电子层能容纳电子的总数不变,容纳电子的轨道数也应不变。如同一原子 s与np的三个轨道杂化将形成4个SP杂化轨道。 ③)杂化轨道的成键能力 轨道杂化后,杂化轨道形状一头大、一头小。成健是以大的一头与键合原子的轨道重 叠,比未经杂化的轨道重叠得多,因而杂化轨道的成键能力比原来未杂化的轨道强。 2、杂化类型与分子的几何构型 杂化类型 SP 分子几何构型 正四面体 平面正三角形 杂化轨道夹 109.5 180 杂化轨道数目 4 以C的SP、SP2、SP杂化为例说明甲烷、乙烯、乙炔的分子构型
工程化学教案 第 五章 8 µ ≠0,有极性。如 NH3(分子不对称) 二、 共价键特征 1、 饱和性 一个原子形成共价键的能力是有限的,有多少个未成对电子,就最多能与 别的原子的多少个自旋相反的电子配对成多少个共价键。 2、 方向性 成键时,沿两个能最大重叠的方向去重叠。 三、共价键的类型 强极性键 HCl 极性键 1、按是否具有极性可分为 弱极性键 CO2,HI 非极性键 2、按成键原子轨道重叠方式的不同。分为σ键与 π 键。 A、 σ键 成键轨道沿键轴(键合原子核间连线)方向以“头碰头”的方式重叠所成的键为σ 键。成键电子为σ电子。 B、π 键 成键原子轨道沿键轴方向以“肩并肩”的方式重叠所成的键为 π 键,成键的电子称 为 π 电子。 双键和叁键即有σ键又有 π 键。 如 N≡N(一个 δ 键、二个 π 键) 四、 杂化轨道理论及分子的几何构型 按电子配对理论,Be 的价层电子构型为 2S2,无未成对电子,不能形成共价键。即使价 层电子激发成 2S12P1,形成的两个共价键是不等同的。事实上,BeCl2 分子中的两个 Be- Cl 键却是等同的。再如,C 的价电子层构型为 2S22P2,只两个未成对电子,按电子配对理 论 C 只能形成 2 个共价键, 即使激发成 2S12P3 , 所形成的 4 个共价键应不完全相同。为解释 这些现象,1931 鲍林在电子配对理论基础上,建立了杂化轨道理论。 1、 杂化轨道理论要点 ⑴ 假设某原子成键时,在成键作用下,该原子内能级相近的不同原子轨道有可能混合 起来,重新组合成一组有利于成键的新轨道(称杂化轨道)。原子成键时价层中不同类型的 原子轨道的混合重组的过程称为杂化。杂化后形成形状、能量完全相同,有一定空间构型的 新的对等轨道(简并轨道)就是杂化轨道。 ⑵ 原子轨道数目。 同一原子的能级相近的几个原子轨道杂化后形成相关杂化轨道。前后轨道数目相等。 因为杂化前后价电子层能容纳电子的总数不变,容纳电子的轨道数也应不变。如同一原子 ns 与 np 的三个轨道杂化将形成 4 个 SP3 杂化轨道。 ⑶ 杂化轨道的成键能力。 轨道杂化后,杂化轨道形状一头大、一头小。成键是以大的一头与键合原子的轨道重 叠,比未经杂化的轨道重叠得多,因而杂化轨道的成键能力比原来未杂化的轨道强。 2、杂化类型与分子的几何构型 杂化类型 SP3 SP2 SP 分子几何构型 正四面体 平面正三角形 直线型 杂化轨道夹角 109.50 1200 1800 杂化轨道数目 4 3 2 以 C 的 SP、SP2、SP3 杂化为例说明甲烷、乙烯 、乙炔的分子构型

工程化学教案 第五章 四田口数田团 IS 2S 2P SP3 T SP2 ttt 2P SP 幻 P 第四节分子间的作用力和氢键 分子的极性和变形性 分子间的作用力 色散力 当非极性分子相互靠近时,会产生瞬间正、负电荷中心不重合,这种爵时正负电荷中 心不重合产生的偶极叫做瞬间偶极。由爵间偶极产生的分子间力叫做色散力。色散力随物 质分子量的增加而增大。 2。取向力 当极性分子之间存在固有偶极的相互作用,由固有偶极之间的取向而产生的分子间力 叫做取向力。 3.诱导力 极性分子中,在相邻分子的周有偶极作用下,使每个分子的正、负电荷中心更加分开, 产生了诱导偶极。诱导偶极与固有偶极之间产生的分子间力叫做诱导力。 色散力存在于各种分 子中 般也是最主要的,只有当分子的极性很大(如水分子) 时才以取向力为主,而诱导力一般较小。 三、 氢健 氢键是指氢原子与电负性较大的x原子(如F、O、N原子)以极性共价键相结合时,还 能吸引另一个电负性较大、半径又较小的Y原子仪原子也可与Y原子相同,也可不同)的孤 对电子所形成的分子间或分子内的键。可简单示意如下: 能形成氢键的物质相当广泛,例如,HF、HO、NH、无机含氧酸和有机羧酸、醇、 胺、蛋白质以及某些合成高分子化合物等物质的分子(或分子链)之间都存在着氢健。因为这 些物质的分子中,含有FH、OH键或NH键。 氢链具有饱和性和方向性。 分子间存在氢键时,大大加强了分子间的相互作用。氢键在生物化学中也有重要意 义。 四、 分子间力和氢键对物质性质的影响 (1)物质的熔点和沸点。对于同类型的单质和化合物,其熔点一般随摩尔质量的增 9
工程化学教案 第 五章 9 激发 SP 3 SP 2 SP 1S 2S 2P 1S SP 3 1S SP 2 2P 1S SP 2P 1S 2S 2P 第四节 分子间的作用力和氢键 一、 分子的极性和变形性 二、 分子间的作用力 1. 色散力 当非极性分子相互靠近时,会产生瞬间正、负电荷中心不重合,这种瞬时正负电荷中 心不重合产生的偶极叫做瞬间偶极。由瞬间偶极产生的分子间力叫做色散力。色散力随物 质分子量的增加而增大。 2. 取向力 当极性分子之间存在固有偶极的相互作用,由固有偶极之间的取向而产生的分子间力 叫做取向力。 3. 诱导力 极性分子中,在相邻分子的固有偶极作用下,使每个分子的正、负电荷中心更加分开, 产生了诱导偶极。诱导偶极与固有偶极之间产生的分子间力叫做诱导力。 色散力存在于各种分子中,一般也是最主要的,只有当分子的极性很大(如水分子) 时才以取向力为主,而诱导力一般较小。 三、 氢键 氢键是指氢原子与电负性较大的 x 原子(如 F、O、N 原子)以极性共价键相结合时,还 能吸引另一个电负性较大、半径又较小的 Y 原子(x 原子也可与 Y 原子相同,也可不同)的孤 对电子所形成的分子间或分子内的键。可简单示意如下: X — Hִ……ִYִ ִ ִ 能形成氢键的物质相当广泛,例如,HF、H2O、NH3、无机含氧酸和有机羧酸、醇、 胺、蛋白质以及某些合成高分子化合物等物质的分子(或分子链)之间都存在着氢键。因为这 些物质的分子中,含有 F-H、O-H 键或 N-H 键。 氢键具有饱和性和方向性。 分子间存在氢键时,大大加强了分子间的相互作用。氢键在生物化学中也有着重要意 义。 四、 分子间力和氢键对物质性质的影响 (1)物质的熔点和沸点。对于同类型的单质和化合物,其熔点一般随摩尔质量的增

工程化学教案 第五章 大而升高。但含有氢健的物质,沸点和熔点一般较高。 (2)物质的溶解性。 ‘相似者相溶'是一个简单有用的经验规律。 第五节晶体结构 一,离子晶体 (1)完义 格点上交替排列正、负离子,其间以离子键结合而构成的晶体叫做离子晶体。 (2)离子晶体的特征 ①配位数较高 离子键不具有方向性和饱和性,在离子晶体中各离子将尽可能多吸引异号离子,因此离 子品体配位数一般较高。离子晶体中不存在单独的分子。 ②熔点较高、硬度较大、有脆性 在离子品体中,微粒间以较强的离子键相互作用,所以离子品体一般具有较高的熔点利和 较大的硬度,延展性差,有脆性。 ③溶于极性溶剂 多数离子品体易溶于水等极性溶剂。离子晶体的水溶液或熔融液都易导电, (3)晶格能 离子晶体的熔点 更度等特性 品体 品格能大小有关。 品格能是指在和298.15K条件下,由气态正、负离子形成单位物质的量的离子品体 所释放的能量。 晶格能的大小与正、负离子的电荷(分别以4、乙表示)和正、负离子的半径r(分别4 【表示)有关: 显然,离子的半径愈小、电荷数愈多,晶格能愈高。此时品体的熔点高,硬度大。 例如 化合物 Mgo Cao Sro BaO 熔占℃ 2852 2614 2430 1918 R.+r/m 0.198 0.231 0.244 0.266 蕊氏师府 5565 45 3.8 3.3 离子电荷对晶体熔点、硬度的影响见p238表5.12 二.原子晶体 以共价键形成的固体物质可以分为两类品体,即原子品体和分子品体。 1,原子晶体的定义晶格点上排列的微粒为原子,原子之间以共价键结合构成的晶体叫做 原子晶体 属原子晶体的物质,单质中常见的除金刚石外,还有可用作半导体的单品硅和绪,它们 都是第V主族元素。在化合物中如碳化硅(SiC、砷化嫁(CAs人方石英(Si02)等也属于原子 品体 2.原子晶体的特征 配位数不高 由于共价健具有饱和性和方向性,所以原子晶体一般配位数不高。 熔点高,硬度大,一般不导电。 三分子晶体
工程化学教案 第 五章 10 大而升高。但含有氢键的物质,沸点和熔点一般较高。 (2)物质的溶解性。‘相似者相溶’是一个简单有用的经验规律。 第五节 晶体结构 一.离子晶体 (1)定义 格点上交替排列着正、负离子,其间以离子键结合而构成的晶体叫做离子晶体。 (2)离子晶体的特征 ① 配位数较高 离子键不具有方向性和饱和性,在离子晶体中各离子将尽可能多吸引异号离子,因此离 子晶体配位数一般较高。离子晶体中不存在单独的分子。 ② 熔点较高、硬度较大、有脆性 在离子晶体中,微粒间以较强的离子键相互作用,所以离子晶体一般具有较高的熔点和 较大的硬度,延展性差,有脆性。 ③ 溶于极性溶剂 多数离子晶体易溶于水等极性溶剂。离子晶体的水溶液或熔融液都易导电。 (3) 晶格能 离子晶体的熔点、硬度等特性与晶体的晶格能大小有关。 晶格能是指在 P 0和 298.15K 条件下,由气态正、负离子形成单位物质的量的离子晶体 所释放的能量。 晶格能的大小与正、负离子的电荷(分别以 z+、z-表示)和正、负离子的半径 r(分别 r+、 r-表示)有关: E ∝ 显然,离子的半径愈小、电荷数愈多,晶格能愈高。此时晶体的熔点高,硬度大。 例如 化合物 MgO CaO SrO BaO 熔点/℃ 2852 2614 2430 1918 R++ r- /nm 0.198 0.231 0.244 0.266 莫氏硬度 5.5~6.5 4.5 3.8 3.3 离子电荷对晶体熔点、硬度的影响见 p238 表 5.12 二. 原子晶体 以共价键形成的固体物质可以分为两类晶体,即原子晶体和分子晶体。 1. 原子晶体的定义 晶格点上排列的微粒为原子,原子之间以共价键结合构成的晶体叫做 原子晶体。 属原子晶体的物质,单质中常见的除金刚石外,还有可用作半导体的单晶硅和锗,它们 都是第Ⅳ主族元素。在化合物中如碳化硅(SiC)、砷化嫁(CaAs )、方石英(Si02 )等也属于原子 晶体。 2. 原子晶体的特征 配位数不高 由于共价健具有饱和性和方向性,所以原子晶体一般配位数不高。 熔点高,硬度大,一般不导电。 三.分子晶体
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第4章 电化学.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第3章 溶液与离子平衡.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第2章 化学动力学基础.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第1章 热力学(主讲教师:董文魁、许力、李静萍).doc
- 兰州交通大学:《工程化学》课程教学大纲 Engineering Chemistry(负责人:董文魁).pdf
- 《生物化学》课程教学资源(参考资料)生物化学英汉词汇.doc
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第四章 酶化学 Enzyme.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第六章 生物氧化与生物能.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第八章 生物化学过程的调控.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第五章 核酸.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第二章 细胞与生物膜 biological membrane.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第三章 蛋白质.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第七章 代谢.pdf
- 兰州交通大学:《生物化学》课程教学课件(讲稿)第一章 生命——绪论 Biochemistry Biochemistry(负责人:李师翁).pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第二十章 有机合成(元素有机化合物).pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第十九章 氨基酸、蛋白质、核酸.pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第十八章 碳水化合物.pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第十七章 杂环化合物.pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第十六章 重氮化合物和偶氮化合物.pdf
- 兰州交通大学:《有机化学》课程教学课件(打印版)第十五章 硝基化合物和胺.pdf
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第6章 化学与能源.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第7章 化学与环境.doc
- 兰州交通大学:《工程化学》课程教学资源(授课教案)第8章 化学与工程材料.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)绪论(负责人:董文魁).doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第一部分 实验基本操作及数据处理.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第二部分 基本实验(共十个实验).doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)第三部分 开放、综合及设计实验.doc
- 兰州交通大学:《工程化学》课程教学资源(实验指导)附录.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第1章 热力学(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第2章 化学动力学基础(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第3章 溶液与离子平衡(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第4章 电化学(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第5章 物质结构基础(含参考答案).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)第6章 化学与能源、第7章 化学与环境、第8章 化学与工程材料.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学自测试卷及参考答案(一).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学自测试卷及参考答案(二).doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学作业批改.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷A参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B.doc
