兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第二章 化学动力学基础

净一异二静净 使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生 主讲教师: 董文魁、许力、李静萍等
使用教材:许力等编著,《工程化学》,兰州大学出版社 授课对象:非化学类各专业学生 主讲教师:董文魁、许力、李静萍等

学习目的和要求: 掌屋化学反应速率的概念 0 掌屋浓度对化学反应速率的影响 掌握温度对化学反应速率的影响 掌握反应速率理论。 掌握催化与催化作用 了解多相催化与酶催化作用
学习目的和要求: 掌握化学反应速率的概念。 掌握浓度对化学反应速率的影响 掌握温度对化学反应速率的影响。 掌握反应速率理论。 掌握催化与催化作用。 了解多相催化与酶催化作用

本章节重点、难点 化学反应速率的概念(平均速率与瞬 时速率 浓度对化学反应速率的影响、温度对 化学反应速率的影响 反应速率理论(碰撞理论与活化络合 物理论) 化与催化作用(催化剂与催化作用)
本章节重点、难点 化学反应速率的概念(平均速率与瞬 时速率) 浓度对化学反应速率的影响、温度对 化学反应速率的影响 反应速率理论(碰撞理论与活化络合 物理论) 化与催化作用(催化剂与催化作用)

学时分配 掌握化学反应速率的概念(1学时) 掌握浓度对化学反应速率的影响(1.5学 时) 掌握温度对化学反应速率的影响(1.5学 时 掌握反应速率理论(1学时)。 掌握催化与催化作用(1学时)
学时分配 掌握化学反应速率的概念(1学时)。 掌握浓度对化学反应速率的影响(1.5学 时)。 掌握温度对化学反应速率的影响(1.5学 时)。 掌握反应速率理论(1学时)。 掌握催化与催化作用(1学时)

化学反寇速牵的棍念 ©一1反应的反应速率 。2平均速率与瞬时速率
化学反应速率的概念 1 反应的反应速率 2 平均速率与瞬时速率

反应的反应速率 如果体积不变: ds Vdt Vvedt Vedr 1△c )= △t-→0时 VB Al
如果体积不变: ( 0时) 1 B → = t t c t c V t n V t d d d d d d B B B B = = = 1 反应的反应速率

对于一般的化学反应: aA bB yY zZ dCA dcB s dcy dcz )= adt bdt ydt zdt 对于定容的气相反应: )=
z t c y t c b t c a t c d d d d d d d d A B Y Z = − = − = = aA + bB yY + zZ t p d 1 d B B = 对于定容的气相反应: 对于一般的化学反应:

2平均速率与瞬时速率 1.平均速率 某一有限时间间隔内浓度的变化量。 △f>0时 △1
2 平均速率与瞬时速率 ( 0时) 1 B B → = t t c 1. 平均速率 某一有限时间间隔内浓度的变化量
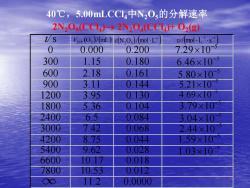
40℃,5.00 mLCCI4中N20s的分解速率 2N20s(CC1)→2N20(CC14+02(g t/s Ism(2)/(mL)c(N,O,)/(mol.L- v/(mol.L.s- 0 0.000 0.200 7.29×10 300 1.15 0.180 6.46×10 600 2.18 0.161 5.80×10- 900 3.1Π 0.144 5.21×10 1200 3.95 0.130 4.69×10 1800 5.36 0.104 3.79×10 2400 6.5 0.084 3.04×10 3000 7.42 0.068 2.44×10 4200 8.75 0.044 1.59x10 5400 9.62 0.028 1.03×10 6600 10.7 0.018 7800 10.53 0.012 O 11.2 0.0000
t/s 0 0.000 0.200 300 1.15 0.180 600 2.18 0.161 900 3.11 0.144 1200 3.95 0.130 1800 5.36 0.104 2400 6.5 0.084 3000 7.42 0.068 4200 8.75 0.044 5400 9.62 0.028 6600 10.17 0.018 7800 10.53 0.012 11.2 0.0000 (O )/(mL) VSTP 2 ( ) ( ) 1 N2 O5 / mol L − c ( ) 1 1 / mol L s − − 5 7.29 10− 5 6.46 10− 5 5.80 10− 5 5.21 10− 5 4.69 10− 5 3.79 10− 5 3.04 10− 5 1.03 10− 5 2.44 10− 5 1.59 10− 40℃,5.00mLCCl4中N2O5的分解速率 2N2O5 (CCl4 )→ 2N2O4 (CCl4 )+ O2 (g)

例:2N2O(CC14)→2N204(CC14)+O2(g) 4=0s c1N20)=0.200molL-1 t2=300S c2N20s)=0.180mol-L- D=-(0.180-0.200)molL =3.3x10mol.L.s 2×300s 2.瞬时速率 时间间隔△趋于无限小时的平均速率的极 限。 lim △CB dCB 90△d d
t1= 0 s c1 (N2O5 ) = 0.200 mol·L-1 t2=300 s c2 (N2O5 ) = 0.180 mol·L-1 5 -1 -1 - 1 3.3 10 mol L s 2 300s mol L = −(− ) = − 2. 瞬时速率 时间间隔Δt趋于无限小时的平均速率的极 限。 t c t c t d d lim B B 0 = = → 2N2O4 (CCl4 ) + O2 例:2N (g) 2O5 (CCl4 )
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第三章 溶液与离子平衡.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第七章 化学与环境.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第一章 化学热力学基础(第二定律).ppt
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学多媒体教学课件相关研究.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验课程的相关探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学考核体系的建立及效果.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革探索.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学课程建设的主要措施及成效.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验的任务及其措施的探讨.doc
- 兰州交通大学:《工程化学》课程教学资源(参考资料)工程化学实验教学改革的探索与实践.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷H.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷G.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷F.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷E.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷D.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷C.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B参考答案.doc
- 兰州交通大学:《工程化学》课程教学资源(试卷习题)工程化学试卷B.doc
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第五章 物质结构基础.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第八章 化学与工程材料.ppt
- 兰州交通大学:《工程化学》课程教学课件(PPT讲稿)第六章 化学与能源.ppt
- 兰州交通大学:《环境化学》课程教学资源(课件讲稿)第一章 绪论(负责人:赵保卫).pdf
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题02参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题03参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题04参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题05参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题06参考答案.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题02试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题03试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题04试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题05试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学试题06试题.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷九.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷二.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷八.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷七.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷六.doc
- 兰州交通大学:《环境化学》课程教学资源(试卷习题)环境化学模拟测试卷三.doc
