石河子大学:《仪器分析》课程教学资源(授课教案)红外吸收光谱法 IR

石河子大学化学化工学院 教案 开课单位:化学化工学院 课程名称:分析化学(二) 专业年级:药学、中药专业 任课教师:赵芳 教材名称:分析化学
石河子大学化学化工学院 教 案 开课单位:化学化工学院 课程名称:分析化学(二) 专业年级:药学、中药专业 任课教师: 赵 芳 教材名称: 分析化学

学年第学期 授课 内容 第四章红外吸收光谱法 课时安排6学时 教学 了解红外吸收光谱法的特点,掌握红外吸收光谱法的原理:分子的振动: 红外吸收光谱产生的条件和谱带强度:基团振动与红外光谱区域:影响基团 要求 频率位移的因素。了解红外光谱仪的构造及红外吸收法的应用。 教学 教学重点:红外吸收光谱法的原理:红外吸收光谱仪的基本原理及应用。 重点 难点 教学难点:红外吸收光谱法的原理。 教学 方 多媒体课件,以讲授为主 手段 第一节概述 一、红外光谱法特点 二、红外光谱图表示方法 第二节红外吸收基本理论 一、分子振动 学 二、红外吸收光谱产生的条件和谱带强度 内 三、基团振动与红外光谱区域 容 四、影响基团频率位移的因素 第三节红外吸收光谱仪 提 、红外光谱仪主要部件 纲 二、色散型红外光谱仪 三、傅里叶变换红外光谱仪 第四节红外吸收光谱分析 一、试样的制备 二、红外吸收光谱分析
2 学年第 学期 授课 内容 第四章 红外吸收光谱法 课时安排 6 学时 教学 目的 要求 了解红外吸收光谱法的特点, 掌握红外吸收光谱法的原理:分子的振动; 红外吸收光谱产生的条件和谱带强度;基团振动与红外光谱区域;影响基团 频率位移的因素。了解红外光谱仪的构造及红外吸收法的应用。 教学 重点 难点 教学重点:红外吸收光谱法的原理;红外吸收光谱仪的基本原理及应用。 教学难点:红外吸收光谱法的原理。 教学 方法 手段 多媒体课件,以讲授为主 教 学 内 容 提 纲 第一节 概述 一、红外光谱法特点 二、红外光谱图表示方法 第二节 红外吸收基本理论 一、分子振动 二、红外吸收光谱产生的条件和谱带强度 三、基团振动与红外光谱区域 四、影响基团频率位移的因素 第三节 红外吸收光谱仪 一、红外光谱仪主要部件 二、色散型红外光谱仪 三、傅里叶变换红外光谱仪 第四节 红外吸收光谱分析 一、试样的制备 二、红外吸收光谱分析

课外 学习 理解并掌握本章所讲内容,完成课后思考题2、5、7。 要求 红外吸收光谱法 第一节概述 1红外光谱法特点 1.1红外光谱不涉及分子的电子能级,主要是振动能级跃迁。 红外光谱波长范围约为0.78~1000um: (1)近红外光区(0.78~2.5um) (2)中红外光区(2.5~50μm) (3)远红外光区(50~1000m) 与紫外可见吸收光谱法比较,红外光谱法具有以下特点: (1)紫外可见吸收光谱是电子振转光谱,涉及主要是电子能级跃迁,常用于研究不饱 和有机物,特别是具有共轭体系的有机化合物:而红外光谱是振转光谱,涉及振动能级 的跃迁,几乎(除了单原子分析和同核双原子分子外)可用于所有化合物的研究。 (2)红外光谱法最重要和最广泛的用途是对有机化合物进行结构分析。 (3)物质对红外光谱的吸收强度与物质含量也符合郎伯比尔定律,也可用于定量分析 但干扰较大。 (4)可测定气体、液体、固体样品,并且试样用量少,分析速度快,不破坏样品。 2红外光谱图表示方法 红外光谱图一般用下。曲线或下入曲线来表示: 3
3 课外 学习 要求 理解并掌握本章所讲内容,完成课后思考题 2、5、7。 教学 后记 红外吸收光谱法 第一节 概 述 1 红外光谱法特点 1.1 红外光谱不涉及分子的电子能级,主要是振动能级跃迁。 红外光谱波长范围约为 0.78~ 1000µm: (1)近红外光区(0.78 ~ 2.5µm ) (2)中红外光区(2.5 ~ 50µm ) (3)远红外光区(50 ~ 1000 µm ) 与紫外-可见吸收光谱法比较,红外光谱法具有以下特点: (1)紫外-可见吸收光谱是电子-振-转光谱,涉及主要是电子能级跃迁,常用于研究不饱 和有机物,特别是具有共轭体系的有机化合物;而红外光谱是振-转光谱,涉及振动能级 的跃迁,几乎(除了单原子分析和同核双原子分子外)可用于所有化合物的研究。 (2)红外光谱法最重要和最广泛的用途是对有 机化合物进行结构分析。 (3)物质对红外光谱的吸收强度与物质含量也符合郎伯-比尔定律,也可用于定量分析, 但干扰较大。 (4)可测定气体、液体、固体样品,并且试样用量少,分析速度快,不破坏样品。 2 红外光谱图表示方法 红外光谱图一般用 T- 曲线或 T- λ曲线来表示 :

10 (a)线形波长表示法 (b)线形波数表示法 第一节 红外吸收基本理论 1分子振动 1.1谐振子分子不是一个刚体,分子中的原子以平衡点为中心,以非常小的振幅(与原 子核之间的距离相比)作周期性的振动,最简单的双原子分子的振动,经典方法可以用 一个弹簧两端连结两个小球的谐振子来模拟。 谐振子对简单的双原子分子的振动可以用谐振子模型来模拟: (4-1) k:化学键力常数 μ为折合质量 可见分子振动频率与化学键的力常数、原子质量有关系。如果用量子力学 来处理,求解得到分子的振动能级EV与谐振子振动频率的关系为 E,=(±he6=(c±m 12非谐振子 实际上双原子分子并非理想的谐振子,比较双原子分子与谐振动位能曲线如图所示 a是谐振子振动位能曲线,bb是真实双原子振动位能曲线。随着v增大,能级间的间 隔逐渐减小:当ⅴ较小时,真实分子振动情况与谐振子振动比较近似。 解高能
4 (a)线形波长表示法 (b)线形波数表示法 第一节 红外吸收基本理论 1 分子振动 1.1 谐振子 分子不是一个刚体,分子中的原子以平衡点为中心,以非常小的振幅(与原 子核之间的距离相比)作周期性的振动,最简单的双原子分子的振动,经典方法可以用 一个弹簧两端连结两个小球的谐振子来模拟。 谐振子 对简单的双原子分子的振动可以用谐振子模型来模拟: 1 2 k v = (4-1) k:化学键力常数 μ 为折合质量 可见分子振动频率与化学键的力常数、原子质量有关系。如果用量子力学 来处理,求解得到分子的振动能级 EV 与谐振子振动频率的关系为 1 1 ( ) ( ) 2 2 E v he v hv v = = 1.2 非谐振子 实际上双原子分子并非理想的谐振子,比较双原子分子与谐振动位能曲线如图所示 aa′ 是谐振子振动位能曲线,bb′是真实双原子振动位能曲线。随着 增大,能级间的间 隔逐渐减小;当 较小时,真实分子振动情况与谐振子振动比较近似

双原子分子振动位能比较a'一谐振子振动位能曲线bb'一双原子振动位能曲线 1.3分子的振动形式 (1)伸缩振动 原子沿键轴方向伸缩,键长发生周期性变化而键角不变的振动称为伸缩振动,用符号 v表示。它又可以分为对称伸缩振动(ws,symmetrical)和不对称伸缩振动(vas, asymmetrical)。对同一基团,不对称伸缩振动的频率要稍高于对称伸缩振动, (2)变形振动(又称弯曲振动或变角振动) 变形振动是指基团键角发生周期变化而键长不变的振动称为变形振动,用符号δ表 示。 变形振动又分为面内变形和面外变形振动。 面内变形振动又分为剪式(以δ表示)和平面摇摆振动(以p表示)。 面外变形振动又分为非平面摇摆(以▣表示)和扭曲振动(以τ表示)。 (3)振动自由度振动自由度,即独立振动数,用来描述多原子分子振动形式的多少 每个振动自由度相当于红外光谱图上一个基频吸收带。 即独立振动数,表示多原子分子振动形式的多少。 对非线性分子: 3n-6 n为原子数 对线性分子: 3n-5 3红外吸收光谱产的条件和谱带强度 3.1分子吸收红外辐射的条件 分子吸收红外辐射必须同时满足以下两个条件: (1)辐射应具有刚好满足振动跃迁所需的能量。 (2)只有能使偶极矩发生变化的振动形式才能吸收红外辐射。 3.2吸收谱带的强度 红外吸收谱带的强弱与分子偶极矩变化的大小有关,根据量子理论红外光谱 的强度与分子振动时偶极矩变化的平方成正比。 如:c=c双键和c-0双键的振动,由于c-0双键振动时,偶极矩变化较c=C双键大, 因此c0键的谱带强度比c=℃双大得多。 偶极矩的变化与固有偶极矩有关,一般极性比较强的分子或基团吸收强度都 比较大 3.3基团振动与红外光谱区域
5 双原子分子振动位能比较 aa′-谐振子振动位能曲线 bb′-双原子振动位能曲线 1.3 分子的振动形式 (1)伸缩振动 原子沿键轴方向伸缩,键长发生周期性变化而键角不变的振动称为伸缩振动,用符号 表示。它又可以分为对称伸缩振动 (s,symmetrical) 和不对称伸缩振动 (as, asymmetrical)。对同一基团,不对称伸缩振动的频率要稍高于对称伸缩振动。 (2)变形振动(又称弯曲振动或变角振动) 变形振动是指基团键角发生周期变化而键长不变的振动称为变形振动,用符号 表 示。 变形振动又分为面内变形和面外变形振动。 面内变形振动又分为剪式(以 表示)和平面摇摆振动(以 表示)。 面外变形振动又分为非平面摇摆(以 表示)和扭曲振动(以 表示)。 (3)振动自由度 振动自由度,即独立振动数,用来描述多原子分子振动形式的多少。 每个振动自由度相当于红外光谱图上一个基频吸收带。 即独立振动数,表示多原子分子振动形式的多少。 对非线性分子: 3n − 6 n 为原子数 对线性分子: 3n − 5 3 红外吸收光谱产的条件和谱带强度 3.1 分子吸收红外辐射的条件 分子吸收红外辐射必须同时满足以下两个条件: (1)辐射应具有刚好满足振动跃迁所需的能量。 (2)只有能使偶极矩发生变化的振动形式才能吸收红外辐射。 3.2 吸收谱带的强度 红外吸收谱带的强弱与分子偶极矩变化的大小有关,根据量子理论红外光谱 的强度与分子振动时偶极矩变化的平方成正比。 如:c=c 双键和 c=0 双键的振动,由于 c=0 双键振动时,偶极矩变化较 c=c 双键大, 因此 c=0 键的谱带强度比 c=c 双大得多。 偶极矩的变化与固有偶极矩有关,一般极性比较强的分子或基团吸收强度都 比较大 3.3 基团振动与红外光谱区域

红外光谱可分为基频区和指纹区两大区域 (1)基频区(4000~1350cm)又称为特征区或官能团区,其特征吸收峰可 作为鉴定基团的依据。 X-H伸缩振动区(4000一2500cm') 三键及累积双键区(2500~1900cm') 双键伸缩振动区(1900一1200cm) X-H弯曲振动区(1650~1350cm') (2)指纹区(1350~650cm) 指纹区的吸收峰是由于c一c,c一0,c一x单键的伸缩振动以及分子骨架中多数 基团的弯曲振动所引起。 4影响基团频率位移的因素 分子中各基团的振动并不是孤立的要受到分子中其它部分特别是邻近基团 的影响,这种影响可分为内部因素和外部因素。 4.1内部因素 (1)诱导效应:吸电子基团使吸收峰向高颜方向移动(蓝移)。 R-COR vC=O 1715cm:R-COH vC=0 1730cm-1 R-COCI vC=O 1800cm1 R-COF vC=0 1920cm 一 F-COF vC=0 1928cm1 R-CONH2 vC=O 1920cm1 (2)共轨效应:轭效应使共轭体系中的电子云密度平均化,结果使原来的双键略有伸长 (即电子云密度降低)、力常数减小,使其吸收频率向低波数方向移动。 (3)氢键作用:氢键的形成使电子云密度平均化,从而使伸缩振动频率降低。(分子 内氢键:分子间氢键):对峰位,峰强产生极明显影响,使伸缩振动频率向低波数方向移 动。分子内氢键不受浓度影响,分子间氢键受浓度影响较大。 (4)空间效应:场效应:空间位阻;环张力 (5)振动耦合:当两个振动频率相同或相近的基团相邻具有一公共原子时,由于一个键 6
6 红外光谱可分为基频区和指纹区两大区域 (1) 基频区(4000~1350cm −1 )又称为特征区或官能团区,其特征吸收峰可 作为鉴定基团的依据。 X-H 伸缩振动区(4000~2500 cm ) −1 三键及累积双键区(2500~1900 cm ) −1 双键伸缩振动区(1900~1200 cm ) −1 X-H 弯曲振动区(1650~1350 cm ) −1 (2)指纹区(1350~650 cm ) −1 指纹区的吸收峰是由于 c-c,c-0,c-x 单键的伸缩振动以及分子骨架中多数 基团的弯曲振动所引起。 4 影响基团频率位移的因素 分子中各基团的振动并不是孤立的要受到分子中其它部分特别是邻近基团 的影响,这种影响可分为内部因素和外部因素。 4.1 内部因素 (1)诱导效应:吸电子基团使吸收峰向高频方向移动(蓝移)。 R-COR C=O 1715cm-1; R-COH C=O 1730cm -1 ; R-COCl C=O 1800cm-1 ; R-COF C=O 1920cm-1 ; F-COF C=O 1928cm-1 ; R-CONH2 C=O 1920cm-1 (2)共轨效应:轭效应使共轭体系中的电子云密度平均化,结果使原来的双键略有伸长 (即电子云密度降低)、力常数减小,使其吸收频率向低波数方向移动。 (3)氢键作用:氢键的形成使电子云密度平均化,从而使伸缩振动频率降低。 (分子 内氢键;分子间氢键):对峰位,峰强产生极明显影响,使伸缩振动频率向低波数方向移 动。分子内氢键不受浓度影响,分子间氢键受浓度影响较大。 (4)空间效应:场效应;空间位阻;环张力 (5)振动耦合:当两个振动频率相同或相近的基团相邻具有一公共原子时,由于一个键

的振动通过公共原子使另一个键的长度发生改变,产生一个“微扰”,从而形成了强烈的 振动相互作用。其结果是使振动频率发生变化,一个向高频移动,另一个向低频移动, 谱带分裂。振动耦合常出现在一些二羰基化合物中 4.2外部因素 外部因素主要指测定时物质的状态以及溶剂效应等因素。 分子在气态时,其相互作用力很弱,此时可以观察到伴随振动光谱的转动精细结构。 液态和固态分子间作用力较强,在有极性基团存在时,可能发生分子间的缔合或形 成氢键,导致特征吸收带频率、强度和形状有较大的改变。 第二节 红外吸收光谱仪 1红外光谱仪的主要部件 1.1光源 (1)能斯特灯:氧化锆、氧化钇和氧化钍烧结制成的中空或实心圆棒,直径1-3mm 长20-50mm:室温下,非导体,使用前预热到800℃: 特点:发光强度大:寿命0.5一1年: (2)硅碳棒:两端粗,中间细:直径5mm,长20一50mm:不需预热;两端需 用水冷却。 1.2吸收池 因玻璃、石英等材料不能透过红外光,红外吸收池要用可透过红外光的 NaCI、KBr等材料制成窗片。用NaCl、KBr等材料制成的窗片需注意防潮。固 体试样常与纯KB混匀压片,然后直接进行测定。 13单色器单色器由色散元件、准直镜和狭缝构成。 色散元件常用闪耀光栅。由于闪耀光栅存在次级光谱的干扰,因此,需要将 光栅和用来分离次光谱的滤光器或前置棱镜结合起来使用。 1.4检测器常用的红外检测器有高真空热电偶、热电量电计和光电导管三种。 (五)记录系统 2色散型红外吸收光谱仪
7 的振动通过公共原子使另一个键的长度发生改变,产生一个“微扰”,从而形成了强烈的 振动相互作用。其结果是使振动频率发生变化,一个向高频移动,另一个向低频移动, 谱带分裂。振动耦合常出现在一些二羰基化合物中。 4.2 外部因素 外部因素主要指测定时物质的状态以及溶剂效应等因素。 分子在气态时,其相互作用力很弱,此时可以观察到伴随振动光谱的转动精细结构。 液态和固态分子间作用力较强,在有极性基团存在时,可能发生分子间的缔合或形 成氢键,导致特征吸收带频率、强度和形状有较大的改变。 第二节 红外吸收光谱仪 1 红外光谱仪的主要部件 1.1 光源 (1)能斯特灯:氧化锆、氧化钇和氧化钍烧结制成的中空或实心圆棒,直径 1-3 mm, 长 20-50mm;室温下,非导体,使用前预热到 800 ℃; 特点:发光强度大;寿命 0.5-1 年; (2)硅碳棒:两端粗,中间细;直径 5 mm,长 20-50mm;不需预热;两端需 用水冷却。 1.2 吸收池 因玻璃、石英等材料不能透过红外光,红外吸收池要用可透过红外光的 NaCl、KBr 等材料制成窗片。用 NaCl、KBr 等材料制成的窗片需注意防潮。固 体试样常与纯 KBr 混匀压片,然后直接进行测定。 1.3 单色器 单色器由色散元件、准直镜和狭缝构成。 色散元件常用闪耀光栅。由于闪耀光栅存在次级光谱的干扰,因此,需要将 光栅和用来分离次光谱的滤光器或前置棱镜结合起来使用。 1.4 检测器 常用的红外检测器有高真空热电偶、热电量电计和光电导管三种。 (五)记录系统 2 色散型红外吸收光谱仪
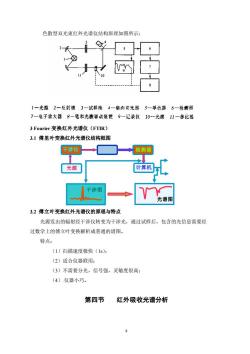
色散型双光束红外光谱仪结构原理如图所示: 6 1一光源2一反射镜3一试样池4一扇向切光器5一单色器6一检测器 7一电子放大器8一笔和光挨繁动装置9一记录仪10一光楔11一参比洒 3 Fourier变换红外光谱仪(FTR) 3.1傅里叶变换红外光谱仪结构框图 干涉仪◆ 检测器 光源 计算机 】干涉图 光谱图 3.2傅立叶变换红外光谱仪的原理与特点 光源发出的辐射经干涉仪转变为干涉光,通过试样后,包含的光信息需要经 过数学上的傅立叶变换解析成普通的谱图。 特点: (1)扫描速度极快(1s): (2)适合仪器联用: (3)不需要分光,信号强,灵敏度很高: (4).仪器小巧。 第四节 红外吸收光谱分析
8 色散型双光束红外光谱仪结构原理如图所示: 3 Fourier 变换红外光谱仪(FTIR) 3.1 傅里叶变换红外光谱仪结构框图 3.2 傅立叶变换红外光谱仪的原理与特点 光源发出的辐射经干涉仪转变为干涉光,通过试样后,包含的光信息需要经 过数学上的傅立叶变换解析成普通的谱图。 特点: (1)扫描速度极快(1s); (2)适合仪器联用; (3)不需要分光,信号强,灵敏度很高; (4).仪器小巧。 第四节 红外吸收光谱分析 干涉仪 光源 样品室 检测器 显示器 绘图仪 计算机 干涉图 光谱图 FTS

1试样的制备 1.1气体—气体池 1.2液体: (1)液膜法 一难挥发液体(BP>>80℃) (2)溶液法—液体池 溶剂:CC4,CS2常用 1.3固体: (1)研糊法(液体石腊法) (2)KBr压片法 (3)薄膜法 2红外吸收光谱分析 红外光谱法广泛用于有机化合物的定性鉴定和结构分析。 2.1己知物的鉴定 将试样的谱图与标准的谱图进行对照,或者与文献上的谱图进行对照。如果两张谱 图各吸收峰的位置和形状完全相同,峰的相对强度一样,就可以认为样品是该种标准物。 如果两张谱图不一样,或峰位不一致,则说明两者不为同一化合物,或样品有杂质。 2.2未知物结构的测定 (1)查阅标准谱图的谱带索引,以寻找试样光谱吸收带相同的标准谱图: (2)进行光谱解析,判断试样的可能结构,然后在由化学分类索引查找标准谱图对照核 实。 (3)图谱解析 谱图的解析至今尚无一定规则。但一般来说可按照“先特征,后指纹;先最强峰.后 次强峰:先粗查.后细找:先否定,后肯定”的程序解析。 (4)图谱解析例 例1某化合物,测得分子式为C8HsO,其红外光谱如下图所示,试推测其结构式
9 1 试样的制备 1.1 气体——气体池 1.2 液体: (1)液膜法——难挥发液体(BP>>80C) (2)溶液法——液体池 溶剂: CCl4,CS2 常用。 1.3 固体: (1)研糊法(液体石腊法) (2)KBr 压片法 (3)薄膜法 2 红外吸收光谱分析 红外光谱法广泛用于有机化合物的定性鉴定和结构分析。 2.1 已知物的鉴定 将试样的谱图与标准的谱图进行对照,或者与文献上的谱图进行对照。如果两张谱 图各吸收峰的位置和形状完全相同,峰的相对强度一样,就可以认为样品是该种标准物。 如果两张谱图不一样,或峰位不一致,则说明两者不为同一化合物,或样品有杂质。 2.2 未知物结构的测定 (1)查阅标准谱图的谱带索引,以寻找试样光谱吸收带相同的标准谱图; (2)进行光谱解析,判断试样的可能结构,然后在由化学分类索引查找标准谱图对照核 实。 (3)图谱解析 谱图的解析至今尚无一定规则。但一般来说可按照 “先特征,后指纹;先最强峰.后 次强峰;先粗查.后细找;先否定,后肯定 ” 的程序解析。 (4)图谱解析例 例 1 某化合物,测得分子式为 C8H8O,其红外光谱如下图所示,试推测其结构式

80 1687V 1363V1265 760 alem C8HsO红外光谱图 解:特征区最强峰1687cm1为C=0的伸缩振动,因分子式中只含一个氧原子。不可能 是酸或酯,只能是醛或酮。1600cml、1580cm'、1450cm1三个峰是苯环的骨架振动: 3000cm1附近的数个弱峰是苯环及CH的C-H伸缩振动:指纹区 760cml、692cml两个吸收峰结合2000-1667cm1的一组泛频蜂说明为单 取代苯。363cml和1430cm1的吸收峰为甲基的C-H弯曲振动。 至此可初步推断该化合物为苯乙酮。 根据:2=1+nu+n3-nm)2 计算其不饱和度为5。 苯乙酮含有苯环及双键,故上述推断合理,进一步与标服谱图对照,证明推断正确 0
10 C8H8O 红外光谱图 解:特征区最强峰 1687cm-1 为 C=O 的伸缩振动,因分子式中只含一个氧原子。不可能 是酸或酯,只能是醛或酮。1600cm-1、1580cm-1、1450cm-1 三个峰是苯环的骨架振动; 3000cm-1 附近的数个弱峰是苯环及 CH3 的 C-H 伸缩振动;指纹区 760cm-1、692cm-1 两个吸收峰结合 2000-1667cm-1 的一组泛频蜂说明为单 取代苯。l363 cm-1 和 1430 cm-1 的吸收峰为甲基的 C-H 弯曲振动。 至此可初步推断该化合物为苯乙酮。 根据: =1+n4+(n3-n1)/2 计算其不饱和度为 5。 苯乙酮含有苯环及双键,故上述推断合理,进一步与标服谱图对照,证明推断正确
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 石河子大学:《仪器分析》课程教学资源(授课教案)高效液相色谱分析法 HPLC.doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)气相色谱分析法 GC.doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(任课教师:李文娟).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)药学分析化学电子教案.doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(2010-2011学年第一学期,授课:齐誉).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教学仪器分析教案(任课教师:洪成林).doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(2010-2011学年第二学期,任课教师:杨红兵).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(2010-2011学年第一学期,任课教师:杨红兵).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(2008-2009学年第二学期,任课教师:杨红兵).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)应化仪器分析教案(任课教师:齐誉).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析实验教案(授课教师:齐誉).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析教案(任课教师:洪成林).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)药学分析化学教案(任课教师:杨红兵).pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)卫生化学教案(任课教师:杨红兵).pdf
- 《仪器分析》课程教学资源(试卷习题)仪器分析复习题仪器分析复习题5(含参考答案).doc
- 《仪器分析》课程教学资源(试卷习题)仪器分析复习题仪器分析复习题4(含参考答案).doc
- 《仪器分析》课程教学资源(试卷习题)仪器分析复习题仪器分析复习题3(含参考答案).doc
- 《仪器分析》课程教学资源(试卷习题)仪器分析复习题仪器分析复习题2(含参考答案).doc
- 《仪器分析》课程教学资源(试卷习题)仪器分析复习题仪器分析复习题1(含参考答案).doc
- 《无机化学》课程教学资源(课堂教学设计)第11章 配位化学基础.pdf
- 石河子大学:《仪器分析》课程教学资源(授课教案)紫外—可见分光光度法 UV.doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)仪器分析概论(任课教师:赵芳).doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)光谱导论(光学分析).doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)色谱概论.doc
- 石河子大学:《仪器分析》课程教学资源(授课教案)荧光分析法.doc
- 石河子大学:《仪器分析》课程教学课件(食品质量与安全)第三章 原子吸收与原子荧光光谱法 Atomic absorption spectrometry, AAS.pdf
- 石河子大学:《仪器分析》课程教学课件(食品质量与安全)第六章 红外分光光度法(Infrared Absorption Spectroscopy,IR).pdf
- 石河子大学:《仪器分析》课程教学课件(食品质量与安全)第十一章 高效液相色谱 High Performance Liquid Chromatography, HPLC.pdf
- 石河子大学:《仪器分析》课程教学课件(食品质量与安全)第四章 紫外—可见分光光度法(ultraviolet and visible spectrophotometry,UV-Vis).pdf
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)分子荧光.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第十章 紫外可见分光光度法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第十七章 气相色谱法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第十六章 色谱分析法概论.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)红外吸收光谱分析.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第一章 绪论 Analytical Chemistry(主讲:洪成林).ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第七章 沉淀滴定法和重量分析法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第三章 滴定分析概述.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第二章 误差和分析数据处理.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第五章 配位滴定法.ppt
- 石河子大学:《仪器分析》课程PPT教学课件(药学仪器分析化学)第四章 酸碱滴定法.ppt
