《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(1/3)

第五章化学平衡 化学平衡是研究化学反应体系的平衡问题: a)化学反应的方向和限度问题 b)各种状态反应的平衡常数表示式 c)各种条件对化学平衡的影响 §5.1化学反应的方向和限度 1.化学反应平衡条件 封闭体系,发生一化学反应: dG=-SdT+VdP+∑μBdhg (W=0) 等T,P,dGn,=∑μBdhB
1 第五章 化学平衡 化学平衡是研究化学反应体系的平衡问题: a)化学反应的方向和限度问题 b)各种状态反应的平衡常数表示式 c)各种条件对化学平衡的影响 §5.1 化学反应的方向和限度 1. 化学反应平衡条件 封闭体系,发生一化学反应: dG= - SdT + VdP + Σ μB dnB (W’=0) 等 T,P,dGT,P =ΣμB dnB

aA dD → gG+hH t=0 na np nG H t=t nA np nG nu 2
2 aA + dD → gG + hH t=0 nA ° nD ° nG ° nH ° t=t nA nD nG nH

定义:反应进度5= nB-nB VB dn dng=vads de= B 等T,P,dGrP=∑μBde=∑YB4gd5 ∂G △,Gm= =∑ya4g ξ)r.P =(gug hun )-(aus +dup) △Gm:等TP反应的自由能随反应进度5的变化 或当dξ=lmol时,引起反应自由能的变化
3 定义:反应进度 B nB nB − = dn d dn d B B B B = , = 等 T,P,dGT,P =Σ μB dnB = B B d = = B B T P r m G G , ( ) ( ) = g G + h H − a A + d D r Gm :等 T,P 反应的自由能随反应进度 的变化 或当d = 1mol 时,引起反应自由能的变化

当△,Gnm0,(g4G+h4H)>(a4A+d4n) 产物化学势高,反应不能自发进行° 当△Gm=0,产物与反应物化学势相等, 体系达平衡或可逆过程
4 当r Gm 0,( ) ( ) g G + h H a A + d D 反应物化学势高,反应向右进行自发反应 当r Gm 0,( ) ( ) g G + h H a A + d D 产物化学势高,反应不能自发进行 当r Gm = 0,产物与反应物化学势相等, 体系达平衡或可逆过程

化学反应的平衡条件: 等1P下,△Gm= =∑yB4B≤0 ∑YB4B<0,自发进行 ∑yB4B=0,平衡,可逆 说明:V反应计量系数,产物为“+”, 反应物为“_” 5
5 化学反应的平衡条件: 等 T,P下 , = = B B T P r m G G , ≤0 B B 0,自发进行 B B = 0,平衡,可逆 说明:νB反应计量系数,产物为“+”, 反应物为“-

2.化学反应的自由能降低原理 封闭系,W=0,化学反应 D E t=0 Ep ne t=t np npnp°-5 由集合公式:G=∑μBg G=npμD+nELE =(μn”+RTLnp9 )+(,+m年
6 2.化学反应的自由能降低原理 封闭系,W’=0,化学反应 D → E t=0 nD ° nE ° t=t nD nD = nD °- 由集合公式:G=ΣμB nB G=nDμD +nEμE =nD (μD °+ RTLn P PD )+ nE (μE °+ RTLn P PE )
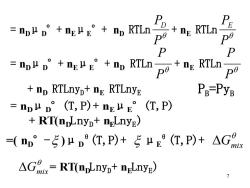
=D+nE丛g°+o RTinp9 E P =n业v'+E丛E°+n RTLnp9+n:RTLnp9 nD RTLnyp+nE RTLnyE Pa-PyB =nDμD°(T,P)+nEμE°(T,P) RT(npLnyp+neLnyE) (nn°-5)μD(T,P)+5LE°(T,P)+AG AG=RT(mpLnyp+ngLnye) 7
7 = nD μD °+ nE μE °+ nD RTLn P PD + nE RTLn P PE = nD μD °+ nE μE °+ nD RTLn P P + nE RTLn P P + nD RTLnyD + nE RTLnyE = nD μD °(T,P)+ nE μE °(T,P) + RT(nD LnyD + nE LnyE ) =( nD °- )μD θ(T,P)+ μE θ(T,P)+ Gmix Gmix= RT(nD LnyD + nE LnyE ) PB =PyB

设n,°=lmo1 G=uD°+5IuE°-μn]+△G G一5作图 G E m 0 1 8
8 设 nD °=1mol G=μD θ+ [μE θ - μD θ] + Gmix G— 作图

若没有AGx,μ上<μn°产物自由能最低 实际存在AGmr0(yn<1,y<1) aG 利用 =0,可求出最低点m的专 ag) T.P 说明:a)自由能最低点不是产物E,而是在 =0 ag b)平衡时,反应物和产物都存在 c)△G的存在,使体系的自由能降低 9
9 若没有 Gmix,μE θ<μD θ 产物自由能最低 实际存在 Gmix<0 (yD <1, yE <1) 利用 0 , = T P G ,可求出最低点 m的 说明:a)自由能最低点不是产物 E,而是在 0 , = T P G b)平衡时,反应物和产物都存在 c) Gmix的存在,使体系的自由能降低

d)物理意义: 在无限大量的体系中发生一个 单位反应的自由能增量 fD化学反应的方向:∑y4a≤0 ∂G 化学反应的限度: =0时, T.P 产率最大 10
10 d)物理意义:在无限大量的体系中发生一个 单位反应的自由能增量 f)化学反应的方向: B B ≤0 化学反应的限度: 0 , = T P G 时, 产率最大
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(4/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(3/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(2/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(1/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,3/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,2/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,1/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(3/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(2/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(1/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,5/5).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,4/5).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(9/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(8/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(7/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(6/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(5/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(4/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(3/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(2/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(2/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(3/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,1/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,2/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,3/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,4/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,5/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,7/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(1/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,8/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,9/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(2/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(3/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(4/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(5/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(6/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(7/17)第七章 基元反应的速率理论 §7-1 简单碰撞理论(1918).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 基元反应的速率理论 §7-2 过渡态理论(活化络合物理论)、§7-3 阿氏公式与两速率理论比较.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,1/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,2/7).ppt
