《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,4/9)
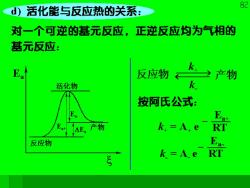
82 d)活化能与反应热的关系: 对一个可逆的基元反应,正逆反应均为气相的 基元反应: 反应物 k之产物 活化物 按阿氏公式: 产物 k,=A.e RT 反应物 k=A e

8. 对于正反应,吸收Ea+【 的活化能变成活化分子, 反应生成产物,放出E的能量: 对于逆反应,吸收E的能量成为活化物后, 生成“反应物?放出Ea+的能量。 由反应物→产物,放出能量为△Ea。 △Ea=Ea+-Ea 由于活化能多数为正值,所以△E,的符号要看 正逆反应活化能的大小及反应进行的方向来确 定。这里的Ea,Ea+,Ea:,△E,的下标a表示 活化能,并无体系状态的意义,也就是没有考 虑等容或等压条件

84 下面对△E,的状态条件加以讨论: 基元气相反应: A+B C+D 对于气相反应,以P表示反应物浓度,则有 Tpt=kp+PAPB Tp.=kp-PcPD, 当反应达平衡时, r=r. 即 Ap+PAPB=Kp-PCPD:

PePD 85 = PAPB Kp=K8, Kg,以1atm.为标准的平衡常数, Kp=K.(2)。(aa) Vant-Hof公式: 把以上Kg代入, (2=)。(2),=

86 阿氏微分式: (2←),(2),=- 比较之后得: EP:-EP.-A,H=Qp 为等压平衡常数与反应热Q, 的关系,此时 △Ea=Qp=AH

87 若以C:表示反应物、产物浓度,反应过程中 体积不变, Tc+=kc+CACB:kc+=Acte 。CCe=Ae是 平衡时:r=r kcy CcCD ke. CACB -Kc-Ke,Kc=ke (C)av

88 〔K入、(h 等容条件下的Vant-Hoff公式为 4 R 2-=器-导 RT2 Ec+-Ec.=△Ut=Qv

89 对于气相反应: 若以P,为浓标时,△E,=△Ep=Qp=AH 若以C:为浓标时,AE,=AEc=Qv=△U 对于溶液相反应: (。- 阿氏公式是从研究液相反应而来,习惯 于用C作为浓标。 △E,=△U=Qy,Ea=Ec,k=ke

90 所以,推至气相反应亦是如此,即一般 没有特殊说明,E是指E。, AEa=△Ua=Q 除非特别指明用P为浓标,k为k,时, 阿氏活化能才可以认为是E。,△Ea为Q, 没有特指时,△E,都为△U即Q

91 )复杂反应的表观活化能与表观指前因子 阿氏的结果是从实验推出的,对基元反应, 复杂反应都适用,只要把速率方程归纳为 r=kC,C.的形式,则其k可写成阿氏 公式形式。 从以上基元反应的讨论中,对A、E都给 出了明确的物理意义,在复杂反应中A、E, 是由多个基元反应构成的,把E,叫做表观 活化能,A叫做表观指前因子,表观活 化能与基元反应的活化能的关系由反应机 理决定
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,3/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,2/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,1/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(3/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(2/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(1/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(4/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(3/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(2/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(1/4).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,3/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,2/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 溶液——多组分体系热力学(热力学在多组分体系中的应用,1/3).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(3/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(2/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(1/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,5/5).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,4/5).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(9/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(8/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,5/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,7/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(1/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,8/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(图片版,9/9).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(2/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(3/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(4/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(5/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(6/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学动力学基础(7/17)第七章 基元反应的速率理论 §7-1 简单碰撞理论(1918).ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 基元反应的速率理论 §7-2 过渡态理论(活化络合物理论)、§7-3 阿氏公式与两速率理论比较.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,1/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,2/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,3/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,4/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,5/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,6/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(图片版,7/7).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(1/6).ppt
