《无机化学》课程PPT教学课件(大连理工版)ch8 原子结构

第二篇 物质结构基础 第八章原子结构 §8.1原子结构的Bohr理论 §8.2散观粒子适动的基本特征 §8.3 氨原子猪构的 量子力学描述 §8.4多电子原子结构 §8.5元素周期表 §8.6元素性质的周期性 回
§8.1 原子结构的Bohr理论 §8.2 微观粒子运动的基本特征 §8.3 氢原子结构的 量子力学描述 第八章 原子结构 §8.4 多电子原子结构 §8.5 元素周期表 §8.6 元素性质的周期性 第二篇 物质结构基础

§8.1原子猪构的Bohr理论 >8.1.1 历史的回顾 >8.1.2 氢原子光谱 >8.1.3Bohr原子结构理论 返回
8.1.1 历史的回顾 8.1.3 Bohr原子结构理论 8.1.2 氢原子光谱 §8.1 原子结构的Bohr理论

8.1.1历史的回顾 Dalton原子学说 0 (1803年) e Thomson西瓜式”模型 (1904年) Rutherford核式模型 无机化学电子救 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)
8.1.1 历史的回顾 Dalton原子学说 (1803年) Thomson“西瓜式”模型 (1904年) Rutherford核式模型 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)

8.1.2 氢原子光谱 1.光和电磁辐射 /m10 102 104 106 10 10-10 10-12 10-14 无 TV 外 电 微波 见 荞 波 线 线 3×108 3×1010 3×1012 3×101 3×1016 3×1018 3×1020 3×1022 60u 500 70 红 橙 黄绿 青蓝 紫 5×1014 6×1014 7×1014
1.光和电磁辐射 8.1.2 氢原子光谱 红 橙 黄 绿 青 蓝 紫
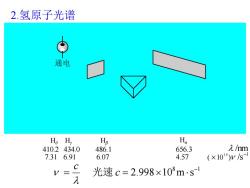
2.氢原子光谱 通电 H5 H, Hg Ha 410.2434.0 486.1 656.3 入/m 7.31 6.91 6.07 4.57 (×1014)ys C V= 光速c=2.998×108ms1 λ
2.氢原子光谱 8 1 2.998 10 m s − = c = c 光速 Hα 656.3 4.57 Hβ 486.1 6.07 Hγ 434.0 6.91 Hδ 410.2 7.31 /nm1 ( 10 ) /s 1 4 −

氢原子光谱特征: ·不连续光谱,即线状光谱 ·其频率具有一定的规律 经验公式: 无机化学电子 =32×10分-s n=3,4,5,6 式中2,n,3.289×1015各代表什么意义? 闲
• 不连续光谱,即线状光谱 • 其频率具有一定的规律 1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n= 3,4,5,6 式中 2,n,3.289×1015各代表什么意义? 经验公式: 氢原子光谱特征:

8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 无机化学电子教 E=hy E一光子的能量 y一光的频率 h—Planck常量,h=6.626×10-34Js
8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 E=hν E—光子的能量 ν—光的频率 h—Planck常量, h =6.626×10-34J·s

Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低一基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态: 无机化学电子教 ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 hv=E2-E E:轨道能量 E2-E v= h
Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低——基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态; ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 h E E h E E 2 1 2 1 − = = − E:轨道能量

原子能级 -6.05×10-20J -8.72×10-20J -1.36×1019J Brackett线系 -2.42×10-19J n=3 Paschen线系 -5.45×1019J n-2 H 无机化学电子款 Ha Balmer线系 -2.179×10-18J 1=1 Lyman线系
原子能级

Balmer线系 =328910 n=3红(H) n=4青(Hg) n=5蓝紫(H,) 无机化学电子款 n=6紫(H,) 其它线系 =3289×105(- 1 )s-1 n2>n1
1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n = 3 红(Hα) n = 4 青(Hβ ) n = 5 蓝紫 ( Hγ ) n = 6 紫(Hδ ) Balmer线系 其它线系 -1 2 2 2 1 15 )s 1 1 3.289 10 ( n n v = − n2 n1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(大连理工版)ch7 氧化还原平衡、电化学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch6 沉淀-溶解平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch5 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch4 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch3 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch2 热化学.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch1 理想气体(石河子大学:周娜).ppt
- 《无机化学》课程PPT教学课件(G)第8章 子龙-配位化合物.ppt
- 《无机化学》课程PPT教学课件(G)第7章 共价健和分子间力.ppt
- 《无机化学》课程PPT教学课件(G)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(G)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(G)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(G)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(G)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(G)第1章 无机计量关系(石河子大学:刘子龙).ppt
- 《普通化学》课程PPT教学课件(F)第四章 电化学与金属腐蚀.ppt
- 《普通化学》课程PPT教学课件(F)第六章 元素化学与无机材料.ppt
- 《普通化学》课程PPT教学课件(F)第二章 化学反应基本原理.ppt
- 《普通化学》课程PPT教学课件(F)第三章 水化学.ppt
- 《普通化学》课程PPT教学课件(F)第一章 普通化学绪论.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch10 固体结构.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch11 配位化合物(配合物结构).ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch9 分子结构.ppt
- 新疆大学:《结构化学》课程教学资源(综合试题,无答案).pdf
- 《结构化学基础》课程教学资源(PPT课件)绪论、第一章 量子力学基础 1.1 微观粒子运动特征(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.2 量子力学基本假设(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.3 箱中粒子的Schrodinger方程及其解(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.1 单电子原子Schrodinger方程及其解 2.2 量子数的物理意义(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.3 波函数和电子云图 2.4 多电子原子结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.5 元素周期表与元素周期性质 2.6 原子光谱和光谱项(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.1 化学键概述 3.2 H2+的结构和共价键的本质 3.3 分子轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 3.4 价键理论(VB)(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性1/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性2/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.1 价电子对互斥理论 5.2 杂化轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.5 离域键和共轭效应 5.6 分子轨道的对称性和反应机理 5.7 硼烷和有关化合物的结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质1/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质2/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质3/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第8章 金属晶体的结构(推荐使用幻灯片放映).pptx
