《无机化学》课程PPT教学课件(大连理工版)ch7 氧化还原平衡、电化学基础

第七章 氧化还原反应电化学基础 §7.1氧化还原反寇的基本橇念 ק7.2电化学电他 ק7.3电极电势 ק7.4电极电势的寇用 回
第七章 氧化还原反应 电化学基础 §7.1 氧化还原反应的基本概念 §7.2 电化学电池 §7.3 电极电势 §7.4 电极电势的应用

§7.1氧化还原友寇的基本橇念 7.1.1 氧化值 3>7.1.2 氧化还原反应方程式的配平 返回
§ 7.1 氧化还原反应的基本概念 7.1.1 氧化值 7.1.2 氧化还原反应方程式的配平

7.1.1 氧化值 有电子得失或电子转移的反应,被称 为氧化还原反应。 Cu2(aq)+Zn(s)-Zn2*(aq)+Cu(s) 得失电子 H2(g)+C12g)=2HC1g) 电子偏移 无机化学电子 氧化值:是指某元素的一个原子的荷电 数,该荷电数是假定把每一化学键中的电子 指定给电负性更大的原子而求得的
7.1.1 氧化值 氧化值:是指某元素的一个原子的荷电 数,该荷电数是假定把每一化学键中的电子 指定给电负性更大的原子而求得的。 有电子得失或电子转移的反应,被称 为氧化还原反应。 Cu (aq) Zn(s) Zn (aq) Cu(s) 2 2 + + 得失电子 + + H2 (g)+Cl2(g) 2HCl(g) 电子偏移

确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于 该离子所带的电荷数 。 ③在大多数化合物中,氢的氧化值为+1: 只有在金属氢化物中氢的氧化值为-1。 初 ④通常,氧在化合物中的氧化值为-2; 化学电子 但是在过氧化物中,氧的氧化值为-1,在氟 的氧化物中,如OF2和OF2中,氧的氧化值 分别为+2和+1
确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于 该离子所带的电荷数 。 ③在大多数化合物中,氢的氧化值为 +1; 只有在金属氢化物中氢的氧化值为 -1。 ④通常,氧在化合物中的氧化值为-2; 但是在过氧化物中,氧的氧化值为-1,在氟 的氧化物中,如OF2 和O2F2中,氧的氧化值 分别为+2和+1

⑤中性分子中,各元素原子的氧化值的 代数和为零,复杂离子的电荷等于各元 素氧化值的代数和。 例: H.IO I的氧化值为+7 S203 S的氧化值为+2 无机化学电子救 S403 S的氧化值为+2.5 8 Fe;Oa Fe的氧化值为+ 3
例: H5 I O6 I的氧化值为+ 7 ⑤中性分子中,各元素原子的氧化值的 代数和为零 ,复杂离子的电荷等于各元 素氧化值的代数和。 3 8 Fe O Fe 3 4 的氧化值为+ S O S 2.5 2 4 6 + − 的氧化值为 S O S 2 2 2 3 + − 的氧化值为

7.1.2 氧化还原反应方程式的配平 配平原则: ①电荷守恒:氧化剂得电子数等于 还原剂失电子数。 无机化学电子教菜 ②质量守恒:反应前后各元素原子 总数相等
配平原则: ① 电荷守恒:氧化剂得电子数等于 还原剂失电子数。 ② 质量守恒:反应前后各元素原子 总数相等。 7.1.2 氧化还原反应方程式的配平

配平步骤: ①用离子式写出主要反应物和产物(气 体、纯液体、固体和弱电解质则写分子式): ②分别写出氧化剂被还原和还原剂被氧 化的半反应。 ③分别配平两个半反应方程式,等号两 无机化学电子款 边的各种元素的原子总数各自相等且电荷数 相等
配平步骤: ①用离子式写出主要反应物和产物(气 体、纯液体、固体和弱电解质则写分子式)。 ②分别写出氧化剂被还原和还原剂被氧 化的半反应。 ③分别配平两个半反应方程式,等号两 边的各种元素的原子总数各自相等且电荷数 相等

④确定两半反应方程式得、失电子数目 的最小公倍数。将两个半反应方程式中各项 分别乘以相应的系数,使得、失电子数目相 同。然后,将两者合并,就得到了配平的氧 化还原反应的离子方程式。有时根据需要可 将其改为分子方程式。 无机化学电子教 例1:配平反应方程式 KMnO(aq)+K2SO3 (aq) 酸性溶液中MnSO,(aq)+K,SO4(aq)
例1:配平反应方程式 MnSO (aq) K SO (aq) KMnO (aq) K SO (aq) 4 2 4 酸性溶液中 4 2 3 ⎯⎯ ⎯→ + + ④确定两半反应方程式得、失电子数目 的最小公倍数。将两个半反应方程式中各项 分别乘以相应的系数,使得、失电子数目相 同。然后,将两者合并,就得到了配平的氧 化还原反应的离子方程式。有时根据需要可 将其改为分子方程式
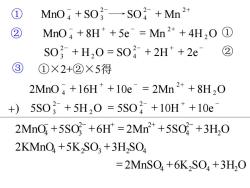
① MnO4+S03一→S0+Mn2+ MnO+8H*+5e Mn2*+4H,O1 S03+H20=S0+2H+2e ③ ①×2+②×5得 2Mn04+16H++10e=2Mn2++8H20 +) 5S03+5H20=5S0+10H++10e 2MnO,+5SO +6H*2Mn2*+5S0+3H,O 2KMnO+5K2SO3 +3H2SO =2MnS04+6K,S04+3H0
+) 2 4 − − + − 5SO + 5H O = 5SO + 10H +10e 2 2 3 − + − + 2MnO + 16H + 10e = 2Mn + 8H 2O 2 4 − + − + ② MnO + 8H + 5e = Mn + 4H 2O 2 4 ① − − + − SO + H O = SO + 2H + 2e 2 2 4 2 3 ② ③ ①×2+②×5得 = 2MnSO4 +6K2SO4 +3H2O 2MnO 5SO 6H 2Mn 5SO 3H2O 2 4 2 2 4 3 + + = + + − − + + − − − − + ① MnO + SO SO + Mn 2 2 4 2 4 3 2KMnO4 5K SO3 3H SO2 4 + + 2

例2:配平 C1,(g)+NaOH(aq)->NaCl(aq)+NaCIO(aq) 解:Cl,+2e=2C1 ① C12+120H=2C10;+6H,0+10e② ①×5+②得: 6C1,+120H=10C1+2C103+6H20 化简得: 3C12+60H=5C1+C103+3H,0 3C1,+6NaOH=5NaCl+NaCIO3 +3H2O
例 2 :配平 Cl (g) NaOH(aq) NaCl(aq) NaClO (aq) 3 Δ 2 + ⎯→ + ① ×5+ ②得: ①② 3Cl 2 + 6NaOH = 5NaCl + NaClO 3 + 3H 2 O 3Cl 2 + 6OH = 5Cl + ClO 3 + 3H 2 O − − − 6Cl 2 +12OH = 10Cl + 2ClO 3 + 6H 2 O − − − − − − Cl +12OH = 2ClO + 6H O +10e 2 3 2 − − Cl + 2e = 2Cl 解: 2 化简得:
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(大连理工版)ch6 沉淀-溶解平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch5 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch4 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch3 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch2 热化学.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch1 理想气体(石河子大学:周娜).ppt
- 《无机化学》课程PPT教学课件(G)第8章 子龙-配位化合物.ppt
- 《无机化学》课程PPT教学课件(G)第7章 共价健和分子间力.ppt
- 《无机化学》课程PPT教学课件(G)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(G)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(G)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(G)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(G)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(G)第1章 无机计量关系(石河子大学:刘子龙).ppt
- 《普通化学》课程PPT教学课件(F)第四章 电化学与金属腐蚀.ppt
- 《普通化学》课程PPT教学课件(F)第六章 元素化学与无机材料.ppt
- 《普通化学》课程PPT教学课件(F)第二章 化学反应基本原理.ppt
- 《普通化学》课程PPT教学课件(F)第三章 水化学.ppt
- 《普通化学》课程PPT教学课件(F)第一章 普通化学绪论.ppt
- 《无机化学》课程PPT教学课件(E)第9章 氧化还原与电极电位(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch8 原子结构.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch10 固体结构.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch11 配位化合物(配合物结构).ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch9 分子结构.ppt
- 新疆大学:《结构化学》课程教学资源(综合试题,无答案).pdf
- 《结构化学基础》课程教学资源(PPT课件)绪论、第一章 量子力学基础 1.1 微观粒子运动特征(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.2 量子力学基本假设(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.3 箱中粒子的Schrodinger方程及其解(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.1 单电子原子Schrodinger方程及其解 2.2 量子数的物理意义(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.3 波函数和电子云图 2.4 多电子原子结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.5 元素周期表与元素周期性质 2.6 原子光谱和光谱项(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.1 化学键概述 3.2 H2+的结构和共价键的本质 3.3 分子轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 3.4 价键理论(VB)(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性1/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性2/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.1 价电子对互斥理论 5.2 杂化轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.5 离域键和共轭效应 5.6 分子轨道的对称性和反应机理 5.7 硼烷和有关化合物的结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质1/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质2/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质3/3(推荐使用幻灯片放映).pptx
