《无机化学》课程PPT教学课件(大连理工版)ch11 配位化合物(配合物结构)

第十一章配合物结构 ק11.1配合物的空门构型、 异构现象和磁性 ק11.2配合物的化学健理论 返回
第十一章 配合物结构 §11.2 配合物的化学键理论 §11.1 配合物的空间构型、 异构现象和磁性

§11.1 配合物的空间构型、 异构现象和磁性 >11.1.1 配合物的空间构型 >11.1.2 配合物的异构现象 11.1.3 配合物的磁性 回
§11.1 配合物的空间构型、 异构现象和磁性 11.1.2 配合物的异构现象 11.1.1 配合物的空间构型 11.1.3 配合物的磁性

11.1.1 配合物的空间构型 配合物分子或离子的空间构型与配位数 的多少密切相关。 配位数2 无机化学电子教 空间构型 直线形 四面体平面正方形八面体 例AgNH)片NiCI?Ni(CN)}Fe(CN)g
配合物分子或离子的空间构型与配位数 的多少密切相关。 直线形 四面体 平面正方形 八面体 配位数 2 4 6 例 + 3 2 Ag(NH ) 2− NiCl 4 2− 4 Ni(CN) 3− Fe(CN)6 11.1.1 配合物的空间构型 空 间 构 型
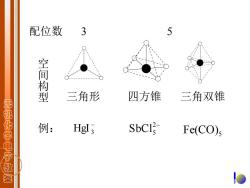
配位数 3 空间构型 三角形 四方锥 三角双锥 无机化学电子救 例: Hgl3 SbCI Fe(CO)s D
例: − HgI 3 2− SbCl5 Fe(CO)5 三角形 四方锥 三角双锥 配位数 3 5 空 间 构 型

E 11.1.2 配合物的异构现象 1.几何异构现象: 按照配体对于中心离子的不同位置区分。 cis-[PtCl2(NH3)2] 顺式 (a) 棕黄色,极性分子 无机化学电子 trans-[PtCl2(NH3)2] (b) 反式 淡黄色,非极性分子 闲 顺式P(Ⅱ)配合物显示治癌活性
11.1.2 配合物的异构现象 1.几何异构现象: 按照配体对于中心离子的不同位置区分。 顺式 棕黄色,极性分子 反式 淡黄色,非极性分子 顺式Pt(Ⅱ)配合物显示治癌活性。 cis-[PtCl2 (NH3 )2 ] trans-[PtCl2 (NH3 )2 ]

思考: ①配位数为4的正四面体结构的配位 化合物是否有顺、反异构体? ②配位数为6的八面体结构的配位化 无机化学电子救 合物是否有顺、反异构体?
思考: ① 配位数为4的正四面体结构的配位 化合物是否有顺、反异构体? ② 配位数为6的八面体结构的配位化 合物是否有顺、反异构体?
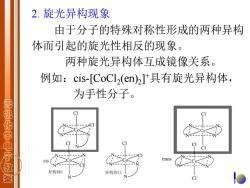
2.旋光异构现象 由于分子的特殊对称性形成的两种异构 体而引起的旋光性相反的现象。 两种旋光异构体互成镜像关系。 例如:cis-[CoCl2(en)2]具有旋光异构体, 为手性分子。 无机化学电子救 cis trans 异构体I 异构体山
2. 旋光异构现象 由于分子的特殊对称性形成的两种异构 体而引起的旋光性相反的现象。 两种旋光异构体互成镜像关系。 例如:cis-[CoCl2 (en)2 ] +具有旋光异构体, 为手性分子

11.1.3配合物的磁性 磁 性:物质在磁场中表现出来的性质。 磁矩:u=√nn+2)(B.M)玻尔磁子 n一未成对电子数 顺磁性: 被磁场吸引4>0,n>0。 无机化学电子 例:O2,NO,NO2 反磁性:被磁场排斥u=0,n=0。例:H2,N2 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni
11.1.3 配合物的磁性 n — 未成对电子数 顺磁性:被磁场吸引 µ > 0 , n > 0 。 例:O2,NO,NO2 反磁性:被磁场排斥 µ = 0 , n =0。例:H2 ,N2 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 磁 性:物质在磁场中表现出来的性质。 磁 矩: = n(n+ 2) (B.M.)玻尔磁子

根据u=Vn(n+2)可用未成对电子 数目n估算磁矩u。 n 0 2 3 4 5 u/B.M. 01.732.833.87 4.905.92 羞 实例: 化学电 [Ti(H2O)6]3+ Ti3+: 3d1 u=1.73 n=1 K3[Mn(CN)] Mn3+: 3d4 u=3.18 n=2 数 K3[Fe(CN)] Fe3+: 3d5 w=2.40 n=1
n 0 1 2 3 4 5 µ/B.M. 0 1.73 2.83 3.87 4.90 5.92 实例: [Ti(H2O)6 ] 3+ Ti3+: 3d1 µ =1.73 n=1 K3 [Mn(CN)6 ] Mn3+: 3d4 µ =3.18 n=2 K3 [Fe(CN)6 ] Fe3+: 3d5 µ =2.40 n=1 根据 = n(n+ 2) 可用未成对电子 数目n估算磁矩µ

§11.2配合物的化学候理论 11.2.1 价键理论 11.2.2 晶体场理论 *11.2.3 分子轨道理论 回
§11.2 配合物的化学键理论 11.2.1 价键理论 11.2.2 晶体场理论 *11.2.3 分子轨道理论
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(大连理工版)ch10 固体结构.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch8 原子结构.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch7 氧化还原平衡、电化学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch6 沉淀-溶解平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch5 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch4 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch3 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch2 热化学.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch1 理想气体(石河子大学:周娜).ppt
- 《无机化学》课程PPT教学课件(G)第8章 子龙-配位化合物.ppt
- 《无机化学》课程PPT教学课件(G)第7章 共价健和分子间力.ppt
- 《无机化学》课程PPT教学课件(G)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(G)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(G)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(G)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(G)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(G)第1章 无机计量关系(石河子大学:刘子龙).ppt
- 《普通化学》课程PPT教学课件(F)第四章 电化学与金属腐蚀.ppt
- 《普通化学》课程PPT教学课件(F)第六章 元素化学与无机材料.ppt
- 《普通化学》课程PPT教学课件(F)第二章 化学反应基本原理.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch9 分子结构.ppt
- 新疆大学:《结构化学》课程教学资源(综合试题,无答案).pdf
- 《结构化学基础》课程教学资源(PPT课件)绪论、第一章 量子力学基础 1.1 微观粒子运动特征(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.2 量子力学基本假设(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第一章 量子力学基础 1.3 箱中粒子的Schrodinger方程及其解(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.1 单电子原子Schrodinger方程及其解 2.2 量子数的物理意义(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.3 波函数和电子云图 2.4 多电子原子结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第二章 原子的结构和性质 2.5 元素周期表与元素周期性质 2.6 原子光谱和光谱项(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.1 化学键概述 3.2 H2+的结构和共价键的本质 3.3 分子轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第三章 共价键和双原子分子的结构 3.3 MO理论和双原子分子的结构 3.4 价键理论(VB)(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性1/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第4章 分子的对称性2/2(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.1 价电子对互斥理论 5.2 杂化轨道理论(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第5章 多原子分子中的化学键 5.5 离域键和共轭效应 5.6 分子轨道的对称性和反应机理 5.7 硼烷和有关化合物的结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质1/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质2/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第7章 晶体的结构和性质3/3(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第8章 金属晶体的结构(推荐使用幻灯片放映).pptx
- 《结构化学基础》课程教学资源(PPT课件)第9章 离子晶体的结构(推荐使用幻灯片放映).pptx
- 新疆大学:《分析化学》课程教学资源(教案讲义)第一章 绪论.doc
