内蒙古大学:《分析化学》课程教学资源(PPT课件)第九章 红外光谱分析 第一节 红外基本原理

第九章 概述 红外吸收光 二、红外光谱与有机 化合物结构 谱分析法 三、分子中基团的基 本振动形式 第一节 四、影响峰位变化的 红外光谱分析 因素 基本原理 下页 帽財 越回
第九章 红外吸收光 谱分析法 一、概述 二、红外光谱与有机 化合物结构 三、分子中基团的基 本振动形式 四、影响峰位变化的 因素 第一节 红外光谱分析 基本原理

、 概述 分子中基团的振动和转动能级跃迁产生:振-转光谱 高 频率V 低 1 能量 化学健断裂 电子低迁 振动跃迁 片动概迁原子候自钳青赶 V"=0 无线 x射线 紫外 红外 微波 电波 射频区 3 纯电子 IR R 跃迁 紫外 可见 振动红外 核磁共振 ”=0 154 5m 纯转动 纯振动 200nm 400nm 800nm2.5μ 试土 联迁 W'=0 短 波长A 长 光波谱区及能量跃迁相关图 双原子分子的三种能级跃迁示意图 页 下页 返回
分子中基团的振动和转动能级跃迁产生:振-转光谱 一、概述

3 5 B E2 3 2 V=0 0 谐振子(a)及非谐振子(b)的势能曲线 上页 下页返回
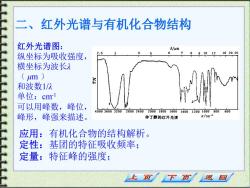
二、 红外光谱与有机化合物结构 红外光谱图: 纵坐标为吸收强度, .5 91012 162025 横坐标为波长入 (m) 和波数1/入 单位:cml 可以用峰数,峰位, 40003600320028002400200018001600140012001000800 600 峰形,峰强来描述。 仲丁醇的红外光谱 应用:有机化合物的结构解析。 定性:基团的特征吸收频率; 定量:特征峰的强度; 上页 下页 返回
红外光谱图: 纵坐标为吸收强度, 横坐标为波长λ ( μm ) 和波数1/λ 单位:cm-1 可以用峰数,峰位, 峰形,峰强来描述。 应用:有机化合物的结构解析。 定性:基团的特征吸收频率; 定量:特征峰的强度; 二、红外光谱与有机化合物结构
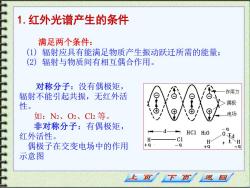
1.红外光谱产生的条件 满足两个条件: (1) 辐射应具有能满足物质产生振动跃迁所需的能量; (2) 辐射与物质间有相互偶合作用。 对称分子:没有偶极矩, 作用力 辐射不能引起共振,无红外活 性。 偶极 如:N2、O2、C12等。 电场 非对称分子:有偶极矩, 红外活性。 HC1 H2O C1 H H 偶极子在交变电场中的作用 -q +a +q 示意图 止页 下页 返回
1.红外光谱产生的条件 满足两个条件: (1) 辐射应具有能满足物质产生振动跃迁所需的能量; (2) 辐射与物质间有相互偶合作用。 对称分子:没有偶极矩, 辐射不能引起共振,无红外活 性。 如:N2、O2、Cl2 等。 非对称分子:有偶极矩, 红外活性。 偶极子在交变电场中的作用 示意图

2.分子振动方程式 ()双原子分子的简谐振动及其频率 化学键的振动类似于连接两个小球的弹簧 虎克定律 1 1=01m2 000000000000 V= 2π 孤1十2 分子的振动能级(量子化): E振=(V+l/2)hy V:化学键的振动频率; :振动量子数。 上页 下页 返回
2. 分子振动方程式 分子的振动能级(量子化): E振=(V+1/2)h V :化学键的 振动频率; :振动量子数。 (1) 双原子分子的简谐振动及其频率 化学键的振动类似于连接两个小球的弹簧

(2) 分子振动方程式 任意两个相邻的能级间的能量差为: △E=hy= 2π k 2πC =1307, K化学键的力常数,与键能和键长有关, u为双原子的折合质量μ=m1m/(m+m2) 发生振动能级跃迁需要能量的大小取决于键两端原子的 折合质量和键的力常数,即取决于分子的结构特征。 下页 返回
(2) 分子振动方程式 任意两个相邻的能级间的能量差为: k k c h k E h 1307 2 1 1 2 = = = = = K化学键的力常数,与键能和键长有关, 为双原子的折合质量 =m1m2 /(m1+m2) 发生振动能级跃迁需要能量的大小取决于键两端原子的 折合质量和键的力常数,即取决于分子的结构特征

表 某些键的伸缩力常数 (毫达因埃) 键 分子 k 键 分子 k F H- HF 9.7 H-C CH2-CH2 5.1 H-C1 1 4.8 H-C CH≡CH 5.9 H-Br Br 4.1 C-Cl CH:Cl 3.4 H- H 3.2 C-C 4.5w5.6 H- 0 H20 7.8 C-C 9.5m9.9 H-S H2S 4.3 C=C 15w17 H-N NH3 6.5 C-0 12~13 H-C CHaX 4.7w5.0 C=0 16m18 键类型: C≡C C=C- > -CC 力常数: 15~17 9.59.9 4.5≈5.6 峰位: 4.5μm 6.0um 7.0m 化学键键强越强(即键的力常数越大)原子折合质量 越小,化学键的振动频率越大,吸收峰将出现在高波数区。 回
表 某些键的伸缩力常数(毫达因/埃) 键类型: —CC — > —C =C — > —C — C — 力常数: 15 17 9.5 9.9 4.5 5.6 峰位: 4.5m 6.0 m 7.0 m 化学键键强越强(即键的力常数K越大)原子折合质量 越小,化学键的振动频率越大,吸收峰将出现在高波数区

例题:由表中查知C=C键的k=9.5~9.9,令其为9.6, 计算波数值 =1307 =1307 9.6 =1650cm-1 12/2 正己烯中C=C键伸缩振动频率实测值为1652cm1 下页 返回
例题: 由表中查知C=C键的k=9.5 9.9 ,令其为9.6, 计算波数值 正己烯中C=C键伸缩振动频率实测值为1652 cm-1 1 1650cm 12 / 2 9.6 1307 1307 2 1 1 − = = = = = k k c v
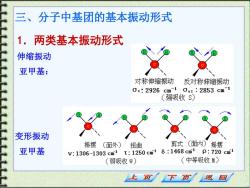
三、分子中基团的基本振动形式 1.两类基本振动形式 伸缩振动 亚甲基: 对称伸缩振动 反对称伸缩振动 0s:2926cm10as:2853cm-1 (强吸收S) 变形振动 摇摆(面外)扭曲 剪式(面内)摇摆 亚甲基 v:1306-1303cm1T:1250cm1δ:1468cm1p:720cm1 (弱吸收W) (中等吸收M) 下页 返回
三、分子中基团的基本振动形式 1.两类基本振动形式 伸缩振动 亚甲基: 变形振动 亚甲基
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第五节 膜分离技术.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第四节 离子交换分离法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第三节 溶剂萃取分离法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第三节 其他.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第二节 沉淀分离法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第八章 分析化学中的分离技术 第一节 概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第九节 高效毛细管电泳.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第八节 离子色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第七节 液相色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第六节 毛细管色谱法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第三节 色谱理论基础.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分析化学的分类与进展.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第二节 气相色谱仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第一节 色谱法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第四节 条件选择与定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第三节 干扰及其消除.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第二节 原子吸收分光光度仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第六章 原子吸收分析法 第一节 原子吸收分析原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第五节 有机物紫外光谱解析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第四节 分光光度测量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第九章 红外光谱分析 第二节 红外光谱仪器.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第九章 红外光谱分析 第四节 红外谱图解析示例.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十章 核磁共振波谱分析 第一节 核磁共振基本原理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十章 核磁共振波谱分析 第二节 核磁共振与化学位移.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十章 核磁共振波谱分析 第三节 自旋偶合与自旋裂分.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差与数据处理 第一节 定量分析中的误差.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十章 核磁共振波谱分析 第四节 谱图解析与结构确定.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十一章 质谱分析 第一节 基本原理与质谱仪.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十一章 质谱分析 第二节 离子峰的主要类型.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十一章 质谱分析 第三节 有机分子裂解类型.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第十一章 质谱分析 第四节 质谱图与结构解析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差与数据处理 第二节 分析结果的数据处理.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差与数据处理 第三节 数据评价方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差与数据处理 第四节 有效数字与运算规则.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第二章 定量分析中的误差与数据处理 第五节 线形方程拟合.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第一节 滴定分析法概述.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第二节 紫外可见分光光度法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第五节 定性定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第四节 分离条件选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第十节 薄板与纸层析.ppt
