《无机化学》课程PPT教学课件(E)第6章 原子结构与元素周期性

物质结构 X 第六章物质结构与元素周期性 §6-1氢原子光谱 §6-2原子的量子力学模型 §6-3原子核外电子结构 §6-4元素性质的周期性变化
§ 6-1 氢原子光谱 § 6-2 原子的量子力学模型 §6-3 原子核外电子结构 §6-4 元素性质的周期性变化 第六章 物质结构与元素周期性

物质结构 ☒ 本章重点 原子轨道及四个量子数 核外电子排布及电子排布能级图 元素性质的周期性变化, 如有效核电荷、原子半径、电离能、 电子亲和能、电负性、氧化数、金属/非金属性
原子轨道及四个量子数 核外电子排布及电子排布能级图 元素性质的周期性变化, 如有效核电荷、原子半径、电离能、 电子亲和能、电负性、氧化数、金属/非金属性 本章重点

物质结构 ☒ §4-1氢原子光谱和玻尔理论 一原子猪构理论的发展简史 ·从道尔顿到门捷列夫,化学家都相信“原子不可分”的观点,认为原子时 化学大厦的基石。 19世纪末,X射线、放射性和电子的发现打破了原子不可分的观点。 1895年,德国物理学家伦琴做阴极射线实验室发现了X射线。 1896年法国物理学家贝克勒尔研究硫酸双氧铀钾时发现了“贝克勒尔现 象”,即放射性。 ·1897年,汤姆生发现了电子,并于1904年提出“葡萄干蛋糕”型原子结构 模型 1905年,爱因斯坦提出了光子学说-光电子效应 1911年,卢瑟福提出了原子核壳层结构模型 1913年,波尔将量子化概念引入卢瑟福模型,提出波尔模型 1926年,薛定谔提出了量子力学模型
§ 4-1 氢原子光谱和玻尔理论 一 原子结构理论的发展简史 •从道尔顿到门捷列夫,化学家都相信“原子不可分”的观点,认为原子时 化学大厦的基石。 •19世纪末,X射线、放射性和电子的发现打破了原子不可分的观点。 •1895年,德国物理学家伦琴做阴极射线实验室发现了X射线。 •1896年法国物理学家贝克勒尔研究硫酸双氧铀钾时发现了“贝克勒尔现 象”,即放射性。 •1897年,汤姆生发现了电子,并于1904年提出“葡萄干蛋糕”型原子结构 模型 •1905年,爱因斯坦提出了光子学说-光电子效应 •1911年,卢瑟福提出了原子核壳层结构模型 •1913年,波尔将量子化概念引入卢瑟福模型,提出波尔模型 •1926年,薛定谔提出了量子力学模型
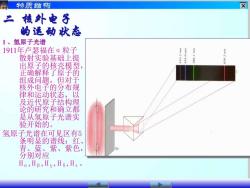
物质结构 ☒ 之 核外电子 的运动状态 1、氢原子光谱 1911年卢瑟福在a粒子 散射实验基础上提 出原子的核壳模型 正确解释了原子的 组成问题,但对于 核外电子的分布规 律和运动状态,以 及近代原子结构理 论的研究和确立都 是从氢原子光谱实 验开始的。 氢原子光谱在可见区有5 条明显的谱线:红、 月 、 蓝、紫、紫色, 别对应 Ha,HB,Hy,Hs,He
二 核外电子 的运动状态 1 、氢原子光谱 1911年卢瑟福在α粒子 散射实验基础上提 出原子的核壳模型, 正确解释了原子的 组成问题,但对于 核外电子的分布规 律和运动状态,以 及近代原子结构理 论的研究和确立都 是从氢原子光谱实 验开始的。 氢原子光谱在可见区有5 条明显的谱线:红、 青、蓝、紫、紫色, 分别对应 Hα,Hβ,Hγ,Hδ,Hε
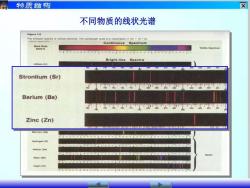
物质结构 ☒ 不同物质的线状光谱 Figure 7.6 Continuous Spectrum "e6 ible Spectrum Bright-line Spectra Strontium (Sr) Barium (Ba) Zinc (Zn) Hydrogen(H) Helium (He) Argon (Ar)
不同物质的线状光谱

物质结构 2、玻尔(Bohr)理论 1913年,丹麦年轻物理学家波尔在卢瑟 福原子模型基础上,结合普朗克和爱因 斯坦的思想,冲破就观念的束缚,提出 了氢原子结构的波尔理论,其要点如下: Bohr ()、在原子中电子不能沿着任意轨道绕 核旋转,只能在那些符合一定条件的轨 道上旋转,而且在此轨道上旋转时,不 吸收或放出能量,处于稳定态(基态)
2、玻尔(Bohr)理论 1913年,丹麦年轻物理学家波尔在卢瑟 福原子模型基础上,结合普朗克和爱因 斯坦的思想,冲破就观念的束缚,提出 了氢原子结构的波尔理论,其要点如下: (1)、在原子中电子不能沿着任意轨道绕 核旋转,只能在那些符合一定条件的轨 道上旋转,而且在此轨道上旋转时,不 吸收或放出能量,处于稳定态(基态) Bohr

物质结构 ☒ (2)、电子在不同轨道上旋转时具有不同能量,电 子运动时所处的能量状态称为能级。 电子在不同轨道上运动时所具有的能量只能取某 些不连续的数值,即电子的能量是量子化的。氢 原子原子轨道半径和能量的关系: ro=ao n2 e2 2元me 1 En =一B 2r h2n2 n2 2元me4 B= =13.6eV=2.179×10-18j h2 n为量子数,只能取正整数。 当=1 r=52.9pm E=-2.179×1018j,原子处 于激发态,n=2, 4.时,原子处于激发态
(2)、电子在不同轨道上旋转时具有不同能量,电 子运动时所处的能量状态称为能级。 电子在不同轨道上运动时所具有的能量只能取某 些不连续的数值,即电子的能量是量子化的。氢 原子原子轨道半径和能量的关系: r0=a0 n 2 e 2 2 2me4 1 En = - = - = -B 2r h2n 2 n 2 2 2me4 B = = 13.6 eV=2.179×10-18j h 2 n为量子数,只能取正整数。 当 n=1 r=52.9pm E=-2.179 ×10-18j ,原子处 于激发态,n=2,3,4.时,原子处于激发态

物质结构 (3)、电子从一个定态跳到另一个定态, 才能有能量的吸收或放出。即: E2-E,=△E=hv=hc/λ h=6.626x10-34J·S 波尔理论成功揭示了氢光谱谱线的形成和 规律性,精确程度令人震惊,波尔因此获 得1922年诺贝尔物理学奖。 波尔理论在解释类氢离子(He*,Li2+, Be3+,B4+等)尚可,但对于多电子原子 光谱不能给出满意的解释
(3)、电子从一个定态跳到另一个定态, 才能有能量的吸收或放出。即: E2 -E1 =ΔE=hν= hc / h=6.626x10-34J·S 波尔理论成功揭示了氢光谱谱线的形成和 规律性,精确程度令人震惊,波尔因此获 得1922年诺贝尔物理学奖。 波尔理论在解释类氢离子(He+ ,Li2+ , Be3+ ,B4+等)尚可,但对于多电子原子 光谱不能给出满意的解释

物质结构 ☒ 波尔理论局限性: 液尔理论不是直接由实验方法确立的,而是在 假设的基础上进行数学处理。 痘用波尔理论成功解释了氢光谱的形成和视 律性。它不能说明多电子原子的光谱,也不能说 明氨原子光谱的精细转构。 其原因在于波尔理论是建立在疫典力学的基础 上,电子是散粒它不同于在固定轨道上运动的宏 观物体,它遵循与疫典力学不同的运动规律
波尔理论不是直接由实验方法确立的,而是在 假设的基础上进行数学处理。 应用波尔理论成功解释了氢光谱的形成和规 律性。它不能说明多电子原子的光谱,也不能说 明氢原子光谱的精细结构。 其原因在于波尔理论是建立在经典力学的基础 上,电子是微粒它不同于在固定轨道上运动的宏 观物体,它遵循与经典力学不同的运动规律。 波尔理论局限性:

物质结构 §4-2原子的量子力学摸型 一、微现离子的波粒二象性 1905年爱因斯坦在普朗克量子论的启发下,提出了光子 学说,结束了二百年来对光的波动性和粒子性的争论。 用下式表示光的波粒二象性: 对于光: P=mc=hv/c=h/入 E=mc=hv 对于微观粒子:元=h/P=hmu 1. 德布罗意波(de Broglie wave1924) 德布罗意,L.V 1924年,法国物理学家德布罗意在光的波粒二象性的启发 下,提出:一切实物微粒都具有波粒二象性。 入=hP=h/mu m为实物粒子的静止质量,v为实物粒子的速度,h为普朗 克常数,P为实物粒子的动量
一、微观离子的波粒二象性 1905年爱因斯坦在普朗克量子论的启发下,提出了光子 学说,结束了二百年来对光的波动性和粒子性的争论。 用下式表示光的波粒二象性: 对于光: P = mc = h / c = h / 对于微观粒子: = h / P = h /m 1. 德布罗意波( de Broglie wave 1924) 1924年,法国物理学家德布罗意在光的波粒二象性的启发 下,提出:一切实物微粒都具有波粒二象性。 = h /P = h / m m为实物粒子的静止质量,v为实物粒子的速度,h为普朗 克常数,P为实物粒子的动量。 E = mc = hv 2 § 4-2 原子的量子力学模型
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(E)第2章 溶液(solution).ppt
- 《无机化学》课程PPT教学课件(D)第四章 沉淀反应.ppt
- 《无机化学》课程PPT教学课件(D)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(D)第三章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(D)第一章 无机化学中的计量关系.ppt
- 《无机化学》课程PPT教学课件(C)第四章 沉淀反应 Precipitation-dissolution equilibrium.ppt
- 《无机化学》课程PPT教学课件(C)第六章 原子结构和元素周期表.ppt
- 《无机化学》课程PPT教学课件(C)第八章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(C)第五章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(C)第七章 共价键和分子结构.ppt
- 《无机化学》课程PPT教学课件(C)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(C)第二章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(C)第一章 无机化学中的计量关系(石河子大学:乔秀文).ppt
- 《无机化学》课程PPT教学课件(B)第六章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(B)第七章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(B)第八章 原子结构.ppt
- 《无机化学》课程PPT教学课件(B)第四章 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(B)第五章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(B)第三章 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(B)第二章 热化学.ppt
- 《无机化学》课程PPT教学课件(E)第3章 弱电解质与酸碱平衡(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第4章 难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(E)第5章 缓冲溶液 Buffer solution(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第7章 化学平衡(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第8章 化学反应速率和限度(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第14章 s区元素.ppt
- 《无机化学》课程PPT教学课件(E)第9章 氧化还原与电极电位(药学无机化学).ppt
- 《普通化学》课程PPT教学课件(F)第一章 普通化学绪论.ppt
- 《普通化学》课程PPT教学课件(F)第三章 水化学.ppt
- 《普通化学》课程PPT教学课件(F)第二章 化学反应基本原理.ppt
- 《普通化学》课程PPT教学课件(F)第六章 元素化学与无机材料.ppt
- 《普通化学》课程PPT教学课件(F)第四章 电化学与金属腐蚀.ppt
- 《无机化学》课程PPT教学课件(G)第1章 无机计量关系(石河子大学:刘子龙).ppt
- 《无机化学》课程PPT教学课件(G)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(G)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(G)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(G)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(G)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(G)第7章 共价健和分子间力.ppt
- 《无机化学》课程PPT教学课件(G)第8章 子龙-配位化合物.ppt
