《无机化学》课程PPT教学课件(E)第8章 化学反应速率和限度(药学无机化学)

中国科学院教材建设专家委员会规划教材 全国高等医药院校规划教材 其药?药约别料系味再?中巧7制西工万 化学及应速率 主编 刘德有 刘行训 Chemistry 野丝华共法 www.sciencep.com
化学反应速率

化学反应速率 第8章化学反应速率 化学反应速率及其表示方法 反应机理和反应级数 化学反应速率理论简介 温度对化学反应速率的影响
化学反应速率 第8章 化学反应速率 反应机理和反应级数 化学反应速率理论简介 温度对化学反应速率的影响 化学反应速率及其表示方法

化学反应速率 第一节化学反应速率及其表示方法 一、化学反应速率 1平均速率 对化学反应,若在等容条件下,单位时间内反应 物的减少或生成物的增加 v=-G=±AC 单位:mol.L1.时间 t2-t1 △t
化学反应速率 一、化学反应速率 第一节 化学反应速率及其表示方法 1 平均速率 对化学反应,若在等容条件下,单位时间内反应 物的减少或生成物的增加 t c t t c c v i = − − = − 2 1 2 1 单位:mol.L-1 .时间

化学反应速率 ☒ 第1节化学反应速率及其表示方法 H202(aq)=H20)+1/202(g) t/min c(HO2)/(molL-) △c(H,02 △ /mol L-1.min) 0 0.80 20 0.40 2.0×10-2 40 0.20 1.0×102 60 0.10 2.5×10-3 80 0.05 5.0×10-3
化学反应速率 第1节 化学反应速率及其表示方法 2 2 c(H O ) t 2 2.0 10− 2 1.0 10− 3 5.0 10 − 3 2.5 10− - t/min c (H2O2 )/( mol·L-1 ) /( mol·L-1·min-1 ) 0 0.80 —— 20 0.40 40 0.20 60 0.10 80 0.05 H2O2 (aq) == H2O(l) + 1/2O2 (g)
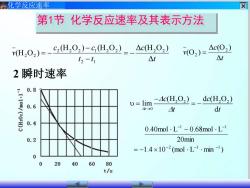
化学反应速率 第1节化学反应速率及其表示方法 H202)=- (H,02)-cH,02)-_△cH,02) △c(O2) t2-t1 △t 02)= △t 2瞬时速率 0.8 .110c02 4c(H,02=-dc(H,02 0.6 lim- 41-→0 t dt 0.4 0.40mol.L-0.68mol.L- 0.2 20min =-1.4×10-2(mol.L.min) 0 0 20 40 60 80 t/s
化学反应速率 第1节 化学反应速率及其表示方法 t c t t c c v Δ (H O ) (H O ) Δ (H O ) (H O ) 2 2 2 1 2 2 2 1 2 2 2 2 = − − − = − t c v Δ Δ (O ) (O ) 2 2 = 2 2 2 2 0 (H O ) d (H O ) lim t d c c → t t − = = − 1.4 10 (mol L min ) 20min 0.40mol L 0.68mol L 2 1 1 1 1 − − − − − = − − 2 瞬时速率
化学反应速率 ☒
化学反应速率

化学反应速率 ☒ 2瞬时速率 R-P d[P] dt 产物(P) dR] VR= dt d(P] d[R] 反应物(R) VP dt dt 时间 反应物和产物的浓度随时间的变化 在浓度随时间变化的图上,在时间t时,作交点的 切线,就得到t时刻的瞬时速率。显然,反应刚开始, 速率大,然后不断减小,体现了反应速率变化的实际情 况
化学反应速率 在浓度随时间变化的图上,在时间t 时,作交点的 切线,就得到 t 时刻的瞬时速率。显然,反应刚开始, 速率大,然后不断减小,体现了反应速率变化的实际情 况。 dt d P v dt d R v R P P R [ ] [ ] = = − → 2 瞬时速率
化学反应速率 ☒
化学反应速率

化学反应速率 ☒ 对一般化学反应: aA+bB=gG+dD 化学反应速率定义为: v-1.ddA)1dd)_1ddc)_1 ddo) a dt b dt g dt d dt 1111 a
化学反应速率 对一般化学反应: aA + bB = gG + dD 化学反应速率定义为:

化学反应速率 ☒ 第2节反应机理和反应级数 一、元反应与复合反应 1.元反应由一步完成的反应 CO(g)+H20(g)=C02(g)+H2(g) 2.复合反应:经过多步完成的反应 例: H2(g)+I2(g)=2HⅡ(g) 由两步组成:2(g)=2I(g) H2(g))+2I(g)=2HⅢ(g)
化学反应速率 第 2 节 反应机理和反应级数 1.元反应 由一步完成的反应 CO(g) + H2O (g) = CO2 (g) + H2 (g) 2 .复合反应:经过多步完成的反应 例: H2 (g) + I2 (g) = 2HI (g) 由两步组成 :I2 (g) = 2I (g) H2 (g) + 2I(g) = 2HI (g) 一、元反应与复合反应
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(E)第7章 化学平衡(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第5章 缓冲溶液 Buffer solution(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第4章 难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(E)第3章 弱电解质与酸碱平衡(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第6章 原子结构与元素周期性.ppt
- 《无机化学》课程PPT教学课件(E)第2章 溶液(solution).ppt
- 《无机化学》课程PPT教学课件(D)第四章 沉淀反应.ppt
- 《无机化学》课程PPT教学课件(D)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(D)第三章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(D)第一章 无机化学中的计量关系.ppt
- 《无机化学》课程PPT教学课件(C)第四章 沉淀反应 Precipitation-dissolution equilibrium.ppt
- 《无机化学》课程PPT教学课件(C)第六章 原子结构和元素周期表.ppt
- 《无机化学》课程PPT教学课件(C)第八章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(C)第五章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(C)第七章 共价键和分子结构.ppt
- 《无机化学》课程PPT教学课件(C)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(C)第二章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(C)第一章 无机化学中的计量关系(石河子大学:乔秀文).ppt
- 《无机化学》课程PPT教学课件(B)第六章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(B)第七章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(E)第14章 s区元素.ppt
- 《无机化学》课程PPT教学课件(E)第9章 氧化还原与电极电位(药学无机化学).ppt
- 《普通化学》课程PPT教学课件(F)第一章 普通化学绪论.ppt
- 《普通化学》课程PPT教学课件(F)第三章 水化学.ppt
- 《普通化学》课程PPT教学课件(F)第二章 化学反应基本原理.ppt
- 《普通化学》课程PPT教学课件(F)第六章 元素化学与无机材料.ppt
- 《普通化学》课程PPT教学课件(F)第四章 电化学与金属腐蚀.ppt
- 《无机化学》课程PPT教学课件(G)第1章 无机计量关系(石河子大学:刘子龙).ppt
- 《无机化学》课程PPT教学课件(G)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(G)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(G)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(G)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(G)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(G)第7章 共价健和分子间力.ppt
- 《无机化学》课程PPT教学课件(G)第8章 子龙-配位化合物.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch1 理想气体(石河子大学:周娜).ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch2 热化学.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch3 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch4 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(大连理工版)ch5 酸碱平衡.ppt
