《无机化学》课程PPT教学课件(B)第八章 原子结构

第二篇 物质结构基础 第八章原子结构 §8.1原子结构的Bohr理论 §8.2微观粒子运动的基本特征 §8.3氢原子猪物的 量子力学描述 §8.4多电子原子猪构 §8.5元素周期表 §8.6元素性质的周期性
§8.1 原子结构的Bohr理论 §8.2 微观粒子运动的基本特征 §8.3 氢原子结构的 量子力学描述 第八章 原子结构 §8.4 多电子原子结构 §8.5 元素周期表 §8.6 元素性质的周期性 第二篇 物质结构基础

§8.1原子猪构的Bohr理论 ©>8.1.1历史的回顾 >8.1. 2氢原子光谱 e 8.1.3Bohr原子结构理论 回
8.1.1 历史的回顾 8.1.3 Bohr原子结构理论 8.1.2 氢原子光谱 §8.1 原子结构的Bohr理论
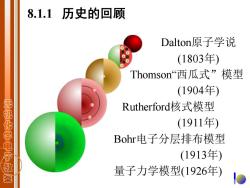
8.1.1历史的回顾 Dalton原子学说 (1803年) Thomson西瓜式”模型 (1904年) Rutherford核式模型 无机化学电子教茶 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)
8.1.1 历史的回顾 Dalton原子学说 (1803年) Thomson“西瓜式”模型 (1904年) Rutherford核式模型 (1911年) Bohr电子分层排布模型 (1913年) 量子力学模型(1926年)
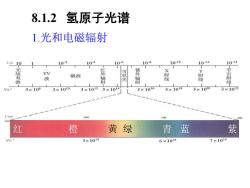
8.1.2 氢原子光谱 1.光和电磁辐射 /m10 102 104 10-6 108 10-10 10-12 10-14 TV X 微波 外 波 是 线 射 波 3×108 3×1010 3×1023×1014 3×1016 3×1018 3×1020 3×102乎 入m 600 500 100 70 红 橙 黄绿 青蓝 紫 5×1014 6×1014 7×1014
1.光和电磁辐射 8.1.2 氢原子光谱 红 橙 黄 绿 青 蓝 紫
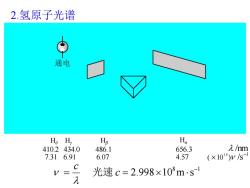
2.氢原子光谱 通电 H5 H, Ho Ha 410.2434.0 486.1 656.3 /nm 7.316.91 6.07 4.57 (×104)ys C V= 光速c=2.998×108ms1 几
2.氢原子光谱 8 1 2.998 10 m s − = c = c 光速 Hα 656.3 4.57 Hβ 486.1 6.07 Hγ 434.0 6.91 Hδ 410.2 7.31 /nm1 ( 10 ) /s 1 4 −

氢原子光谱特征: ·不连续光谱,即线状光谱 ·其频率具有一定的规律 经验公式: 无机化学电子救 -329×10( n=3,4,5,6 式中2,n,3.289×1015各代表什么意义?
• 不连续光谱,即线状光谱 • 其频率具有一定的规律 1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n= 3,4,5,6 式中 2,n,3.289×1015各代表什么意义? 经验公式: 氢原子光谱特征:

8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 无机化学电子教茶 E=hy E一光子的能量 w一光的频率 h—Planck常量,h=6.626×10-34Js
8.1.3 Bohr原子结构理论 Plank量子论(1900年): 微观领域能量不连续。 Einstein光子论(1903年): 光子能量与光的频率成正比 E=hν E—光子的能量 ν—光的频率 h—Planck常量, h =6.626×10-34J·s

Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低一基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态; 无机化学电子教 ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 hv=E2-E E:轨道能量 E2-E1 V= h
Bohr理论(三点假设): ①核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ②通常,电子处在离核最近的轨道上,能 量最低——基态;原子获得能量后,电子被 激发到高能量轨道上,原子处于激发态; ③从激发态回到基态释放光能,光的频率 取决于轨道间的能量差。 h E E h E E 2 1 2 1 − = = − E:轨道能量
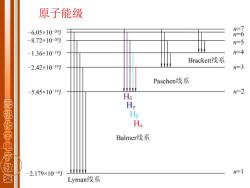
原子能级 6.05×10-20J -8.72×10-20J -1.36×101J Brackett线系 -2.42×10-19灯 Paschen线系 -5.45×1019灯 n-2 H 无机化学电子 Hp Ha Balmer线系 -2.179×1018J =1 溪 Lyman线系
原子能级

Balmer线系 v=3.289×1015(1 n=3红(H) n=4 青(HB) n=5 蓝紫(H,) 无机化学电子数 n=6紫(H) 其它线系 =-3.289×105(2- n2>n1 n n
1 2 2 1 5 )s 1 2 1 3.289 10 ( − = − n v n = 3 红(Hα) n = 4 青(Hβ ) n = 5 蓝紫 ( Hγ ) n = 6 紫(Hδ ) Balmer线系 其它线系 -1 2 2 2 1 15 )s 1 1 3.289 10 ( n n v = − n2 n1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(B)第四章 化学平衡、熵和Gibbs函数.ppt
- 《无机化学》课程PPT教学课件(B)第五章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(B)第三章 化学动力学基础.ppt
- 《无机化学》课程PPT教学课件(B)第二章 热化学.ppt
- 《无机化学》课程PPT教学课件(B)第一章 气体.ppt
- 《无机化学》课程PPT教学课件(A)第7章 分子结构.ppt
- 《无机化学》课程PPT教学课件(A)第8章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(A)第6章 原子结构.ppt
- 《无机化学》课程PPT教学课件(A)第5章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(A)第4章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(A)第3章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(A)第2章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(A)第1章 无机化学中的计量关系.ppt
- 《无机化学》课程复习试题(1-10)参考答案(工科).doc
- 《无机化学》课程复习试题(1-6)试题(工科).doc
- 《无机化学》课程试卷习题(二)试卷(10套)参考答案.doc
- 《无机化学》课程试卷习题(一)试卷(10套)试题.doc
- 《无机化学》课程试卷习题(一)试卷(10套)参考答案.doc
- 《无机化学》课程综合练习题(十一套)及参考答案.doc
- 《无机化学》课程试卷习题(二)试卷(10套)试题.doc
- 《无机化学》课程PPT教学课件(B)第七章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(B)第六章 沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(C)第一章 无机化学中的计量关系(石河子大学:乔秀文).ppt
- 《无机化学》课程PPT教学课件(C)第二章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(C)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(C)第七章 共价键和分子结构.ppt
- 《无机化学》课程PPT教学课件(C)第五章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(C)第八章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(C)第六章 原子结构和元素周期表.ppt
- 《无机化学》课程PPT教学课件(C)第四章 沉淀反应 Precipitation-dissolution equilibrium.ppt
- 《无机化学》课程PPT教学课件(D)第一章 无机化学中的计量关系.ppt
- 《无机化学》课程PPT教学课件(D)第三章 化学反应的方向、速率和限度.ppt
- 《无机化学》课程PPT教学课件(D)第三章 酸碱反应.ppt
- 《无机化学》课程PPT教学课件(D)第四章 沉淀反应.ppt
- 《无机化学》课程PPT教学课件(E)第2章 溶液(solution).ppt
- 《无机化学》课程PPT教学课件(E)第6章 原子结构与元素周期性.ppt
- 《无机化学》课程PPT教学课件(E)第3章 弱电解质与酸碱平衡(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第4章 难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(E)第5章 缓冲溶液 Buffer solution(药学无机化学).ppt
- 《无机化学》课程PPT教学课件(E)第7章 化学平衡(药学无机化学).ppt
