华南理工大学:《物理化学》课程电子教案(PPT教学课件)第6章 相平衡
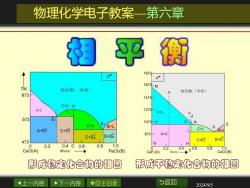
物理化学电子教案一第六章 平衡 08 1873 TIK 1673M 络化1《单相) 熔化物L(单相) 673 1473 C+LH A+L 1273 A+L 573 E1 d 1073 N C+L E A+E C+E C+L 6+H C+ES B+ES 873 A+C 47 C+E B+EC 0 G 0.2 0.4C0.6 0.8 1.0 0.4 0.8 CuCI(A) XFeCb FeCl3(B) 0.2 CaF2(A) CaCl2(B) 形成稳定化合物的相图 形成不稳定化合物的相图 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 物理化学电子教案—第六章

第六章 相平衡 §6.1 相律 §6.2 杠杆规则 §6.3单组分系统相图 §6.4二组分理想液态混合物的气-液平衡相图 §6.5二组分真实液态混合物的气-液平衡相图 §6.7二组分液态部分互溶系统及完全不互溶系统 §68二组分固态不互溶系统液-固平衡相图 §6.9 二组分固态互溶系统液-固平衡相图 §610生成化合物的二组分凝聚系统相图 上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 §6.1 相律 §6.2 杠杆规则 §6.3 单组分系统相图 §6.4 二组分理想液态混合物的气-液平衡相图 §6.5 二组分真实液态混合物的气-液平衡相图 §6.7 二组分液态部分互溶系统及完全不互溶系统 §6.8 二组分固态不互溶系统液-固平衡相图 第六章 相平衡 §6.9 二组分固态互溶系统液-固平衡相图 §6.10 生成化合物的二组分凝聚系统相图

§6.1相律 相平衡是热力学在化学领域中的重要应用之一。 研究多相系统的平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。 相图(phase diagram) 表达多相系统的状态如何 随温度、压力、组成等强度性质变化而变化的图形, 称为相图。 上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 §6.1 相律 相平衡是热力学在化学领域中的重要应用之一。 研究多相系统的平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。 相图(phase diagram) 表达多相系统的状态如何 随温度、压力、组成等强度性质变化而变化的图形, 称为相图

86.1 相律(phase rule) 相(phase) 系统内部物理和化学性质完全均匀 的部分称为相。相与相之间在指定条件下有明显 的界面,在界面上宏观性质的改变是飞跃式的。 系统中相的总数称为相数,用P表示。 气体,不论有多少种气体混合,只有一个气相。 液体,按其互溶程度可以组成一相、两相或三 相共存。 固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 §6.1 相律(phase rule) 相(phase) 系统内部物理和化学性质完全均匀 的部分称为相。相与相之间在指定条件下有明显 的界面,在界面上宏观性质的改变是飞跃式的。 系统中相的总数称为相数,用 P 表示。 气体,不论有多少种气体混合,只有一个气相。 液体,按其互溶程度可以组成一相、两相或三 相共存。 固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)

1.自由度数 自由度(degrees of freedom) 确定平衡系统的状 态所必须的独立强度变量的数目称为自由度,用字 母F表示。这些强度变量通常是压力、温度和浓 度等。例如水的气-液平衡衡时,T,只有一个可独 立可变,F=1。 如果已指定某个强度变量,除该变量以外的其它 强度变量数称为条件自由度,用表示。 例如:指定了压力,F=F-1 指定了压力和温度,F*=F-2 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 1. 自由度数 自由度(degrees of freedom) 确定平衡系统的状 态所必须的独立强度变量的数目称为自由度,用字 母 F 表示。这些强度变量通常是压力、温度和浓 度等。例如水的气-液平衡时,T,p只有一个可独 立可变,F=1。 如果已指定某个强度变量,除该变量以外的其它 强度变量数称为条件自由度,用 F*表示。 例如:指定了压力, F* = F –1 指定了压力和温度,F* = F – 2

2.相律的推导 煤油和水的饱和 蒸气 煤油 饱和硫酸铜 水溶液 冰 硫酸铜晶体 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 2. 相律的推导 饱和硫酸铜 水溶液 冰 硫酸铜晶体 煤油 煤油和水的饱和 蒸气

2.相律的推导 设有S种物质在P个相中, 描述一个相的状态要T,p,(x1,x2,.xs) (S-1)种独立含量 所以总变量数=P(S-1)+2 上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 2. 相律的推导 设有 S 种物质在 P 个相中, 描述一个相的状态要 T,p,(x1 , x2 , .xs ) (S–1)种独立含量 所以总变量数= P(S –1) + 2

2.相律的推导 在一个封闭的多相系统中,相与相之间可以有热的 交换、功的传递和物质的交流。对具有P个相系统的 热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设系统有I、川.P个相,达到 平衡时,各相具有相同温度 T=T1=.=TA (2)压力平衡条件:达到平衡衡时各相的压力相等 p=p"=.=p 上一内容 下一内容 ◇回主目录 力返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 2. 相律的推导 在一个封闭的多相系统中,相与相之间可以有热的 交换、功的传递和物质的交流。对具有P个相系统的 热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设系统有、Ⅱ······P 个相,达到 平衡时,各相具有相同温度 P T = T = = T (2)压力平衡条件:达到平衡时各相的压力相等 P p = p = = p

2.相律的推导 (3)相平衡条件:任一物质(编号为1,2,.S)在 各相(编号为I,Ⅱ,.P)中的化学势相等,相变 达到平衡,即 4(I)=4(ID=.=4(P) 42(I)=42(I0=.=42(P) 4(I)=4(ID=.=4s(P) 其中4(k)分别代表第B种物质在第相中的化学势 共SP-1)个关于各物质在各相中的浓度及T、p方程 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 2. 相律的推导 (3) 相平衡条件: 任一物质(编号为1,2,······S)在 各相 (编号为 ,Ⅱ,······P) 中的化学势相等,相变 达到平衡,即 ( ) ( ) ( ) 1 = 1 == 1 P . 共 S(P–1) 个关于各物质在各相中的浓度及T、p方程 ( ) ( ) ( ) 2 = 2 == 2 P ( ) ( ) (P) S S = = S = 其中B (k)分别代表第B种物质在第k相中的化学势

2.相律的推导 (4)化学平衡条件:化学反应(编号为1,2,.R) 达到平衡 (I)4=A,Gm()=0 ∑.(24=AG(2)=0 ∑(R4,=AGn(R)=0 共R个关于各物质在各相中的浓度及T、p方程 上一内容 下 一内容 ◇回主目录 5返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 2. 相律的推导 (4) 化学平衡条件:化学反应 (编号为1,2,······R) 达到平衡 (1) B r m (1) 0 B B = G = . 共 R 个关于各物质在各相中的浓度及T、p方程 (2) B r m (2) 0 B B = G = ( ) B r m ( ) 0 B B R = G R =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第5章 化学平衡.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第3章 热力学第二定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第2章 热力学第一定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第1章 气体的PVT关系.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)绪论.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十四章 细胞代谢和基因表达的调控.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸与蛋白质的生物合成及基因工程.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十二章 核酸的降解和核苷酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十一章 蛋白质降解及氨基酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十章 脂类代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第九章 糖代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第八章 代谢总论与生物氧化.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第七章 脂类化学与生物膜.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第六章 酶学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第五章 维生素与辅酶.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第四章 核酸的化学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第二章 糖的化学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第一章 绪论(负责人:车振明).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二十章 有机合成.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第7章 电化学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第9章 统计热力学基础.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第11章 化学动力学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第12章 胶体化学.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第一章 气体的pVT关系 The Properties of Gases(主讲:刘向荣).ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第一定律 The First Law Of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第三章 热力学第二定律 The second Law of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第四章 多组分系统热力学 Thermodynamics of Polycomponent system.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 Chemical Equilibrium.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第一章 蛋白质结构与功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第二章 核酸的结构和功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第三章 酶学.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第四章 三羧酸循环和能量代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第五章 糖代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第六章 脂类代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第七章 蛋白质代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第八章 非营养物质的代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第九章 水盐代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十章 酸碱平衡.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十一章 基因信息的储存和表达.ppt
