西安科技大学:《物理化学》课程教学资源(PPT课件)第一章 气体的pVT关系 The Properties of Gases(主讲:刘向荣)

第一章气体的pVT关系 The Properties of Gases 刘向荣 西安科技大学 化学与化工系 Department of Chemistry and Chemical Engineering Xi'an University of Science Technology
第一章 气体的 pVT关系 The Properties of Gases 西安科技大学 化学与化工系 Department of Chemistry and Chemical Engineering Xi’an University of Science & Technology 刘向荣

Brief Introduction 本章简介: 司理想气体状态方程 (The perfect gas equations) 了真实气体状态方程 (The real gas equations)
Xi’an University of Science & Technology 本章简介: 理想气体状态方程 (The perfect gas equations) 真实气体状态方程 (The real gas equations) Brief Introduction

Preface Xi'an Universit 固体 m物质的聚集状态 液体 气体 流体 四气体 无固定形状
Xi’an University of Science & Technology 物质的聚集状态 气 体 Preface 固体 液体 气体 流体 无固定形状

Preface -Physical properfies of gas 米组成,n Composition moles 米 压力,卫 Pressure -Pa 米体积,V Volume-m3 Ah 米温度,T Temperature -K
Xi’an University of Science & Technology Preface -Physical properties of gas 组成, n Composition - moles 压力, p Pressure – Pa 体积,V Volume - m3 温度,T Temperature - K

The perfect gas Xi'an Universif 理想气体两大特征: 0分子之间无相互作用力; ②分子本身不占有体积。 四接近理想气体的实际气体状态: 。低压,高温
Xi’an University of Science & Technology 1 m 1 m 1 m 一. The perfect gas 理想气体两大特征: 分子之间无相互作用力; 分子本身不占有体积。 接近理想气体的实际气体状态: 低压,高温

Gas laws mT一定,p=c,Boyle'slaw mP一定,V∝T,Charles'law mT,P一定,Vo∝n,Avogadro's principle
Xi’an University of Science & Technology h T一定,pV=c, Boyle’s law P一定,V∝T, Charles’ law T, P一定,V∝n,Avogadro’s principle Gas laws

The perfect gas equation 司理想气体状态方程 PV=ART mp pressure mV=volume ▣n=noles m T=temperature m R=universal gas contant =8.314510Jmol-l.K-1
Xi’an University of Science & Technology 理想气体状态方程 The perfect gas equation pV nRT = p = pressure V = volume n = moles T = temperature R = universal gas contant = 8.314 510 J•mol-1 •K-1

Dalton's Law 四定义:各种气体的分压之和等于总压 The total pressure is the sum of all the partial pressure. def 分压力: PB-YBD 道尔顿定律: P=>PE B
Xi’an University of Science & Technology Dalton’s Law 定义:各种气体的分压之和等于总压. The total pressure is the sum of all the partial pressure. 分压力: = B p pB p yB p def B = 道尔顿定律:

Amagart's law Xi'an Uni m定义:各种气体的分体积之和等于总体积. The total volume is the sum of all the partial volume. def 分体积: B 三 阿马加定律: V=∑ B
Amagart’s law Xi’an University of Science & Technology 定义:各种气体的分体积之和等于总体积. The total volume is the sum of all the partial volume. 分体积: = B V VB V yB V def B = 阿马加定律:
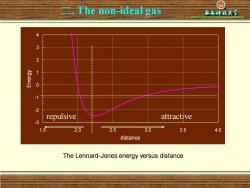
二.The non-ideal gas 3 2 1 0 -2 repulsive attractive 3 1.5 2.0 2.5 3.0 3.5 4.0 distance The Lennard-Jones energy versus distance
二 Xi’an University of Science & Technology . The non-ideal gas The Lennard-Jones energy versus distance -3 -2 -1 0 1 2 3 4 1.5 2.0 2.5 3.0 3.5 4.0 distance Energy repulsive attractive
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第12章 胶体化学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第11章 化学动力学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第9章 统计热力学基础.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第7章 电化学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第6章 相平衡.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第5章 化学平衡.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第3章 热力学第二定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第2章 热力学第一定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第1章 气体的PVT关系.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)绪论.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十四章 细胞代谢和基因表达的调控.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸与蛋白质的生物合成及基因工程.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十二章 核酸的降解和核苷酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十一章 蛋白质降解及氨基酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十章 脂类代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第九章 糖代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第八章 代谢总论与生物氧化.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第七章 脂类化学与生物膜.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第六章 酶学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第五章 维生素与辅酶.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第一定律 The First Law Of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第三章 热力学第二定律 The second Law of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第四章 多组分系统热力学 Thermodynamics of Polycomponent system.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 Chemical Equilibrium.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第一章 蛋白质结构与功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第二章 核酸的结构和功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第三章 酶学.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第四章 三羧酸循环和能量代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第五章 糖代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第六章 脂类代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第七章 蛋白质代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第八章 非营养物质的代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第九章 水盐代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十章 酸碱平衡.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十一章 基因信息的储存和表达.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十二章 细胞间信息传递——信号传导.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷1(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷2(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷3(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷4(无答案).doc
